
- •Лекция 1
- •Лекция 2
- •Отражение
- •Вращение
- •Инверсия
- •Отражение-вращение
- •Вращение-инверсия
- •Взаимодействие элементов симметрии (теоремы сложения).
- •Теорема №1
- •Обратная теорема
- •Виды симметрии кристаллов.
- •Виды симметрии кристаллов, обладающих единичным направлением.
- •Виды симметрии кристаллов без единичных направлений.
- •Лекция 4 Характеристика сингоний.
- •Обозначение плоскостей и направлений в кубических кристаллах.
- •Порядок нахождения индексов плоскостей.
- •Аспекты эквивалентности плоскостей.
- •Индексы направлений.
- •Алгоритм определения индексов направлений.
- •Определение кристаллографических индексов гексагональных кристаллов.
- •Индексы направлений
- •Лекция 5 Формулы геометрической кристаллографии.
- •Кристаллографические проекции.
- •I. Сферические координаты.
- •II. Стереографические проекции.
- •IV. Гномонические проекции.
- •Лекция 6 Решетки Бравэ
- •Теорема.
- •Симметрия внутреннего строения.
- •Плоскость скользящего отражения.
- •Винтовые оси
- •Тетрагональные кристаллы
- •Понятие о пространственной системе точек
- •Правила записи символа пространственной группы.
- •Распределение пространственных групп по классам симметрии, сингониям и категориям.
- •Лекция 8 Основы кристаллохимии.
- •Объемные характеристики кристаллического материала
- •Факторы, влияющие на кристаллическую структуру
- •Понятие о плотнейших упаковках
- •Лекция 9
- •Типичные структуры материалов используемых в микроэлектронике.
- •Структурный тип магния.
- •Основные кристаллохимические характеристики
- •Полупроводниковые соединения
- •Основные кристаллохимические характеристики
- •Лекция 11
- •Структурный тип поваренной соли (NaCl).
- •Структура цезий хлор (СsCl).
- •Структурный тип халькопирита (CuFeS2)
- •Лекция 12 Структурный тип перовскита
- •Кристаллическая структура SiO2.
- •Кристаллическая структура Al2o3.
- •Лекция 13 Полиморфизм, изоморфизм и политипия.
- •Неустойчивая устойчивая
- •Классификация полиморфных модификаций по Бюргеру
- •Классификация изоструктурных соединений пр Гримму.
- •Лекция 14 Кристаллофизика
- •Предельные группы симметрии (группы Кюри)
- •Принцип суперпозиции Кюри
- •Указательная поверхность
- •Системы координат
- •Лекция 15 Скалярные и векторные свойства кристаллов.
- •Физические свойства кристаллов, описываемых тензором второго ранга.
- •Геометрические свойства указательной поверхности.
- •Лекция 16 Оптические свойства кристаллов Двупреломление лучей
- •Дефекты в кристаллических материалах
- •Точечные дефекты
- •Межузельный атом
- •Примесные атомы
- •Комплексы точечных дефектов
- •Лекция 17
- •Дефект Френкеля (сложный).
- •Механизм Шотке или образование тепловых вакансий (при нагревании).
- •Термодинамика точечных дефектов.
- •Линейные дефекты.
- •Понятие о векторе Бюргерса.
- •Лекция 18
- •Взаимодействие дислокаций между собой
- •Метод селективного травления
- •Лекция 19
- •Методика прогнозирования формы ямки травления.
- •Двумерные дефекты (поверхностные).
- •Модели, объясняющие высокоугловые границы.
- •Дефекты упаковки (ду).
Кристаллическая структура Al2o3.
Еще ее называют - Al2O3или лейкосапфир. Используется как материал для изготовления подложек в полупроводниковых технологиях.
Модификация безводна, чистые кристаллы прозрачны и бесцветны. Если атомы Al замещаются атомами Cr, то цвет становится малиновым, получается рубин, который используется для изготовления лазеров. Если атомы Al замещаются атомами Ti, то цвет становится синим, получается сапфир, атомы Al замещаются атомами Fe, то цвет становится желтым.
Это ромбоэдрически деформированная структура поваренной соли, где позиции ионов Na и Cl замещены группой Al2О3. Двухвалентные ионы кислорода образуют приблизительно плотнейшую гексагональную упаковку с мотивом чередования слоев АВАВ, а ионы Al симметрияно заполняют 2/3 октоэдрических пустот. Это сложная структура, ей присущи винтовые оси, повторение структуры происходит через 6 слоев ионов О с шестью промежуточными слоями Al.
К Al по O =6
Лекция 13 Полиморфизм, изоморфизм и политипия.
Полиморфизм это способность элемента или химического соединения существовать в разных кристаллических формах, отличающихся по симметрии структуры и свойствам.
Аллотропия – сера моноклинная и сера ромбическая.
Термин “полиморфия” относится к химическим элементам.
При этом каждая полиморфная модификация является устойчивой фазой в соответствующих физико-химических условиях.
Переход из одной модификации в другую осуществляется при определенном соотношение между давлением и температурой.
Количество тепла, поглощаемое или выделяемое в результате полиморфного превращения, отнесенного к единице массы называется теплотой полиморфного поглощения. При это процесс полиморфного превращения из одной полиморной модификации в другую называется:
энантиотропный, если процесс обратимый;
монопропный, если процесс необратимый.
Пример:
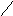
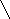
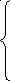 алмаз
графит (процесс
монотропный)
алмаз
графит (процесс
монотропный)
Неустойчивая устойчивая
модификация модификация
ZnS
вюрцит сфалерит (монотропный процесс)
95,50С
сера ромбиическая сера моноклинная (энатиотропный пр-сс)
5730С
-кварц-кварц (энатиотропный пр-сс)
Скорость полиморфного перехода зависит от температуры. При температурах несколько ниже температуры превращения скорость перехода устойчивой при высокой температуре формы, возрастает постепенно достигая максимума.
Из двух полиморфных модификаций устойчивой является форма с наименьшим давлением пара при данной температуре.
Переход из одной полиморфной модификации в другую всегда осуществляется при определенном соотношении температуры и давления.
На образование различных полиморфных модификаций влияют также: химический состав раствора, из которого происходит криталлизация, и наличие в нем примесей, не считая давления и температуры.
Когда осуществляется полиморфное превращение, менется тип химической связи. Полиморфные превращения с незначительным перемещением ионов, атомов и молекул называются сдвиговыми превращениями в отличие отреконструктивных превращений, связанных с возникновением совершенно новой структуры. Если образуются структуры с разными координационными числами, то существует правило:
При низких температурах и высоких давлениях устойчивой является форма с большим координационным числом. Наоборот, при высоких температурах и нормальном давлении устойчива форма сменьшим координационным числом. Возможны отклонения от правила.
ПК ОЦК ГЦК
К6 К8 К12
=0,52=0,68=0,74
При увеличении давления и уменьшения температуры идет изменение структурного типа. ZnS NaClCsCl
Понижение давления и увеличение температуры связано с образованием менее плотной упаковки.
CsCl NaClZnS
К8 К6 К4
Для полиморфных модификаций в некоторых случаях полиморфный переход связан с вращением группы атомов в кристаллической структуре, которое начинается после достижения определенной температуры.
