
- •Лекция 1
- •Лекция 2
- •Отражение
- •Вращение
- •Инверсия
- •Отражение-вращение
- •Вращение-инверсия
- •Взаимодействие элементов симметрии (теоремы сложения).
- •Теорема №1
- •Обратная теорема
- •Виды симметрии кристаллов.
- •Виды симметрии кристаллов, обладающих единичным направлением.
- •Виды симметрии кристаллов без единичных направлений.
- •Лекция 4 Характеристика сингоний.
- •Обозначение плоскостей и направлений в кубических кристаллах.
- •Порядок нахождения индексов плоскостей.
- •Аспекты эквивалентности плоскостей.
- •Индексы направлений.
- •Алгоритм определения индексов направлений.
- •Определение кристаллографических индексов гексагональных кристаллов.
- •Индексы направлений
- •Лекция 5 Формулы геометрической кристаллографии.
- •Кристаллографические проекции.
- •I. Сферические координаты.
- •II. Стереографические проекции.
- •IV. Гномонические проекции.
- •Лекция 6 Решетки Бравэ
- •Теорема.
- •Симметрия внутреннего строения.
- •Плоскость скользящего отражения.
- •Винтовые оси
- •Тетрагональные кристаллы
- •Понятие о пространственной системе точек
- •Правила записи символа пространственной группы.
- •Распределение пространственных групп по классам симметрии, сингониям и категориям.
- •Лекция 8 Основы кристаллохимии.
- •Объемные характеристики кристаллического материала
- •Факторы, влияющие на кристаллическую структуру
- •Понятие о плотнейших упаковках
- •Лекция 9
- •Типичные структуры материалов используемых в микроэлектронике.
- •Структурный тип магния.
- •Основные кристаллохимические характеристики
- •Полупроводниковые соединения
- •Основные кристаллохимические характеристики
- •Лекция 11
- •Структурный тип поваренной соли (NaCl).
- •Структура цезий хлор (СsCl).
- •Структурный тип халькопирита (CuFeS2)
- •Лекция 12 Структурный тип перовскита
- •Кристаллическая структура SiO2.
- •Кристаллическая структура Al2o3.
- •Лекция 13 Полиморфизм, изоморфизм и политипия.
- •Неустойчивая устойчивая
- •Классификация полиморфных модификаций по Бюргеру
- •Классификация изоструктурных соединений пр Гримму.
- •Лекция 14 Кристаллофизика
- •Предельные группы симметрии (группы Кюри)
- •Принцип суперпозиции Кюри
- •Указательная поверхность
- •Системы координат
- •Лекция 15 Скалярные и векторные свойства кристаллов.
- •Физические свойства кристаллов, описываемых тензором второго ранга.
- •Геометрические свойства указательной поверхности.
- •Лекция 16 Оптические свойства кристаллов Двупреломление лучей
- •Дефекты в кристаллических материалах
- •Точечные дефекты
- •Межузельный атом
- •Примесные атомы
- •Комплексы точечных дефектов
- •Лекция 17
- •Дефект Френкеля (сложный).
- •Механизм Шотке или образование тепловых вакансий (при нагревании).
- •Термодинамика точечных дефектов.
- •Линейные дефекты.
- •Понятие о векторе Бюргерса.
- •Лекция 18
- •Взаимодействие дислокаций между собой
- •Метод селективного травления
- •Лекция 19
- •Методика прогнозирования формы ямки травления.
- •Двумерные дефекты (поверхностные).
- •Модели, объясняющие высокоугловые границы.
- •Дефекты упаковки (ду).
Структура цезий хлор (СsCl).
( нет
плотнейшей упаковки)
нет
плотнейшей упаковки)
- Zs
- Cl
Решетка Бравэ – примитивная, структура состоит из
двух примитивных решеток.
ПКCsПКCl½ <111>
Структурный тип халькопирита (CuFeS2)
(или двойной сфалерит)
АIIВIVСV2
C dSnAs2
dSnAs2
- Fe
- Cu
- S
c Cu и Fe совместно в соотношении 1:1 образуют
две ГЦК, в половине тетраэдрических пустот
находятся атомы серы.
Каждый атом серы окружен тетраэдрически
двумя атомами железа и двумя меди.
a
Элементарная ячейка – тетрагональная.
При этом параметр с=2а;
0
а=3,24 А
0
с=10,3А
Ч исло
структурных единиц:
исло
структурных единиц:
n= 8*1/8+1 + 4*1/2 + 8 + 4*1/4 +6*1/2 = 164 формульные единицы
4Сu 8S 4Fe
Лекция 12 Структурный тип перовскита
Формула: CaTiO3
К этому структурному типу относятся диэлектрические фазы, обладающие в определенном интервале температур спонтанной самопроизвольной электрической поляризацией.
Соединения, изоморфные данному: BaTiO3
PbTiO3 и др.
I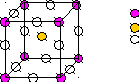 .
.
Ti
Ca
O
Рис.1
Ч исло
структурных единиц:
исло
структурных единиц:
n= 8*1/8+1+12*1/4=5 1 формульная единица.
Ti Ca O
O вместе с Ca образует плотнейшую упаковку ГЦК, в одной октоэдрической пустоте которой находится 1 атом Ti (все тетраэдрические пустоты свободны).
I I.
КO по Ca= КCa по O=12
I.
КO по Ca= КCa по O=12
К Ti по O =6
Рис.2
Элементарная ячейка — примитивная.
Кристаллическая структура SiO2.
В зависимости от температуры и давления может кристаллизоваться в разные кристаллические структуры, но все они построены из кремниево-кислородных тетраэдров, которые по-разному ориентированы в пространстве.
Пример:
1.При 14700С и нормальном давлении —кристобалит.
 2.Тригональная модификация с осью
третьего порядка (-
кварц).
2.Тригональная модификация с осью
третьего порядка (-
кварц).
O
Si
Рис.3
2 соседних тетраэдра сопрягаются вершинами.
С
5730С пленочные 14700С 17050С
-кварц кварцтридимиткристобалитрасплав.
Существуют промежуточные модификации.
В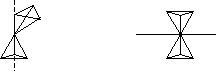 кварцететраэдры завиваются по
спирали вокруг оси третьего порядка
(рис.4).
кварцететраэдры завиваются по
спирали вокруг оси третьего порядка
(рис.4).
m
3
Рис.4 Рис.5
В тридимитепроисходит отражение тетраэдров относительно плоскости (зеркальное расположение) (рис.5).
В кристобалитепроисходит отражение (инверсионное) тетраэдров относительно точки (инверсионное расположение) (рис.6).
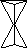
С
Рис.6
-кварц — пъезоэлектрик.
Расплав используется в микроэлектронике в качестве контейнерного материала.
-кварц: тригональная структура, устойчив при t<5730C. O-Si тетраэдры расположены в структуре на трех уровнях вследствие действия винтовых осей третьего порядка.
-кварц: гексагональная структура, атомы Si также находятся на трех уровнях (0, 1/3 С, 2/3 С), но кроме осей третьего порядка действуют оси шестого порядка, при этом различие между структурами и кварца основаны на незначительном смещении атомов Si в плоскостях, перпендикулярных вертикальной оси.
-тридимит:существует в интервале 8700С14700С, структура гексагональная, атомы Si находятся в таком же положении, как и атомы Zn и S в вюрците. Атомы О расположены на середине расстояния Si- Si.
-кристобалит:кубическая структура, существует в интервале 14700Сtпл. Атомы Si находятся в тех же положениях, что и атомы С в структуре алмаза. На половине расстояния Si- Si находятся атомы О.
