
- •Лекция 1
- •Лекция 2
- •Отражение
- •Вращение
- •Инверсия
- •Отражение-вращение
- •Вращение-инверсия
- •Взаимодействие элементов симметрии (теоремы сложения).
- •Теорема №1
- •Обратная теорема
- •Виды симметрии кристаллов.
- •Виды симметрии кристаллов, обладающих единичным направлением.
- •Виды симметрии кристаллов без единичных направлений.
- •Лекция 4 Характеристика сингоний.
- •Обозначение плоскостей и направлений в кубических кристаллах.
- •Порядок нахождения индексов плоскостей.
- •Аспекты эквивалентности плоскостей.
- •Индексы направлений.
- •Алгоритм определения индексов направлений.
- •Определение кристаллографических индексов гексагональных кристаллов.
- •Индексы направлений
- •Лекция 5 Формулы геометрической кристаллографии.
- •Кристаллографические проекции.
- •I. Сферические координаты.
- •II. Стереографические проекции.
- •IV. Гномонические проекции.
- •Лекция 6 Решетки Бравэ
- •Теорема.
- •Симметрия внутреннего строения.
- •Плоскость скользящего отражения.
- •Винтовые оси
- •Тетрагональные кристаллы
- •Понятие о пространственной системе точек
- •Правила записи символа пространственной группы.
- •Распределение пространственных групп по классам симметрии, сингониям и категориям.
- •Лекция 8 Основы кристаллохимии.
- •Объемные характеристики кристаллического материала
- •Факторы, влияющие на кристаллическую структуру
- •Понятие о плотнейших упаковках
- •Лекция 9
- •Типичные структуры материалов используемых в микроэлектронике.
- •Структурный тип магния.
- •Основные кристаллохимические характеристики
- •Полупроводниковые соединения
- •Основные кристаллохимические характеристики
- •Лекция 11
- •Структурный тип поваренной соли (NaCl).
- •Структура цезий хлор (СsCl).
- •Структурный тип халькопирита (CuFeS2)
- •Лекция 12 Структурный тип перовскита
- •Кристаллическая структура SiO2.
- •Кристаллическая структура Al2o3.
- •Лекция 13 Полиморфизм, изоморфизм и политипия.
- •Неустойчивая устойчивая
- •Классификация полиморфных модификаций по Бюргеру
- •Классификация изоструктурных соединений пр Гримму.
- •Лекция 14 Кристаллофизика
- •Предельные группы симметрии (группы Кюри)
- •Принцип суперпозиции Кюри
- •Указательная поверхность
- •Системы координат
- •Лекция 15 Скалярные и векторные свойства кристаллов.
- •Физические свойства кристаллов, описываемых тензором второго ранга.
- •Геометрические свойства указательной поверхности.
- •Лекция 16 Оптические свойства кристаллов Двупреломление лучей
- •Дефекты в кристаллических материалах
- •Точечные дефекты
- •Межузельный атом
- •Примесные атомы
- •Комплексы точечных дефектов
- •Лекция 17
- •Дефект Френкеля (сложный).
- •Механизм Шотке или образование тепловых вакансий (при нагревании).
- •Термодинамика точечных дефектов.
- •Линейные дефекты.
- •Понятие о векторе Бюргерса.
- •Лекция 18
- •Взаимодействие дислокаций между собой
- •Метод селективного травления
- •Лекция 19
- •Методика прогнозирования формы ямки травления.
- •Двумерные дефекты (поверхностные).
- •Модели, объясняющие высокоугловые границы.
- •Дефекты упаковки (ду).
Объемные характеристики кристаллического материала
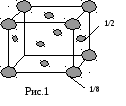
Число атомов в элементарной ячейке
Число атомов, принадлежащих элементарной ячейке, подсчитывается с учетом доли принадлежности каждого атома данной элементарной ячейке.
Структура ГЦК
( Ag,
Au, Pt, Cu, Al, Ir)
Ag,
Au, Pt, Cu, Al, Ir)
Данной ячейке принадлежит 4 атома.
Это элементарная
ячейка, в которой атомы расположены
наиболее плотно, так как, чем больше
атомов, тем упаковка плотнее.
Решетка ОЦК менее
плотно упакована.
Если атомы разногосорта, то говорят о числе не атомов, а структурных единиц.
Координационное число
Э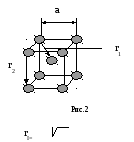 то
число ближайших однотипных соседей,
окружающих данный атом.
то
число ближайших однотипных соседей,
окружающих данный атом.
Решетка ОЦК
rI
—
ближайшее расстояние между атомами,
первая
координационная сфера. rII
— вторая координационная сфера. В
данном случае, координационное число
К8, где К — вид кристалла (кубический),
а 8 — координациционное число.
(а 3 )/2
r2=а
Плотность заполнения пространства.
Характеризуется коэффициентом заполнения пространства.
= Vат/ Vяч = (4/3*r3*nат)/ Vяч
Vат— объем, который занимают атомы.
Vяч— объем элементарной ячейки.
r — радиус атомов.
куба0,52
Пример
П К
— примитивная кубическая ячейка.
К
— примитивная кубическая ячейка.
а
а=2r
=(4/3*r3)/ 8r3=/60,52, то есть, 52 % объема заполнено атомами.
В решетке ГЦК (кубической гранецентрированной) и ГПУ (гексагональной плотно упакованной, например, Zn, Mg) =0,72
Чем больше атомов в элементарной ячейке, тем больше , тем выше координационное число, тем более плотная кристаллическая структура.
Примеры
|
ГЦК |
ГПУ |
|
=0,74 К12 n=4 |
=0,52 К6 n=1 |
Р
d*(hkl)=
етикулярная плотность плоскостей и направлений.
nат (hkl)
S(hkl)
n — число атомов плоскости
S — площадь плоскости
Пример:у алмаза (октаэдр) 8 плоскостей {111}, они наиболее плотно упакованы.
Для нахождения плоскости с наибольшей плотностью берут плоскости с малыми индексами, например (100), (110), (111) и сравнивают их ретикулярные плотности.
Пример
Р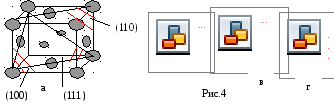 ешетка
ГЦК
ешетка
ГЦК
б
На рисунке 4б изображена плоскость (100), квадрат со стороной а, площадьюа2, принадлежность плоскости атомов в узлах — ¼, в центре — 1.
d*(100)= (4*1/4+1)/a2=2/a2
Н
 а
рисунке 4в изображена плоскость (110),
прямоугольник со сторонамиа и а2
площадьюа22,
принадлежность плоскости атомов в
узлах — ¼, в серединах сторон — ½.
а
рисунке 4в изображена плоскость (110),
прямоугольник со сторонамиа и а2
площадьюа22,
принадлежность плоскости атомов в
узлах — ¼, в серединах сторон — ½.
d
 *(110)= (4*1/4+2*1/2)/a22=2/a22
*(110)= (4*1/4+2*1/2)/a22=2/a22
Н
 а
рисунке 4г изображена плоскость (111),
треугольник со стороной а22,
площадью (а23)/2,
принадлежность плоскости атомов в
узлах — 1/6, в серединах сторон — ½.
а
рисунке 4г изображена плоскость (111),
треугольник со стороной а22,
площадью (а23)/2,
принадлежность плоскости атомов в
узлах — 1/6, в серединах сторон — ½.
d
 *(111)= ((3*1/6+3*1/2)*2)/a23=4/a23
*(111)= ((3*1/6+3*1/2)*2)/a23=4/a23
Самая большая ретикулярная плотность у последней плоскости, она наиболее плотно упакована.
Р
d*[uvw]=
nат [uvw]
L[uvw]
n — число атомов направления
L — длина направления
Пример
Решетка ОЦК
А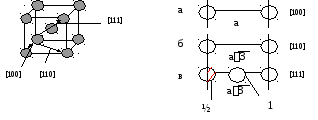 налогично
выбираем направления [100], [110], [111].
налогично
выбираем направления [100], [110], [111].
а
Рис.5
По аналогии из этих трех направлений наиболее плотно упакованное последнее.
Разность плотности упаковки вдоль плоскостей и направлений обуславливает анизотропию кристалла.
Структурный тип объединяет различные химические элементы и их соединения с одинаковым расположением атомов в пространстве и обычно носит название наиболее известного химического элемента.
Пример
ГЦК — структурный тип меди.
ОЦК — структурный тип вольфрама.
ГПУ — структурный тип магния.
