
- •Основы генетики
- •Оглавление
- •Список сокращений
- •Предисловие
- •Введение
- •I. Наследование дискретных признаков
- •1.1. Исторические этапы развития генетики
- •1.2. Законы менделя
- •1.3. Генетические методы исследования
- •2. Наследование количественных признаков
- •3. Изменчивость
- •3.1. Мутационная изменчивость
- •3.2. Наследственная предрасположенность
- •3.3. Мультифакториальные заболевания
- •4. Наследственность и здоровье
- •4.1. Формула здоровья
- •4.2. Благоприятная наследственность
- •4.3. Отягощённая наследственность
- •4.3.1. Генные заболевания
- •4.3.2. Хромосомные заболевания
- •4.3.3. Мультифакторные состояния.
- •4.3.4. Внутричерепные родовые травмы
- •Глава 5. Наследственные болезни нервной системы
- •5.1. Генные заболевания с нарушением психики
- •5.1.1. Наследственные формы интеллектуальных нарушений
- •5.1.2. Наследственные формы расстройства речи
- •5.1.3. Наследственные формы эмоционально-личностных расстройств и давиантного поведения
- •5.1.4. Наследственные формы глухоты и тугоухости
- •5.1.5. Наследственные формы слепоты и слабовидения
- •5.2. Хромосомные болезни с нарушениями психики
- •5.3. Мультифакторные состояния с нарушением психики
- •5.4. Внутричерепные родовые травмы с нарушением психики
- •6. Медико-генетическое консультирование
- •Заключение
- •Список литературы
- •Государственный стандарт Дисциплина: «основы генетики» (опд.Ф.06)
- •Рабочая программа
- •Цели и задачи дисциплины.
- •Требования к уровню освоения содержания дисциплины.
- •Объем дисциплины и виды учебной работы.
- •Содержание дисциплины.
- •4.1 Разделы дисциплины и виды занятий (Тематический план)
- •4.2. Содержание разделов дисциплины.
- •Раздел 1. Наследование дискретных признаков.
- •Раздел 2. Наследование количественных признаков. Изменчивость признаков.
- •Раздел 3. Наследственность и здоровье.
- •Раздел 4. Генные заболевания.
- •Раздел 5. Хромосомные аберрации.
- •Раздел 6. Мультифакторные состояния.
- •Раздел 7. Родовые травмы.
- •Раздел 8. Основы специальной психологии.
- •5. Лабораторный практикум не предусмотрен.
- •6. Учебно-методическое обеспечение дисциплины.
- •6.1. Рекомендуемая литература.
- •6.2. Средства обеспечения освоения дисциплины.
- •7. Материально-техническое обеспечение дисциплины.
- •8. Методические рекомендации по организации изучения дисциплины.
- •Вопросы к зачёту
- •Методические указания к оформлению реферативных работ
- •Редкие положительные мутации Генов у человека
- •Примерные темы рефератов
- •Расширенный словарь терминов
1.3. Генетические методы исследования
В современной генетике выделяют следующие научные методы исследования: клинико-генеалогический, близнецовый, цитогенетический, биохимический, молекулярно-генетический и другие.
Клинико-генеалогический метод (метод изучения родословных) предложен Ф. Гальтоном в 1865г.; заключается в исследовании патологических признаков или самой болезни в семье с указанием родословных связей между членами родословной. Такие родословные составлялись на протяжении многих столетий в отношении царствующих семей в Европе и Азии.
П
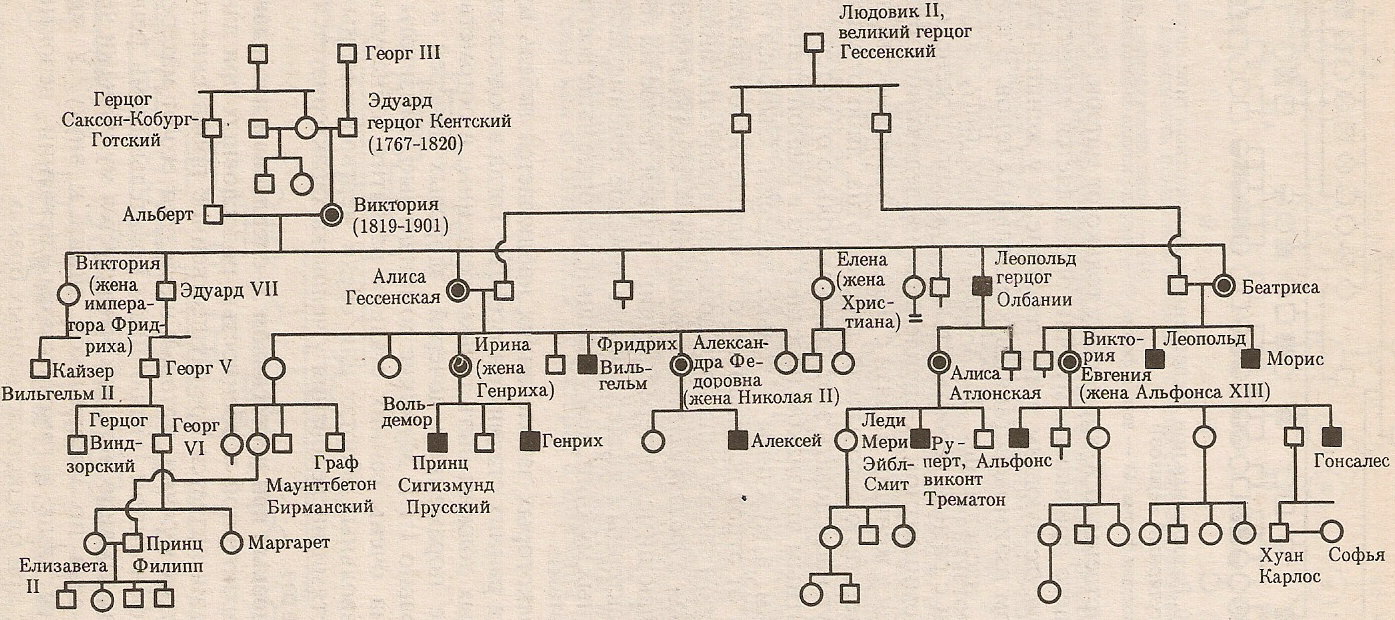
Рисунок 6. Родословная потомков английской королевы Виктории.
Однако в реальной жизни, когда семьи не ведут свои родословные, многие признаки, которые замечены у ближайших родственников, нельзя назвать наследственными, так как для доказательства требуется прослеживание характера наследования этого признака в 16 поколениях (!). Поэтому наследование большинства генных признаков доказано в экспериментах на животных. В частности, в генетике самым удобным объектом для исследования является обыкновенная мушка дрозофила, имеющая очень короткий период жизни и очень высокую плодовитость.
Близнецовый метод был предложен Ф. Гальтоном в 1875г. Замечено, что общая частота рождения двойни равна 1 : 100, тройни – 1 : 10 000, четверни – 1 : 1000 000, пятерни – 1 : 100 000 000. Из них монозиготные близнецы составляют 35 % от всех случаев. Монозиготные близнецы, развивающиеся из одной оплодотворённой яйцеклетки, генетически идентичны, так как имеют 100 % общих генов. Поэтому среди монозиготных близнецов наблюдается высокий процент конкордантных пар, в которых признак развивается у обоих близнецов. Близнецовый метод позволяет разграничивать роль наследственности и внешней среды в фенотипическом разнообразии различных признаков у человека.
При диагностике зиготности изучаемых близнецовых пар достоверность диагноза должна быть не менее 0.99. Для получения такой точности в исследовании используется метод ДНК-диагностики. Считается, что монозиготные близнецы генетически идентичны. Проживающие в одинаковых условиях однояйцовые близнецы сохраняют фенотипически близкое сходство в течение всей жизни. На рисунке показана пара однояйцовых близнецов в возрасте 4, 25, 60 и 85 лет.
Самые знаменитые монозиготные близнецы: 5 сестёр Дионн (Канада, начало ХХ века).
Дизиготные близнецы развиваются из двух различных яйцеклеток, оплодотворёнными разными сперматозоидами, и генетически сходны между собой не более, чем обычные братья и сёстры (имеют в среднем около 50 % общих генов). Монозиготные близнецы развиваются из одной яйцеклетки, оплодотворённой одним сперматозоидом; генетически идентичны.
При анализе данных близнецовых пар используется коэффициент конкордантности (КК), который указывает на относительное число пар, в которых оба партнёра несут изучаемый признак.
С
КК = ---------- ,
С + Д
где С – число сходных (конкордатнтных) пар, Д – число дисконкордантных (различающихся) пар.
При монозиготных болезнях и полной пенетрантности признака конкордантность монозиготных близнецов приближается к 100 % (например, цвет глаз, 98 %), дизиготных близнецов – 25 % при болезнях с аутосомно-рецессивным и 50 % - при болезнях с аутосомно-даминантным типом наследования.
При болезнях с наследственной предрасположенностью конкордантность может быть очень низкой, но у монозиготных близнецов в 2.5 раза выше, чем у дизиготных близнецов.
Применение близнецового метода показало, что не только морфофункциональные структуры, но и формирование ряда психологических признаков, относящихся к познавательным процессам и личностным характеристикам, находится под контролем генетических структур.
Трудности близнецового метода связаны, во-первых, с относительно низкой частотой рождения близнецов в популяции (1 : 86 – 1 : 88); во-вторых, с идентификацией монозиготности. Наиболее достоверный критерий монозиготности представляет трансплантационный тест с применением перекрёстной пересадки кожи близнецов.
Метод дерматоглифики, предложенный Я. Пуркинье в 1823г., развитый в 1892г. Ф. Гальтоном и состоящий в изучении кожного рисунка пальцев и ладоней, также позволяет идентифицировать однояйцовых близнецов. Считается, что если из 10 гомологичных пальцев рук не менее 7 имеют сходные узоры, то это указывает на однояйцовость. Сходство узоров лишь 4 – 5 пальцев свидетельствует в пользу разнояйцовости близнецов.
Цитогенетический метод основан на микроскопическом изучении хромосом в клетках человека, используется при подозрении на хромосомную болезнь; позволяет идентифицировать перестроенную хромосому, установить тип хромосомной перестройки и происхождение этой хромосомы.
Ц
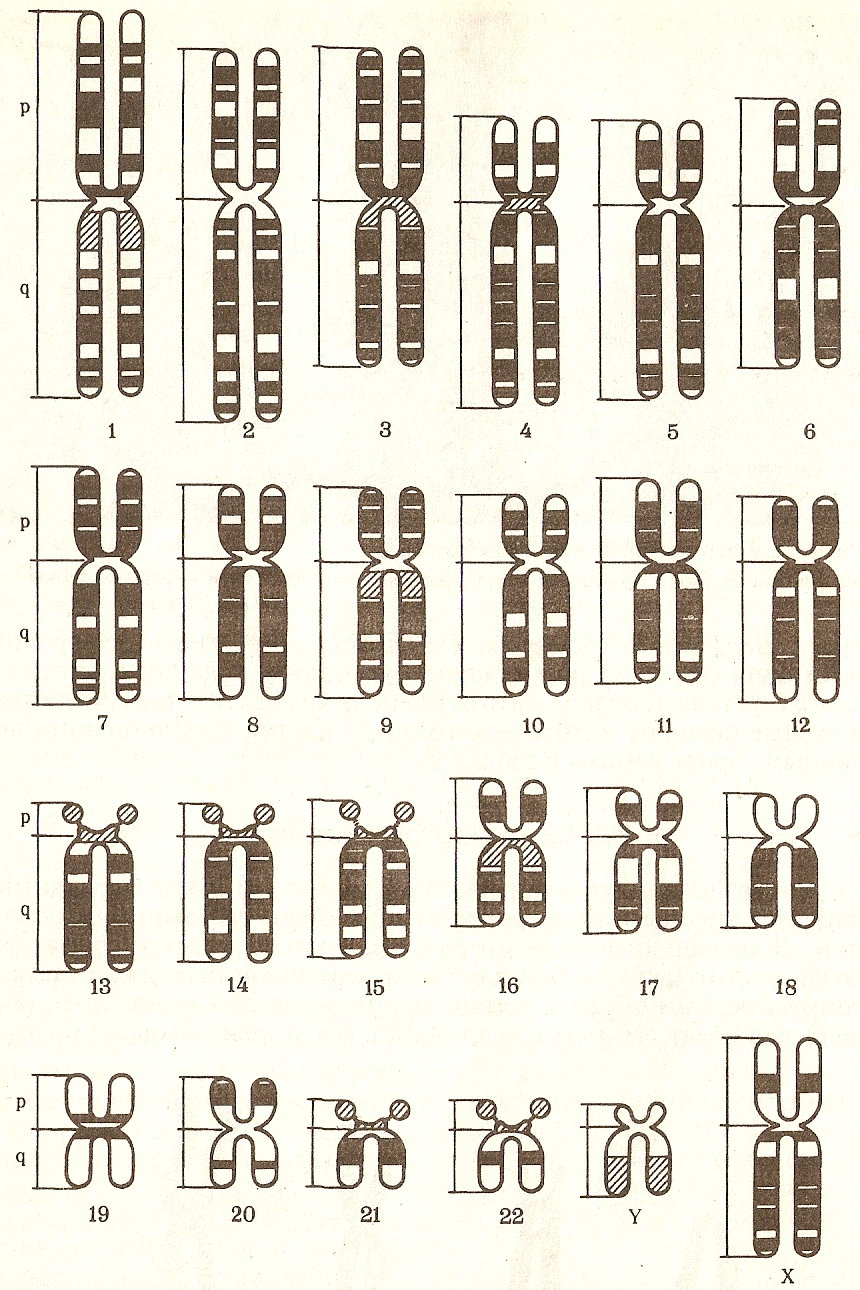
Современный этап в применении цитогенетического метода связан с. методом дифференциального окрашива-
ния хромосом (Т. Касперсон, 1969г.), который расширил возможности анализа, позволив точно идентифицировать хромосомы по характеру распределения в них окрашиваемых сегментов (рисунок 7). Применение цитогенетического метода позволяет диагностировать хромосомные болезни, изучать процессы мутагенеза на уровне хромосом и кариотипа, своевременно прерывать беременность в случае отрицательных результатов при пренатальной диагностике.
Препараты хромосом человека обычно получают из культуры лимфоцитов периферической крови (легкодоступный материал делящихся клеток), клетки костного мозга, фибробласты, клетки опухолей или берут клетки слущенного эпителия из амниотической жидкости при беременности.
Иммуногенетический метод подразумевает исследование аутоантигенов крови человека. Из 18 известных систем обычно исследуют только две – это система АВО (открыта Ландштейнером в 1900г., таблица 1) и система резус-фактора (таблица 2), по которым может наступать несовместимая с жизнью аутоиммунная реакция при беременности и переливании крови.
Таблица 1.
Система крови АВО
Фенотип |
Генотип |
О ( I ) ( α, β ) А ( II) ( β ) В (III) ( α ) АВ (IY) ( – ) |
ОО АА, АО ВВ, ВО АВ |
α, β – аутоагглютинины крови |
А, В – аутоантигены крови, О – рецессивный ген, А и В – кодоминантны |
Таблица 2.
Система крови Rh-фактора
Фенотип |
Генотип |
Rh– Rh+ |
Rh–Rh–, 15% Rh+Rh+, Rh+Rh–, 85% |
Биохимический метод используется медико-генетическими консультациями при подозрении на наследственные и врождённые дефекты обмена веществ. Например, микробиологический тест Гатри используется для обнаружения фенилкетонурии, проба Бенедикта – галактоземии и фруктозурии у новорождённых.
Биохимический анализ прогестерона. Прогестерон – стероидный женский половой гормон; синтезируется в яичнике жёлтым телом во время беременности. Когда формируется плацента, то она берёт на себя функцию выработки прогестерона до конца беременности. Этот гормон является главным протектором (стимулятором) беременности, так как основное его биологическое действие – поддержание нормотонуса маточной мускулатуры.
Дефицит прогестерона наблюдается довольно часто, особенно на ранних сроках беременности. Уровень прогестерона можно определить в содержимом мазка с задней стенки влагалища, в сыворотке крови, или определить прегнандиол в моче (метаболит прогестерона). Уровень прогестерона в течение всей беременности постоянно возрастает. Например, при ранних сроках уровень прогестерона составляет 6 – 7 нг/мл, к концу беременности – до 190 нг/мл.
Недостаточность прогестерона на ранних сроках беременности указывает на угрозу прерывания беременности (тонус матки повышен, матка начинает сокращаться, плод отслаивается). Лечение – введение прогестерона. Количество прогестерона снижено при плацентарной недостаточности до 30 – 80 %. Высокий уровень прогестерона при «большой» плаценте может наблюдаться при сахарном диабете, при многоводии.
Определение уровня эстриола – женского полового гормона производится в моче или плазме крови. Эстриол синтезируется плацентарно главным образом из предшественников. Уровень эстриола зависит от состояния плода и целости всего фетоплацентарного комплекса. В течение беременности уровень эстриола постоянно повышается. Так, в 5 – 8 недель – 0.3 – 0.4 нг/мл, в 39 – 40 недель – 65 нг/мл.
Плацентарный лактоген, хорионический соматотропин (открыт в 1961г.) – вещество белковой природы, синтезируется синцитиотрофобластом. Продукция этого гормона также повышается с увеличением срока беременности, что отражает увеличение массы плаценты. В норме на ранних сроках беременности его уровень составляет 3 ммоль/л, в конце беременности – 300 – 320 ммоль/л. Клиническую значимость представляет резкое снижение уровня гормона. Снижение его концентрации на 50 % представляет практическую угрозу для жизни плода. При снижении уровня плацентарного лактогена до 80 % наблюдается антенатальная гибель плода.
Популяционно-генетический метод изучает частоту встречаемости признака (заболевания) в общей популяции и частоту гетерозиготного носительства (таблица 3). Частота этого явления зависит от количества близкородственных браков, которые могут резко увеличить встречаемость детей с наследственными формами патологии. В нашей стране эта частота не превышает 1 %.
Таблица 3.
Частота некоторых наследственных болезней.
Генное заболевание |
Частота дефекта среди новорождённых |
Фенилкетонурия Алкаптонурия Синдром Марфана Муковисцидоз Адреногенитальный синдром Спинальная мышечная атрофия Ахондроплазия Синдром Мартина-Белла Хорея Гентингтона Болезнь Реклингаузена Альбинизм Гемофилия А Гемофилия В |
1 : 10 000 – 1 : 15 000 1 : 1 000 000 1 : 10 000 – 1 : 15 000 1 : 100 000 – 170 000 1 : 5 000 – 11 000 1 : 6 000 1 : 100 000 1 : 1 000 – 1 : 1 500 среди мальчиков 2 – 7 : 100 000 1 : 3 300 1 : 20 000 1 : 2 500 мальчиков 1 : 25 000 мальчиков |
Молекулярно-генетический метод позволяет изучить геном, наличие мутаций, делает возможной диагностику инфекционных и онкологических заболеваний, оценивает риск болезней с наследственной предрасположенностью. Молекулярно-генетический метод используется в криминалистике для установления личности человека по микроскопическим уликам, содержащим биологический материал, в пренатальной диагностике.
К настоящему времени на хромосомах человека картировано более 800 генов, мутации которых приводят к различным наследственным заболеваниям. Количество моногенных заболеваний, для которых известна локализация контролирующего гена, ещё больше и приближается к 950 за счёт существования аллельных серий, то есть групп заболеваний, клинически отличающихся друг от друга и обусловленных мутациями в одном и том же гене. Для этих заболеваний принципиально возможна пренатальная диагностика с использованием косвенных методов молекулярного анализа.
Более половины картированных генов клонировано и охарактеризовано методами молекулярного анализа. Для каждого структурного гена доказана специфичность мутационных повреждений. Причины этой уникальности кроются в особенностях первичной структуры ДНК каждого гена, его размерах, наличии прямых и обращённых повторов, присутствии внутри гена ДНК последовательностей, гомологичных внегенным участкам.
Генетические технологии привели к разработке мощных методов анализа генов и геномов. К 1996г. установлены нуклеотидные последовательности 11 разных микроорганизмов, начиная от самой маленькой автономно размножающейся микоплазмы (всего 580 000 нуклеотидных пар).
В начале XXI века молекулярно-генетическим методом удалось расшифровать геномы и более сложных организмов: мушки дрозофилы, кузнечика и человека, которые в условных единицах составили 1.0, 3.5 и 1.4 соответственно. При этом число генов, обнаруженных в геноме дрозофилы, условно приняли за 1 единицу генома. Оказалось, что весь набор генов человека чуть больше, чем у примитивной плодовой мушки. Геном кузнечика значительно объёмнее, что связано, по мнению учёных, с очень сложным движением этого насекомого. Так, для сравнения, у кузнечика более 1500 мышечных групп, и он может летать и очень сильно прыгать. У человека менее 700 разнообразных по назначению мышечных групп.
Эти факты ещё раз подтвердили мнение большинства генетиков, что геном человека содержит только видовые характеристики; его объём лимитирован конкретным количеством генов, и он не может передавать иную информацию, что очень часто приписывают наследственности.
Преимплантационная диагностика используется для диагностики фенилкетонурии, миодистрофии Дюшена-Беккера, гемофилии А и В и других наследственных заболеваний. Преимплантационная диагностика охватывает короткий период в жизни дробящейся зиготы, когда она ещё не внедрилась в стенку матки.
Пренатальная (дородовая) диагностика – одно из самых молодых и бурно развивающихся направлений современной репродуктивной медицины. Для России пренатальная диагностика актуальна, ведь каждые 16 минут умирает грудной ребёнок, каждую минуту выполняется 5 – 6 абортов, высока частота мёртворождений, гибели плодов при поздних выкидышах (27 – 28 недель).
30 лет назад началось изучение развития плода и окружающих его сред, что позволило снизить перинатальную смертность в развитых странах. При этом изучаются различные заболевания плода, находящегося в амниотическом мешке и омывающегося амниотической жидкостью.
Между плодом и жидкостью постоянно происходит обмен веществ. Установлено, что доношенный плод ежесуточно заглатывает около 450 см³ жидкости и выделяет 500 см³ мочи. Поэтому в амниотической жидкости постоянно находятся продукты обмена плода и слущивающиеся клетки его кожи и слизистых оболочек. Исследуя состояние клеточных элементов и продуктов обмена эмбриона в амниотической жидкости, можно в известной степени судить о состоянии плода, о его кариотипе и многих нарушениях обмена веществ.
О
Пренатальная диагностика позволяет ответить на вопросы: имеются ли качественные или количественные изменения в хромосомном наборе, как может повлиять обнаруженная болезнь на качество жизни будущего ребёнка, возможно ли эффективное лечение болезни после рождения малыша? Эти ответы позволяют семье осознанно и своевременно решить вопрос о дальнейшей судьбе беременности – и тем самым смягчить психическую травму, вызываемую рождением малыша с неизлечимой инвалидизирующей патологией.
К методам пренатальной диагностики относится ультразвуковой скрининг (динамическое наблюдение) развития плода, скрининг сывороточных факторов (так называемый «тройной тест») материнской крови (оба метода являются неинвазивными, так как не предусматривают хирургического вторжения в полость матки, практически безопасные для плода эти диагностические процедуры рекомендуются всем без исключения будущим мамам), амниоцентез (инвазивный метод; используется только в особых случаях).
Скрининг сывороточных факторов – известный во всём мире неинвазивный метод дородовой диагностики некоторых тяжёлых заболеваний у плода. Его часто называют «тройным» тестом, поскольку при его проведении исследуется содержание в крови беременной женщины трёх веществ: альфа-фетопротеина (АФП), хорионического гонадотропина (ХГ) и неконъюгированного эстриола (НЭ).
АФП – это вещество, которое перерабатывается печенью плода, а затем через плаценту попадает в кровь беременной женщины. В случаях, когда у плода имеются некоторые тяжёлые пороки развития, приводящие к смерти или инвалидности (черепно-мозговые или спинномозговые грыжи, называемые дефектами закрытия нервной трубки, а также не заращение передней брюшной стенки и т. д.) анализ показывает значительное повышение уровня АФП в крови матери. Например, при синдроме Дауна у плода, уровень АФП в крови матери сильно снижается.
Определённую роль в диагностике синдрома Дауна оказывает определение в крови женщины и двух других веществ – ХГ и НЭ. В случае болезни у плода они также отклоняются от нормальных величин. Иногда «тройной тест» дополняют исследованием уровня нейтрофильной щелочной фосфатазы (НЩФ) в крови матери. При синдроме Дауна у плода этот уровень выше, чем при беременности здоровым плодом.
При проведении «тройного теста» кровь для исследования чаще всего берётся из локтевой вены будущей мамы дважды: на сроке 15 недель и через 1 – 3 недели с таким расчётом, чтобы второй забор крови был не позже 20 недели беременности.
На результаты анализов оказывают влияние разные ситуации – например, беременность двойней, особенности женского организма, акушерские проблемы. Поэтому оценивает результаты анализа только врач, в каждом конкретном случае делая поправки на эти ситуации.
В развитых странах, а также в передовых регионах России все беременные женщины проходят этот тест. Его эффективность достаточно большая: 705 всех случаев синдрома Дауна и дефектов закрытия нервной трубки можно выявить на сроках 15 – 22 недели беременности. При дополнительном исследовании НЩФ процент выявления плодов с синдромом Дауна достигает 80 %. Это даёт возможность прервать беременность без особых осложнений.
Ультразвуковое сканирование или исследование (УЗИ) при беременности – это один из неинвазивных способов оценить состояние плода без вторжения в полость матки. При проведении этого исследования на поверхность живота беременной женщины устанавливается специальный датчик (трансдюсер), который испускает звуковые волны высокой частоты. По достижению тканей плода эти волны отражаются и улавливаются датчиком снова. Компьютерная обработка этих волн и формирует изображение на экране монитора.
И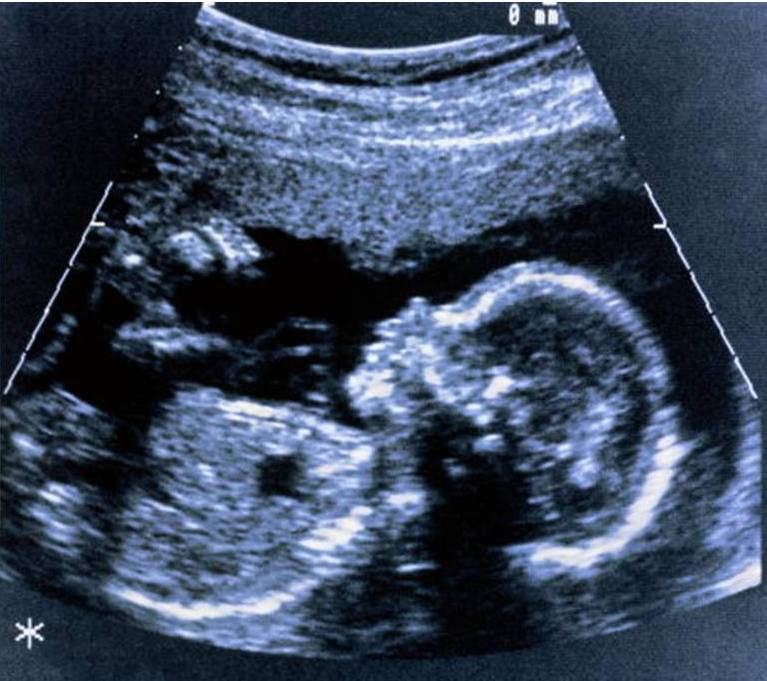 зображение
называется сонограммой
(рисунок 9).
Иногда используют датчик, который
вводится во влагалище женщины (чаще –
на ранних сроках беременности).
зображение
называется сонограммой
(рисунок 9).
Иногда используют датчик, который
вводится во влагалище женщины (чаще –
на ранних сроках беременности).
Потенциально вредное воздействие УЗИ на организм плода несопоставимо с воздействием, например, рентгеновского излучения. По крайней мере, группа экспертов ВОЗ признала четырёхкратное ультразвуковое исследование плода во время беременности безопасным. Однако необходимо помнить, что абсолютно безвредных диагностических процедур не существует в природе, поэтому УЗИ не следует часто использовать.
При помощи УЗИ можно ответить, например, на следующие вопросы: является беременность маточной или внематочной, сколько плодов находится в матке – один или несколько, каков возраст плода (срок беременности) и нет ли отставания в его развитии, имеются ли у него видимые дефекты (пороки развития), какая часть плода предлежит к выходу из таза женщины – голова или ягодицы, каков характер сердцебиения плода, пол плода, где располагается плацента и каково её состояние, каково состояние околоплодных вод, нет ли нарушений кровотока в сосудах плаценты и нет ли угрозы выкидыша?
Н еобходимо
помнить, что обязательное УЗИ плода
должна пройти каждая беременная женщина
на сроке 15 – 18 недель. Это УЗИ проводят
в женской консультации по месту жительства
(рисунок 10). Если возникает подозрение
на какой-либо дефект развития плода,
делается повторное УЗИ на сроках 22 –
23 недели, но
уже в МГК.
еобходимо
помнить, что обязательное УЗИ плода
должна пройти каждая беременная женщина
на сроке 15 – 18 недель. Это УЗИ проводят
в женской консультации по месту жительства
(рисунок 10). Если возникает подозрение
на какой-либо дефект развития плода,
делается повторное УЗИ на сроках 22 –
23 недели, но
уже в МГК.
Определить плод при помощи УЗИ можно в 4 – 5 недель, работу сердца – в 7 – 8 недель, первые движения (дыхательные) – в 11 недель, в 19 недель – глотательные движения, в 12 – 16 недель – постоянные движения головой, туловищем, конечностями. На 25 неделе можно видеть сочетание всех видов двигательной активности. Пик движения плода наблюдается между 28 и 34 неделями. К концу беременности активная двигательная функция снижается.
Отсутствие или значительное снижение двигательной активности является угрожающим признаком (антенатальная гибель плода).
УЗИ представляет собой совершенно безболезненную процедуру продолжительностью 15 – 20 минут. Для того, чтобы изображение плода на экране было более чётким, беременной женщине рекомендуется выпить примерно 1.5 л жидкости за час до исследования и не мочиться, пока сканирование не закончится (наполненный мочевой пузырь улучшает качество исследования).
Развитие генетики соматических клеток привело к появлению в конце 60-х годов пренатальной диагностики, основанной на амниоцентезе во второй трети беременности. Благодаря этой процедуре можно получить культуру эмбриональных амниотических клеток и с её помощью осуществлять цитогенетические и биохимические исследования генотипа эмбриона, определять его пол и диагностировать различные внутренние нарушения.
В
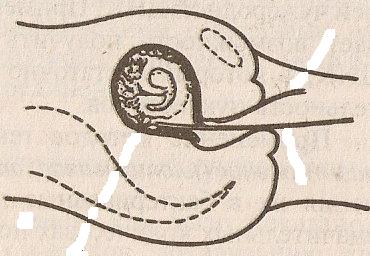
Суть этого инвазивного метода такова (рисунок 11): под контролем УЗИ в канал шейки матки беременной женщины вводится тоненькая трубочка (катетер). После соприкосновения конца катетера с хорионом в него с помощью шприца засасывается очень небольшое количество хориональной ткани. Именно эта ткань, а не ткань зародыша, исследуется в лаборатории разными методами.
Биопсия хориона даёт возможность определить наличие хромосомных (синдрома Дауна и др.) и генных заболеваний. Биопсию хориона проводят на сроках 10 – 11 недель беременности. Именно в этот срок отмечается достаточная результативность и безопасность метода. Возможны осложнения после проведения этой процедуры (до 5 %): выкидыши, инфицирование плода и кровотечение у женщины. Однако, главное достоинство биопсии хориона заключается в том, что диагноз тяжёлой инвалидизирующей болезни у плода можно установить в период до 12-ой недели беременности. На этом сроке прерывание беременности (аборт) происходит с меньшим количеством осложнений для женщины
Разработка метода фетоскопии сделала возможной пункцию сосудов плода для диагностики гемоглобинопатий и даже визуальное выявление некоторых пороков развития эмбриона. К арсеналу методов диагностики добавился ультразвуковой метод исследования плаценты и выявления фенотипических аномалий плода.
Кордоцентез и плацентоцентез. Это также методы инвазивной дородовой диагностики. Техника их проведения универсальна: прокол иглой передней брюшной стенки беременной женщины и под контролем ультразвукового аппарата взятие кусочка плаценты (при плацентоцентезе) или пуповинной крови плода (при кордоцентезе).
Диагностические возможности кордоцентеза несколько больше, чем плацентоцентеза. И тот, и другой методы позволяют диагносцировать синдром Дауна и другие болезни, связанные с изменением количества хромосом, а при наличии молекулярно-генетической лаборатории – и многие генные болезни.
Осложнение после кордоцентеза и плацентоцентеза бывают очень редко. Это существенное достоинство данных методов. Недостатком является большой срок беременности, на котором эти исследования проводятся. В случае подтверждения диагноза грубой патологии, прерывание беременности в этот срок требует длительной госпитализации женщины и чревато осложнениями, вплоть до потери возможности иметь детей.
Большое значение имеет ДНК-диагностика рака, позволяющая это грозное заболевание обнаружить на самых ранних стадиях развития, и резко увеличивает вероятность излечения от этого смертельно опасного заболевания. Так, разработана и успешно применяется диагностическая система по анализу химерного гена ber/abl, присутствующего в филадельфийской хромосоме.
Генная инженерия – это метод биотехнологии, который занимается исследованиями по перестройке генотипа. Генная инженерия позволяет переносить генетическую информацию от одного организма другому. Перенос генов даёт возможность преодолевать межвидовые барьеры и передавать отдельные наследственные признаки одних организмов другим.
Изменения генов, прежде всего, связано с преобразованием химической структуры ДНК. Информация о структуре белка, записанная в виде последовательности нуклеотидов, реализуется в виде последовательности аминокислот (АК) в синтезируемой молекуле белка. Изменение последовательности нуклеотидов в хромосомной ДНК, выпадение одних и включение других нуклеотидов меняют состав образующихся на ДНК молекулы РНК, а это, в свою очередь, обуславливает новую последовательность АК при синтезе. В результате в клетке начинает синтезироваться новый белок, что приводит к появлению у организма новых свойств.
Наиболее распространённым методом генной инженерии является метод получения рекомбинантных, т.е. содержащих чужеродный ген, плазмид. Плазмиды представляют собой кольцевые двухцепочечные молекулы ДНК, состоящие из нескольких тысяч пар нуклеотидов. Этот процесс включает несколько этапов: рестрикции, лигирования, трансформации и скрининга.
Рестрикция – разрезание ДНК на фрагменты. Лигирование – фрагмент с нужным геном включают в плазмиды и сшивают их. Трансформация – введение рекомбинантных плазмид в бактериальные клетки. Трансформированные бактерии при этом приобретают определённые свойства. Каждая из трансформированных бактерий размножается и образует колонию из многих тысяч потомков – клон. Скрининг – отбор среди клонов трансформированных бактерий тех, кто несёт нужный ген. Весь этот процесс называется клонированием. С помощью клонирования можно получить более миллиона копий любого фрагмента ДНК человека или другого организма.
Введя в генотип кишечной палочки ген из генотипа человека, контролирующий синтез инсулина, учёные добились получения инсулина при посредстве такой кишечной палочки.
В XX веке благодаря методам генной инженерии появились первые клонированные живые объекты. Русский учёный Георгий Лопашов впервые клонировал амфибии уже в середине XX века, но его опыты остались без внимания, как и опыты других советских учёных по клонированию мышей.
Первый
удачный опыт клонирования крупного
млекопитающего (

Учёные Техасского университета смогли методами генной инженерии продлить жизнь нескольких типов человеческих клеток. Обычно клетка умирает, пережив около 7 – 10 процессов деления, а они добились 100 делений клетки. Старение, по мнению этих учёных, происходит из-за того, что клетки при каждом делении теряют теломеры, молекулярные структуры, которые располагаются на концах всех хромосом. Учёные имплантировали в клетки открытый ими ген, отвечающий за выработку теломеразы, тем самым сделав эти клетки бессмертными.
В настоящее время активно разрабатывается метод клонирования человека, который позволит сделать генетический аналог любого живущего человека на Земле. Однако человечество ещё не определилось, надо ли это делать. Но зато совершенно очевидно, что этот метод имеет очевидные медицинские перспективы, так как позволяет клонировать внутренние органы и пересаживать их по медицинским показаниям, как самому донору клеток, так и любому другому человеку.
Наряду с положительными сторонами генной инженерии, нельзя забывать и об отрицательных последствиях её применения. Новые микроорганизмы могут приобрести необычную патогенность или резистентность к известным лекарствам.
Хромосомная инженерия – конструирование хроматина (сборка нуклеосом из ДНК и гистонов, более сложных структур) и целых хромосом. Уже синтезирована, например, хромосома дрожжей со всеми регуляторными структурами.
Геномная инженерия – это создание нового генома в клетке.
Специалистами по эмбриональной инженерии за последнее время были достигнуты значительные успехи в области искусственного оплодотворения в пробирке и методики имплантации эмбриона. Сейчас уже всем известны «дети из пробирки», которые нормально растут и развиваются. Метод позволяет решить проблему стерильности супругов.
Бурный расцвет переживает иммунная инженерия. Получены гибридные клетки путём слияния клетки миеломы, способной к беспредельному размножению, с лимфоцитом иммунизированного животного, который вырабатывает антитела против определённого антигена.
Синтез и введение в организм искусственных генов представляет колоссальные возможности для исправления ошибок природы: можно будет навсегда избавиться от половины врождённых пороков развития сердца, костно-мышечной системы, человек сможет планомерно управлять эволюцией биологических видов, многократно ускоряя и упрочивая этот пока стихийный процесс.
