
- •Химия и технология гомогенного катализа Конспект лекций Москва 2012
- •Предисловие
- •Общие проблемы катализа
- •1.1 Краткая история открытия каталитических реакций и теории катализа
- •Краткая история открытия каталитических реакций
- •1.2 Теории катализа
- •1.3 Классификации каталитических процессов и катализаторов
- •1.3.1 Классификация каталитических процессов
- •1.3.2 Классификации катализаторов
- •2. Выбор катализаторов
- •2.1 Современное содержание термина «активация»
- •2.1.1 Классификация комплексов
- •Карбеновые комплексы:
- •Карбиновые комплексы
- •2.2 Активация молекул
- •2.2.1 Молекула водорода
- •2.2.2 Молекула монооксида углерода
- •2.2.3 Активация алкенов и алкинов
- •2.2.3.1 Реакции координированных алкенов
- •2.2.3.2 Реакции координированных алкинов
- •2.2.4 Активация полярных молекул
- •2.3 Проблема выбора катализатора и возможные пути ее решения
- •2.3.1 Эмпирический подход.
- •2.3.2 Полуэмпирический метод.
- •2.3.3 Теоретический подход.
- •2.4 Требования к промышленным катализаторам
- •2.4.1 Активность (производительность)
- •2.4.2 Селективность.
- •2.4.3 Стабильность.
- •2.4.4 Наличие методик регенерации и утилизации
- •2.4.5 Воспроизводимость.
- •2.4.6 Экологичность.
- •2.4.7 Экономичность.
- •Технология гомогенного катализа
- •Методы приготовления и исследования гомогенных катализаторов
- •3.1 Приготовление гомогенных катализаторов
- •3.2 Методы исследования гомогенных катализаторов и процессов с их участием
- •3.2.1 Дифракционные методы
- •3.2.2 Электронографический анализ (эга)
- •3.2.3 Спектроскопические методы.
- •3.2.4 Масс-спектрометрия
- •Технология синтеза и разделения реакционных систем на основе гомогенных катализаторов
- •4.1 Выбор реактора
- •4.2 Методы разделения катализаторов и продуктов, используемые для гомогенно-каталитических реакционных систем
- •4.2.1. Выделение наиболее ценных компонентов каталитической системы (чаще всего благородных металлов).
- •4.2.2 Выделение продуктов гомогенно-каталитической реакции.
- •4.3 Гидроформилирование алкенов (Оксосинтез)
- •4.3.1 Схемы с термической декобальтизацией (выделение кобальта в виде металла на поверхности твердой фазы носителя)
- •4.3.2 Солевые схемы (выделение металла в виде соли за счет экстракции)
- •4.3.3 Испарительные схемы (отделение продуктов за счет отгонки )
- •Оксосинтез в двухфазных системах вода-органический растворитель
- •4.4 Технология производства ацетальдегида
- •4.4.1 Механизм и кинетика Вакер-процесса.
- •4.4.2 Технология получения ацетальдегида
- •4.5 Технология производства уксусной кислоты.
- •4.6 Технология производства высших олефинов фирмы Шелл (shop process)
- •4.6.1 Олигомеризация
- •4.6.2 Гидроформилирование
- •4.6.3 Изомеризация
- •4.6.4 Метатезис
- •4.6.5 Технология shop процесса
4.4.1 Механизм и кинетика Вакер-процесса.
Общепринятый механизм Вакер-процесса, основной вклад в изучение которого внесла группа И.И. Моисеева, включает стадии замещения анионов хлора в тетрахлорпалладате на этилен и воду с последующим депротонированием координированной в транс-положении к этилену воды.
PdCl42- + C2H4 ↔ PdCl3(C2H4)- + Cl-
PdCl3(C2H4)- + H2O ↔ PdCl2(H2O)(C2H4) + Cl-
PdCl2(H2O)(C2H4) + H2O ↔ PdCl2(OH)(C2H4)- + H3O+
Далее в зависимости от разных обстоятельств возможны два варианта механизма лимитирующей стадии. Первый – изомеризация π-комплекса PdCl2(OH)(C2H4)-, имеющего транс-строение, в π-комплекс цис-строения с последующей внутримолекулярной нуклеофильной атакой гидроксильного лиганда на углерод этилена (цис-присоединение, внедрение этилена по связи Pd-O) с образованием σ-палладий-органического соединения σ1.

Второй вариант предполагает нуклеофильную атаку воды на углерод этилена из раствора с образованием того же соединения σ1.

Распад σ1 приводит к образованию ацетальдегида и восстановленной формы палладия.
σ1→ CH3CHO + Pd(0)+ HCl + Cl-
Кинетическое уравнение, соответствующее приведенному механизму, описывает закономерности процесса при низких концентрациях палладия ([Pd]<0.04 моль/л). Торможение скорости образования ацетальдегида при увеличении концентрации хлорид-иона (в квадрате) и протона связано с наличием в механизме квазиравновесных стадий, включающих выделение этих частиц (см. выше).
R= k[Pd][C2H4] / [H+][Cl-]2
При более высоких концентрациях палладия механизм принципиально не изменяется, но появляются димерные комплексы Pd(II) и еще один маршрут образования ацетальдегида с их участием.
4.4.2 Технология получения ацетальдегида
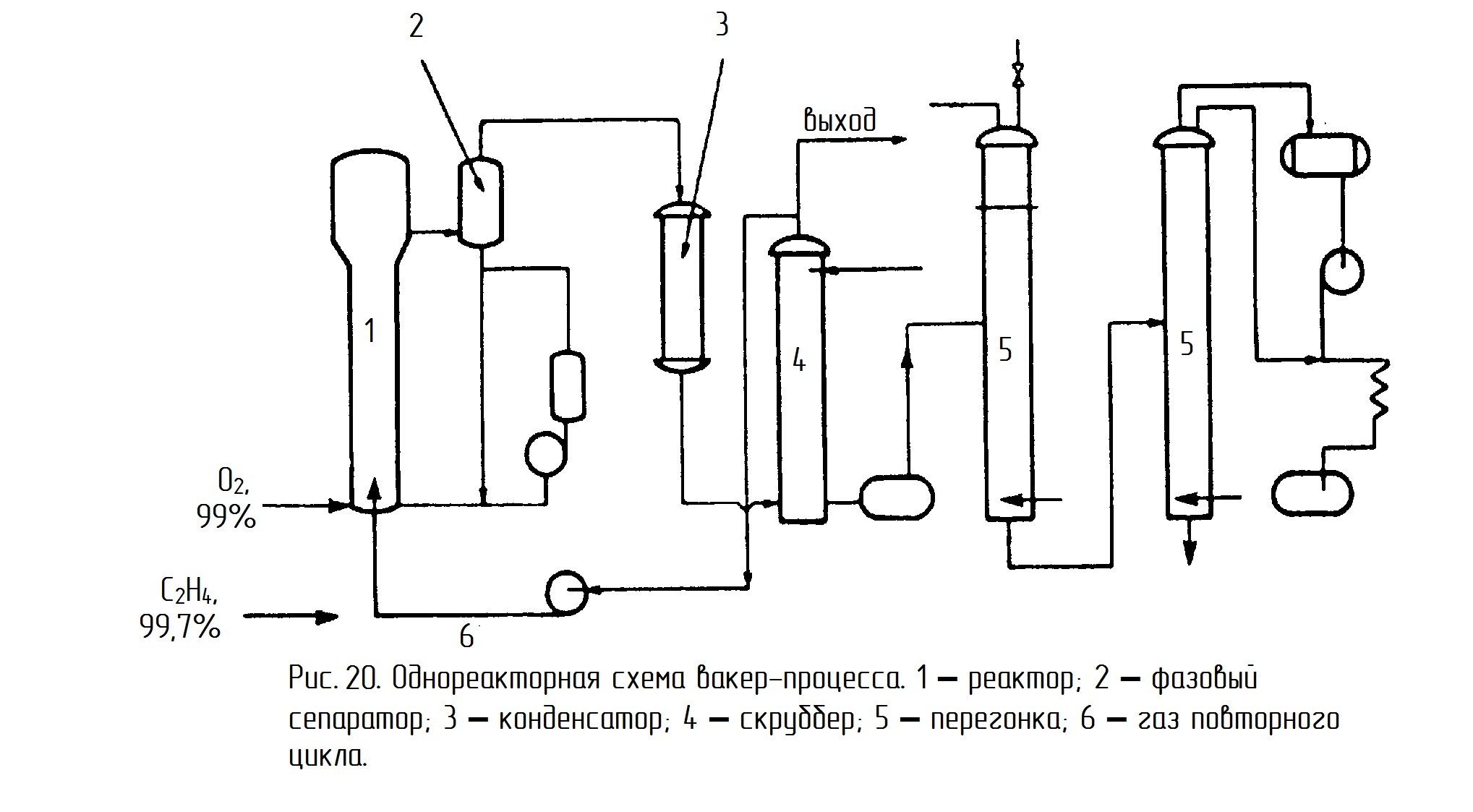
Существует два технологических варианта проведения этого процесса – двухреакторный и однореакторный. В случае двухреакторной схемы в одном реакторе проводят первую и вторую реакции из вышеприведенных трёх (с. 83), а во втором реакторе - реакцию реокисления меди кислородом воздуха (рис. 19). В случае однореакторной схемы все три реакции протекают в одном аппарате (рис. 20).
В Советском Союзе (России) была реализована только двухреакторная схема. Процесс в этом случае проводят при 100-110º и 1 МПа. Этилен и водный раствор солей палладия и меди подают в реактор типа «труба в трубе» 3 (рис. 19), который содержит инертную насадку для увеличения межфазной поверхности газ-жидкость. После реактора 3 контактный раствор вместе с реакционными газами поступает в отпарную колонну 4. Газовая фаза из колонны 4 (органические продукты) попадает в ректификационную колонну 5. Кубовый продукт колонны 5 используют для орошения колонны 4. Жидкую фазу из колонны 4 (водный слой) перекачивают в реактор 1, в котором происходит реокисление солей меди воздухом. Регенерированный каталитический раствор через фазовый сепаратор 2 поступает в реактор 3. Часть раствора из фазового сепаратора 2 отводится в регенератор 10, в котором под воздействием хлористого водорода при 150º происходит разложение труднорастворимых оксалатов меди и палладия (щавелевая кислота – один из побочных продуктов). Это необходимо для поддержания активности катализатора. Газовая фаза из сепаратора 2 поступает в скруббер 7, орошаемый, как и скруббер 6, кубовым продуктом из колонны 5. В скруббере 6 промывается несконденсировавшийся газ с верха колонны 5. Конденсат из колонны 5, содержащий ацетальдегид, через холодильник поступает на ректификацию в колонну 8 для отделения лёгких побочных продуктов (диоксид углерода, хлористый метил, хлористый этил), а затем в колонну 9 для отделения более высококипящих продуктов (хлорацетальдегид, уксусная и щавелевая кислоты). Тепло реакции (52 ккал/моль) используется для обогрева колонны 4.
Основной проблемой этого варианта является большое количество аппаратов, через которые циркулирует коррозионноактивный контактный раствор. Реакторы 1, 3, 10, сепаратор 2, насосы, коммуникации необходимо изготавливать из дорогих коррозионностойких материалов (титановых сплавов). Еще одним недостатком двухреакторной схемы является низкая производительность (~7 г/л·час). Преимущество двухреакторной схемы над однореакторной – безопасность, поскольку этилен и кислород не контактируют между собой.

Альтернативная схема (рис. 20) использует один реактор, содержащий контактный раствор, в который подают высокочистые этилен и кислород. Процесс проводят при 120-130º и 0,3 МПа. Тепловой эффект снимают за счет испарения части воды. Убыль воды восполняется. Газообразные продукты, пройдя фазовый сеператор 2 и холодильник 3, поглощаются в скрубберах 4. Непрореагировавший этилен в избытке которого проводят процесс (выше верхнего предела взрываемости) рециркулируют обратно в реактор 1. Ацетальдегид очищают ректификацией в колоннах 5.
Достоинства однореакторной схемы:
1) Мало аппаратов соприкасается с контактным раствором.
2) Производительность выше, чем в 2-х реакторном варианте.
Недостатки:
1) Необходимость использования чистого кислорода и этилена из-за рециркуляции газа.
2) Большой расход энергии на рециркуляцию газа.
3) Взрывоопасность.
4) Потери части этилена из-за отдувки газа из рецикла.
Результаты сравнения показателей процессов получения ацетальдегида, проведенного во ВНИИОС, представлены в таблице 13 (затраты на двухреакторный вариант приняты за 100%). Из этих данных следует, что однореакторная схема обладает существенными преимуществами перед двухреакторным вариантом и в отношении капитальных вложений, и по себестоимости ацетальдегида. Только потенциальная взрывоопасность ставит под сомнение целесообразность использования однореакторной схемы. Данные, приведенные в той же таблице и относящиеся к технологии получения ацетальдегида из ацетилена, свидетельствуют о неконкурентоспособности этого варианта в основном из-за высокой стоимости сырья и несоответствия экологическим требованиям.
Таблица 13
Сравнение показателей процесов получении ацетальдегида окислением этилена для однореакторной и двухреакторной схем и гидратацией ацетилена (по данным ВНИИОС)
Схема |
Степень превра-щения, % |
Селектив-ность образов. ацетальд., % |
Производи-тельность, г/л•час |
Себесто-имость, % |
Капитальн. вложения, % |
Сточные воды,% |
Привед. затраты,% |
|
|
С2Н4 |
О2 |
|
|
|
|
|
|
2-х реакт-ая |
98 |
92 |
93 |
7 |
100 |
100 |
100 |
100 |
1-но реакт-ая |
98 |
99 |
95 |
15-16 |
82 |
50 |
12 |
72 |
Из С2Н2 |
|
|
|
|
300 |
45 |
5000 |
|
