
- •Химия и технология гомогенного катализа Конспект лекций Москва 2012
- •Предисловие
- •Общие проблемы катализа
- •1.1 Краткая история открытия каталитических реакций и теории катализа
- •Краткая история открытия каталитических реакций
- •1.2 Теории катализа
- •1.3 Классификации каталитических процессов и катализаторов
- •1.3.1 Классификация каталитических процессов
- •1.3.2 Классификации катализаторов
- •2. Выбор катализаторов
- •2.1 Современное содержание термина «активация»
- •2.1.1 Классификация комплексов
- •Карбеновые комплексы:
- •Карбиновые комплексы
- •2.2 Активация молекул
- •2.2.1 Молекула водорода
- •2.2.2 Молекула монооксида углерода
- •2.2.3 Активация алкенов и алкинов
- •2.2.3.1 Реакции координированных алкенов
- •2.2.3.2 Реакции координированных алкинов
- •2.2.4 Активация полярных молекул
- •2.3 Проблема выбора катализатора и возможные пути ее решения
- •2.3.1 Эмпирический подход.
- •2.3.2 Полуэмпирический метод.
- •2.3.3 Теоретический подход.
- •2.4 Требования к промышленным катализаторам
- •2.4.1 Активность (производительность)
- •2.4.2 Селективность.
- •2.4.3 Стабильность.
- •2.4.4 Наличие методик регенерации и утилизации
- •2.4.5 Воспроизводимость.
- •2.4.6 Экологичность.
- •2.4.7 Экономичность.
- •Технология гомогенного катализа
- •Методы приготовления и исследования гомогенных катализаторов
- •3.1 Приготовление гомогенных катализаторов
- •3.2 Методы исследования гомогенных катализаторов и процессов с их участием
- •3.2.1 Дифракционные методы
- •3.2.2 Электронографический анализ (эга)
- •3.2.3 Спектроскопические методы.
- •3.2.4 Масс-спектрометрия
- •Технология синтеза и разделения реакционных систем на основе гомогенных катализаторов
- •4.1 Выбор реактора
- •4.2 Методы разделения катализаторов и продуктов, используемые для гомогенно-каталитических реакционных систем
- •4.2.1. Выделение наиболее ценных компонентов каталитической системы (чаще всего благородных металлов).
- •4.2.2 Выделение продуктов гомогенно-каталитической реакции.
- •4.3 Гидроформилирование алкенов (Оксосинтез)
- •4.3.1 Схемы с термической декобальтизацией (выделение кобальта в виде металла на поверхности твердой фазы носителя)
- •4.3.2 Солевые схемы (выделение металла в виде соли за счет экстракции)
- •4.3.3 Испарительные схемы (отделение продуктов за счет отгонки )
- •Оксосинтез в двухфазных системах вода-органический растворитель
- •4.4 Технология производства ацетальдегида
- •4.4.1 Механизм и кинетика Вакер-процесса.
- •4.4.2 Технология получения ацетальдегида
- •4.5 Технология производства уксусной кислоты.
- •4.6 Технология производства высших олефинов фирмы Шелл (shop process)
- •4.6.1 Олигомеризация
- •4.6.2 Гидроформилирование
- •4.6.3 Изомеризация
- •4.6.4 Метатезис
- •4.6.5 Технология shop процесса
2.2 Активация молекул
В катализе часто применяют термин “активация”, понимая под этим повышение реакционной способности реагентов. Попытаемся наполнить этот термин конкретным физическим содержанием. Под активацией субстрата будем понимать степень и характер воздействия катализатора на субстрат, приводящего к превращению первичного комплекса в промежуточное соединение, содержащее в координационной сфере реакционноспособные фрагменты субстрата. Анализ имеющихся данных о влиянии координации на физические свойства лигандов и о реакциях координированных лигандов позволяет понять наиболее существенные черты механизма активации каждой молекулы.
Рассмотрим современные представления о механизме активации молекул веществ, используемых в качестве реагентов органического синтеза, комплексами переходных металлов. Механизмы активации молекул различного типа кислотными катализаторами рассмотрены ранее.
Сущность активации заключается в изменении определенных характеристик субстратов при образовании первичного комплекса с катализатором.
Катализатор + субстрат Х1 Х2 ….. Хn P + Kатализатор
При образовании первичного комплекса возможны два варианта
Образуется очень прочный комплекс между субстратом и катализатором. Субстрат в таком комплексе оказывается менее реакционноспособным, чем в свободном виде.
В первичном комплексе происходит изменение характеристик субстрата в желательном направлении: изменение валентных углов, понижение частоты валентных колебаний и удлинение связей. Реакционная способность увеличивается.
Иногда в результате комплексообразования происходит настолько сильное изменение характеристик связей в субстрате, что происходит расщепление субстрата на фрагменты, часть которых или все могут оказаться в координационной сфере комплекса. В качестве примера такого воздействия координации на достаточно прочную молекулу можно рассматривать комплексы молекулярного водорода.
2.2.1 Молекула водорода
Проблема активации этой молекулы важна т.к. водород один из основных реагентов НХС и ООС (гидрообработка, гидрогенолиз, гидрирование ненасыщенных соединений, синтезы из синтез-газа).
Молекула Н2 – слабый донор (IH2= 15,4 эВ) и слабый акцептор (FH2= -0,7 эВ).
Рассмотрим возможности активации этой молекулы с точки зрения теории МО. Энергия диссоциации связи Н-Н зависит от заселенности орбиталей электронами (табл. 4).
Таблица 4
Энергия диссоциации связи Н-Н в зависимости от заселенности орбиталей
Частица |
ЕD, кДж/моль |
LH-H, Å |
Н2 |
430,5 |
0,74 |
Н2+ |
259,2 |
1,07 |
Н2 - |
17,14 |
0,86 |
*

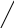
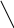
Н
Н

Р
Из приведенной таблицы и диаграммы МО следует, что есть два пути активации водорода: а) уменьшение заселенности связывающей орбитали, б) увеличение заселенности разрыхляющей орбитали.
Хотя сродство Н2 к Н+ довольно велико (в газовой фазе НО = -322кДж/моль) активация протоном молекулы Н2 (вариант а) оказалась возможной только в растворе суперкислоты SbF5- HF в апротонных средах (SO2, SO2ClF ), cудя по реакциям дейтерообмена и орто-пара конверсии. Вариант б оказался более простым. Активация водорода легко осуществляется основаниями (ОН-, КNH2, К ). Промотирование электронов на разрыхляющую орбиталь водорода является решающим фактором активации (К+Н2-).
Первичные комплексы для водорода были получены примерно в 1980 г. Первым из них был (CO)3W(P i-Pr3)2(2-H2), структура которого представляет собой октаэдр с молекулой водорода, занимающей одно координационное место в экваториальной плоскости вместе с тремя карбонилами. Длина связи Н-Н составляет 0,84 Å (сравните с данными табл. 4). В аналогичном комплексе иридия Ir(H)2(2-H2)(P(C6H11)3)2 наблюдается быстрый обмен между координированным молекулярным водородом и гидридными лигандами.
В большинстве случаев первичные η2-комплексы не удаётся зафиксировать, и активация Н2 приводит к разрыву связи в молекуле водорода. Два основных направления превращения водорода при взаимодействии с комплексами переходных металлов.
В случае комплексов металлов в высоких степенях окисления с преобладанием акцепторных свойств происходит гетеролитический разрыв связи в водороде (электрофильное замещение Н+ в Н2 ионом или комплексом металла).
Cu2+ + H2 CuH+ + H+
PtCl2 + H2 ClPtH + HCl
RuCl63- + H2 H RuCl53- + HCl
Комплексы металлов в низших степенях окисления, имеющие возможность повысить степень окисления и координационное число, ведут к гомолитическому расщеплению связи Н-Н. В этом случае дативная компонента связи преобладает над донорно-акцепторной.
IrCl(CO)L2 + H2 (H)2 IrCl(CO)L2
Co2(CO)8 + H2 2 HCo(CO)4
2 Co(CN)53-+ H2 2 HCo(CN)53-
В любом из перечисленных вариантов образуются гидридные комплексы переходных металлов. Комплексы такого типа предполагаются в качестве катализаторов и интермедиатов многих процессов с участием водорода.
