
- •Химия и технология гомогенного катализа Конспект лекций Москва 2012
- •Предисловие
- •Общие проблемы катализа
- •1.1 Краткая история открытия каталитических реакций и теории катализа
- •Краткая история открытия каталитических реакций
- •1.2 Теории катализа
- •1.3 Классификации каталитических процессов и катализаторов
- •1.3.1 Классификация каталитических процессов
- •1.3.2 Классификации катализаторов
- •2. Выбор катализаторов
- •2.1 Современное содержание термина «активация»
- •2.1.1 Классификация комплексов
- •Карбеновые комплексы:
- •Карбиновые комплексы
- •2.2 Активация молекул
- •2.2.1 Молекула водорода
- •2.2.2 Молекула монооксида углерода
- •2.2.3 Активация алкенов и алкинов
- •2.2.3.1 Реакции координированных алкенов
- •2.2.3.2 Реакции координированных алкинов
- •2.2.4 Активация полярных молекул
- •2.3 Проблема выбора катализатора и возможные пути ее решения
- •2.3.1 Эмпирический подход.
- •2.3.2 Полуэмпирический метод.
- •2.3.3 Теоретический подход.
- •2.4 Требования к промышленным катализаторам
- •2.4.1 Активность (производительность)
- •2.4.2 Селективность.
- •2.4.3 Стабильность.
- •2.4.4 Наличие методик регенерации и утилизации
- •2.4.5 Воспроизводимость.
- •2.4.6 Экологичность.
- •2.4.7 Экономичность.
- •Технология гомогенного катализа
- •Методы приготовления и исследования гомогенных катализаторов
- •3.1 Приготовление гомогенных катализаторов
- •3.2 Методы исследования гомогенных катализаторов и процессов с их участием
- •3.2.1 Дифракционные методы
- •3.2.2 Электронографический анализ (эга)
- •3.2.3 Спектроскопические методы.
- •3.2.4 Масс-спектрометрия
- •Технология синтеза и разделения реакционных систем на основе гомогенных катализаторов
- •4.1 Выбор реактора
- •4.2 Методы разделения катализаторов и продуктов, используемые для гомогенно-каталитических реакционных систем
- •4.2.1. Выделение наиболее ценных компонентов каталитической системы (чаще всего благородных металлов).
- •4.2.2 Выделение продуктов гомогенно-каталитической реакции.
- •4.3 Гидроформилирование алкенов (Оксосинтез)
- •4.3.1 Схемы с термической декобальтизацией (выделение кобальта в виде металла на поверхности твердой фазы носителя)
- •4.3.2 Солевые схемы (выделение металла в виде соли за счет экстракции)
- •4.3.3 Испарительные схемы (отделение продуктов за счет отгонки )
- •Оксосинтез в двухфазных системах вода-органический растворитель
- •4.4 Технология производства ацетальдегида
- •4.4.1 Механизм и кинетика Вакер-процесса.
- •4.4.2 Технология получения ацетальдегида
- •4.5 Технология производства уксусной кислоты.
- •4.6 Технология производства высших олефинов фирмы Шелл (shop process)
- •4.6.1 Олигомеризация
- •4.6.2 Гидроформилирование
- •4.6.3 Изомеризация
- •4.6.4 Метатезис
- •4.6.5 Технология shop процесса
3.2.2 Электронографический анализ (эга)
Для облучения используются электроны, ускоренные до 30-80 кэВ и даже до 400 кэВ. Длины волн для пучка электронов меньше, чем для рентгеновского излучения, поэтому ЭГА может применяться для образцов значительно меньшего размера (очень мелкие кристаллы, порошки, пленки, поверхность массивного образца). Существует два основных метода: «на просвет» и «на отражение». ЭГА часто используют для исследования газообразных (парообразных) веществ. Во всех случаях получают дифракционную картину, которая потом расшифровывается. В результате анализа получают с определенной точностью межъядерные расстояния.
Ограничения метода связаны как с трудностью постановки эксперимента, так и с трудностью расшифровки структуры многоатомных молекул целесообразно сочетать этот метод с микроволновой спектроскопией, масс-спектрометрией и ИК-спектроскопией.
3.2.3 Спектроскопические методы.
Различные спектроскопические методы используют практически все части диапазона электромагнитного излучения (табл. 8).
Таблица 8
Использование различных диапазонов электромагнитного излучения в спектральных методах
Шкала
Тип спектра |
γ-Излу-чение |
Рент-генов-ская об-ласть |
Оптическая область |
Радиочастотная область |
|||||
даль-няя УФ |
ближ-няя УФ |
види-мая |
даль-няя ИК |
ближ-няя ИК |
микро-волно-вая |
корот-ковол-новая |
|||
Частота, с1(Гц) Волнов. число, см-1 Длина волны, см Энергия, эВ |
1020÷18 1010÷8 10-10÷-8 107÷5 |
1019÷17 109÷7 10-9÷-7 105÷3 |
1017÷16 107÷6 10-7÷-6 103÷2 |
1016÷15 106÷5 10-6÷-5 102÷1 |
1014 104 10-4 1 |
1013 103 10-3 10-1 |
1012 102 10-2 10-2 |
1012÷9 102÷-1 10-2÷1 10-2÷-5 |
109÷7 10-1÷-3 101÷3 10-6÷-7 |
Спектры Мессбауэра Рентгеновские спектры Электронные спектры ИК и КР спектры Вращательные спектры Спектры ЭПР Спектры ЯМР и ЯКР |
ХХХ |
ХХХ ХХХ |
ХХХХХХ |
ХХХХХХ |
ХХХХХХ |
ХХХ |
ХХХ |
ХХХХХХХХХХХХ |
ХХХХ |
Все методы базируются на двух квантовых законах, сформулированных в 1913 г Нильсом Бором.
1. Атомная система устойчива лишь в определенных стационарных состояниях, которым соответствуют определенные значения энергии:
Е1<Е2<Е3<…
2. Переход из состояния Еi в состояние Еj может быть связан с испусканием (при Еi >Еj) или поглощением (при Еi <Еj).
ΔE = Еi -Еj = hν
где h - постоянная Планка, ν – частота излучения.
В зависимости от свойств данного диапазона электромагнитного излучения (энергия, длина волны, температура) он воздействует на определенный объект в атоме или молекуле, вызывая определенное изменение в уровне энергии (табл. 8).
Различают следующие виды спектроскопии.
Ядерная спектроскопия. Для получения спектров Мессбауэра используют γ-излучение, которое вызывает изменение уровней энергии ядер и переходы между этими уровнями (энергия 107-105 эВ).
Атомная и молекулярная спектроскопия изучает электронные уровни атомов и молекул, колебательные и вращательные уровни молекул и переходы между ними. Электронные уровни в молекулах рассматривают на основе теории химической связи (кристаллического поля, теории поля лигандов, теории молекулярных орбиталей). Облучение вещества рентгеновским излучением энергией 103-105 эВ вызывает переход электронов с внутренних орбиталей на внешние. Эти переходы фиксируются в виде рентгеноэлектронных спектров (РЭС). РЭС позволяет получить информацию о степени окисления атома, поскольку энергия, поглощаемая для осуществления электронного перехода при прочих равных условиях, зависит от окислительного состояния данного элемента.
Электромагнитное излучение ультрафиолетового или видимого диапазона (10-102 эВ) вызывает переход электронов с нижних занятых валентных орбиталей (основное состояние) на вышележащие вакантные орбитали (возбужденное состояние). При этом в молекуле происходит одновременное изменение энергии электронов, колебательной и вращательной энергии молекул. Поэтому в спектрах поглощения или пропускания, зарегистрированных в УФ и видимой области спектра, наблюдаются широкие полосы. В УФ и видимой области спектра активны соединения переходных металлов (d-d-переходы) и ненасыщенные соединения (π-π* - переходы). Это позволяет получать ценную для катализа информацию о состоянии каталитических систем в жидкой фазе и кинетике образования или расходования ненасыщенных веществ, которые могут быть и реагентами, и интермедиатами, и конечными продуктами каталитических реакций.
ИК-спектроскопия. Уменьшение энергии электромагнитного излучения до 10-1 эВ позволяет получать спектры веществ в инфракрасном диапазоне, соответствующем изменению уровней энергии, связанных с колебательным движением ядер в молекулах вокруг некоторых положений равновесия. Частоты этих колебаний соответствуют энергиям от 0,025 до 0,5 эВ. Изменение энергии колебаний ядер сопровождается изменением многочисленных дискретных состояний вращательной энергии молекулы. Поэтому, также как электронные спектры, ИК-спектры состоят из более или менее широких полос.
Колебания бывают валентные и деформационные. Валентными называются колебания, в которых происходят изменения длины связей (движения ядер только вдоль осей, связывающих ядра). Например, для группы СН2, валентные колебания связей С-Н могут быть симметричными (одновременное удлинение связей) и антисимметричными (одна связь становится длиннее, а другая – короче) (рис. 7). Деформационные колебания, сопровождающиеся изменением углов между связями, гораздо более разнообразны (ножничные, веерные, маятниковые и крутильные) (рис. 7).

Рис. 7. Валентные и деформационные колебания связей в группе СН2
ИК-спектр сложного соединения может содержать несколько полос поглощения, относящихся к колебаниям различного типа, которые могут использоваться для идентификации соединений (неорганических, органических, металлоорганических). Колебательные спектры сравнивают с отпечатками пальцев. Совпадение всех полос спектра неизвестного соединения с полосами спектра образца сравнения позволяет однозначно идентифицировать неизвестное вещество. Даже если идентификация невозможна, из ИК-спектра можно извлечь информацию о наличии в молекуле неизвестного соединения определенных функциональных групп. Частота валентных колебаний определенных связей относительно постоянна и мало зависит от структуры остальной части молекулы (табл. 9).
Таблица 9
Области частот валентных колебаний основных связей в различных соединениях.
Связи |
Диапазон частот, см-1 |
С-С, С-О, C-N |
1300-800 |
С=С, С=О, С=N, N=O, |
1900-1500 |
C≡C, C≡N |
2300-2000 |
C-H, O-H, N-H |
3800-2700 |
ИК-спектроскопия используется для всех видов систем (твердых, жидких, газообразных) и может дать ценную информацию о состоянии катализатора и кинетике его формирования и функционирования. Следующий (в сторону уменьшения энергии) диапазон электромагнитного излучения – радиочастотный (10-2-10-7 эВ) используют три метода радиоспектроскопии: электронный парамагнитный резонанс (ЭПР), ядерный магнитный резонанс (ЯМР), ядерный квадрупольный резонанс (ЯКР).
Электронный парамагнитный резонанс (ЭПР). Спектроскопию ЭПР используют при изучении систем, которые могут содержать вещества с неспаренными электронами. К таким веществам относятся свободные радикалы, ион-радикалы, молекулы в триплетных состояниях, ионы и комплексы переходных металлов и фазы, содержащие свободные электроны. Электрон имеет относительно большой магнитный момент (в 1836 раз больший, чем у протона). В отсутствие внешнего магнитного поля векторы μe неспаренных электронов в веществе ориентированы беспорядочно, все ориентации одинаковы (вырождены) по энергии. Если поместить парамагнетик в магнитное поле В0, вырождение «снимается», уровни магнитной энергии расщепляются. Спин электрона равен ½, поэтому возникает два подуровня. Более энергетически выгодно состояние с антипараллельной ориентацией μe и В0 (рис. 8)
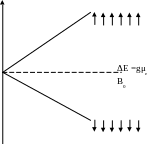
Рис. 8. Уровни энергии неспаренного электрона в магнитном поле В0
Разность энергий между подуровнями легко определить по формуле
ΔE =gμe В0
где μeeh/2mc=9.27*10-24 Am2 – магнетон Бора (е – заряд электрона, m –его масса, с – скорость света); g – безразмерный спектроскопический фактор Ланде, который чаще всего называют просто g-фактором, а В0 – напряженность магнитного поля. В макроскопическом образце, содержащем большое число неспаренных электронов, произойдет их распределение по подуровням. Соотношение заселенностей верхнего подуровня N2 и нижнего подуровня N1 легко определить по соотношению Больцмана
N2/N1=e ΔE/kT=gμBB0/kBT’
где kB- постоянная Больцмана, а Т – абсолютная температура. Число неспаренных электронов на нижнем уровне всегда будет больше, чем на верхнем (N1>N2). Поэтому если облучать образец радиочастотным полем, величина квантов которых hν точно соответствует разности энергий подуровней, т.е. ΔE = hν, то произойдет поглощение энергии. При этом часть неспаренных электронов изменит ориентацию магнитных моментов и перейдет на верхний энергетический подуровень. Это и есть явление ЭПР. Для свободного электрона g=2. С учетом релятивистской поправки более точное значение g=2,00232. Однако неспаренный электрон в атоме, входящем в состав химического соединения, будет испытывать сильное влияние внутренних электромагнитных полей. Для неспаренных электронов во многих свободных радикалах g-факторы очень близки к значению, приведенному выше, и отличаются от него во втором или третьем знаке. Но они могут и сильно отличаться от 2, например, для ионов и комплексов переходных металлов вследствие так называемого спин-орбитального взаимодействия. Приложенное магнитное поле В0 индуцирует в атоме, ионе или молекуле дополнительное магнитное поле В’, которое в зависимости от строения соединения может уменьшать или усиливать В0. Таким образом, локальное поле, действующее на электронный спин, будет отлично от В0 : Влок = В0± В’. Следовательно, резонансные частоты для разных парамагнитных веществ в одном и том же поле В0 будут различаться, что и проявляется в различиях g-факторов. Таким образом, g-фактор в спектроскопии ЭПР несет информацию о строении парамагнитной частицы, сходную с информацией, которую дает химический сдвиг в ЯМР.
Многие реакции, в том числе и каталитические, протекают с промежуточным образованием реакционноспособных частиц, комплексов, содержащих неспаренные электроны. Высокая чувствительность метода ЭПР позволяет наблюдать их возникновение, измерять их концентрации во времени и получать таким образом информацию о механизмах соответствующих реакций. Например, эта информация очень полезна для понимания механизма процессов свободнорадикального жидкофазного окисления углеводородов, катализируемого соединениями кобальта и марганца, различных процессов с участием меди (II), палладия (I), никеля (I) и т.д.
Близкие физические основы имеет метод ядерного магнитного резонанса (ЯМР). ЯМР изучает переходы между уровнями энергии, соответствующими различной ориентации ядерных магнитных моментов по отношению к внешнему магнитному полю. Энергия таких переходов находится в интервале 10-6-10-7 эВ. Явление ЯМР было открыто в 1945 г независимо двумя группами американских ученых – Э.Пурселла и Ф.Блоха (Нобелевская премия по физике за 1952 г). За прошедшие десятилетия ЯМР стал одним из основных методов изучения строения вещества и механизмов химических процессов.
Большинство атомных ядер обладает магнитным моментом (кроме ядер с четным числом и протонов, и нейтронов (126С, 168О,2814Si, 3216S). В отсутствие внешнего магнитного поля любые ориентации магнитных моментов ядер равновероятны и имеют одинаковую энергию. В постоянном внешнем магнитном поле В0 уровни магнитной энергии расщепляются. В общем случае число состояний n магнитного момента ядра в магнитном поле определяется значением его спинового квантового числа (или просто спина) I :
n=2I+1
Ядра с нечетной атомной массой (М) имеют полуцелый спин (I=1/2: 1H, 13C, 15N, 19F, 31P, 199Hg; I=3/2: 11B; I=5/2: 17O), а ядра с четным М и нечетным зарядом ядра (числом протонов z) – целый спин ( I=1: 2H, 14N; I=3: 10B….). Разность энергий ΔE между соседними уровнями магнитного ядра в магнитном поле определяется соотношением
ΔE = μВ0/I.
Электромагнитные кванты, точно соответствующие по энергии разности энергий соседних уровней (ΔE = hν), будут вызывать переориентацию магнитных моментов по отношению к приложенному внешнему магнитному полю В0, что и приводит к спектральным переходам.
Энергия, необходимая для спектрального перехода (резонанса), зависит в первую очередь от электронной плотности на наблюдаемом ядре, которая в свою очередь определяется природой атома, которому принадлежит ядро, и строением молекулы, в которую входит атом. Таким образом положение резонансного сигнала на шкале частот переменного электромагнитного поля определяется химической природой исследуемого объекта. Положение резонансной частоты относительно какого-то стандарта (точки отсчета) называется химическим сдвигом. Значение химического сдвига является определенной характеристикой атома, функциональной группы, в которую он входит (аналогично положению полосы поглощения в ИК-спектре), и существенно облегчает идентификацию химического соединения с помощью имеющихся баз данных по химическим сдвигам.
Не менее важную информацию о строении молекул несет еще один параметр спектров ЯМР – константа спин-спинового взаимодействия (ССВ) между магнитными ядрами. Это взаимодействие приводит к появлению в спектре дополнительной тонкой структуры. Причина возникновения ССВ связана с изменением внешнего магнитного поля, влияющего на химсдвиг данного ядра, в зависимости от ориентации магнитных моментов аналогичных ядер, расположенных в пределах от 2 до 4 связей. Например, на химсдвиг протонов метильной группы этанола влияют магнитные моменты протонов СН2 группы. Это влияние приводит к появлению квадруплет с соотношением 1:3:3:1 для резонансного сигнала метиленовой группы.
Метод ЯМР имеет очень широкое применение. Одно из них – изучение строения каталитических комплексов в жидкой фазе, идентификация интермедиатов и продуктов каталитических процессов, исследование твёрдых катализаторов.
