
- •Химия и технология гомогенного катализа Конспект лекций Москва 2012
- •Предисловие
- •Общие проблемы катализа
- •1.1 Краткая история открытия каталитических реакций и теории катализа
- •Краткая история открытия каталитических реакций
- •1.2 Теории катализа
- •1.3 Классификации каталитических процессов и катализаторов
- •1.3.1 Классификация каталитических процессов
- •1.3.2 Классификации катализаторов
- •2. Выбор катализаторов
- •2.1 Современное содержание термина «активация»
- •2.1.1 Классификация комплексов
- •Карбеновые комплексы:
- •Карбиновые комплексы
- •2.2 Активация молекул
- •2.2.1 Молекула водорода
- •2.2.2 Молекула монооксида углерода
- •2.2.3 Активация алкенов и алкинов
- •2.2.3.1 Реакции координированных алкенов
- •2.2.3.2 Реакции координированных алкинов
- •2.2.4 Активация полярных молекул
- •2.3 Проблема выбора катализатора и возможные пути ее решения
- •2.3.1 Эмпирический подход.
- •2.3.2 Полуэмпирический метод.
- •2.3.3 Теоретический подход.
- •2.4 Требования к промышленным катализаторам
- •2.4.1 Активность (производительность)
- •2.4.2 Селективность.
- •2.4.3 Стабильность.
- •2.4.4 Наличие методик регенерации и утилизации
- •2.4.5 Воспроизводимость.
- •2.4.6 Экологичность.
- •2.4.7 Экономичность.
- •Технология гомогенного катализа
- •Методы приготовления и исследования гомогенных катализаторов
- •3.1 Приготовление гомогенных катализаторов
- •3.2 Методы исследования гомогенных катализаторов и процессов с их участием
- •3.2.1 Дифракционные методы
- •3.2.2 Электронографический анализ (эга)
- •3.2.3 Спектроскопические методы.
- •3.2.4 Масс-спектрометрия
- •Технология синтеза и разделения реакционных систем на основе гомогенных катализаторов
- •4.1 Выбор реактора
- •4.2 Методы разделения катализаторов и продуктов, используемые для гомогенно-каталитических реакционных систем
- •4.2.1. Выделение наиболее ценных компонентов каталитической системы (чаще всего благородных металлов).
- •4.2.2 Выделение продуктов гомогенно-каталитической реакции.
- •4.3 Гидроформилирование алкенов (Оксосинтез)
- •4.3.1 Схемы с термической декобальтизацией (выделение кобальта в виде металла на поверхности твердой фазы носителя)
- •4.3.2 Солевые схемы (выделение металла в виде соли за счет экстракции)
- •4.3.3 Испарительные схемы (отделение продуктов за счет отгонки )
- •Оксосинтез в двухфазных системах вода-органический растворитель
- •4.4 Технология производства ацетальдегида
- •4.4.1 Механизм и кинетика Вакер-процесса.
- •4.4.2 Технология получения ацетальдегида
- •4.5 Технология производства уксусной кислоты.
- •4.6 Технология производства высших олефинов фирмы Шелл (shop process)
- •4.6.1 Олигомеризация
- •4.6.2 Гидроформилирование
- •4.6.3 Изомеризация
- •4.6.4 Метатезис
- •4.6.5 Технология shop процесса
2.2.3 Активация алкенов и алкинов
Превращения алкенов и алкинов относятся к важнейшим реакциям основного органического синтеза. Как правило, эти превращения включают активацию π-лигандов в π-комплексах переходных металлов.
π-Комплексы моноолефинов, сопряженных и несопряженных диолефинов и алкинов известны почти для всех переходных металлов. При этом встречаются моно-, би- и полиядерные соединения. Известны также соединения, содержащие 2, 3 и даже 4 молекулы алкена на атом металла, например, AcacRh(C2H4)2, Ni(C2H4)3 и Ir(C2H4)4Cl. В π-комплексах алкинов состава Mm(C2R2)n соотношение m/n меняется весьма широко. Например, известны комплексы состава Co4(CO)10(C2H2), Pt(C2R2)2, W(CO) (C2R2)3.
Координация всех π-лигандов сопровождается более или менее значительными изменениями их физических характеристик – понижается частота валентных колебаний кратных связей, увеличивается длина связей С-С, изменяются величины валентных углов. Природа химической связи в π-комплексах переходных металлов имеет много общего.
Рассмотрим основные положения на примере π-комплексов алкенов и алкинов. Молекула этилена по величине потенциала ионизации не отличается от молекулы аммиака (IC2H4 = 10.5 эв). Донорные свойства ацетилена выражены несколько слабее (IC2H2 = 11.4 эв). В ацетилене, однако, нижние вакантные МО лежат ниже, чем у этилена, поэтому молекула ацетилена характеризуется более выраженными акцепторными свойствами.
Представления о природе связи в π-комплексах базируются на идеях Дьюара, Чатта и Данкансона, развитых более полувека назад. Модель Дьюара-Чатта-Данкансона, несмотря на ее упрощенность, может быть положена в основу концепции активации π-лигпндов в комплексах переходных металлов.
Рассмотрим, например, соль Цейзе KPtCl3(C2H4). Молекула этилена занимает координационное место в плоско-квадратном комплексе PtCl42-, вытесняя ион хлора:
Гибридная орбиталь Pt(II) (например, dsp2-орбиталь) перекрывается с π-МО этилена, образуя трехцентровую двухэлектронную связь (донорно-акцепторная компонента связи). Гибридные заполненные 6dp-орбитали платины взаимодействуют с разрыхляющей π*-МО олефина, образуя вторую трехцентровую двухэлектронную связь (дативная компонента связи). В общем виде эти ситуация представлена на диаграмме:
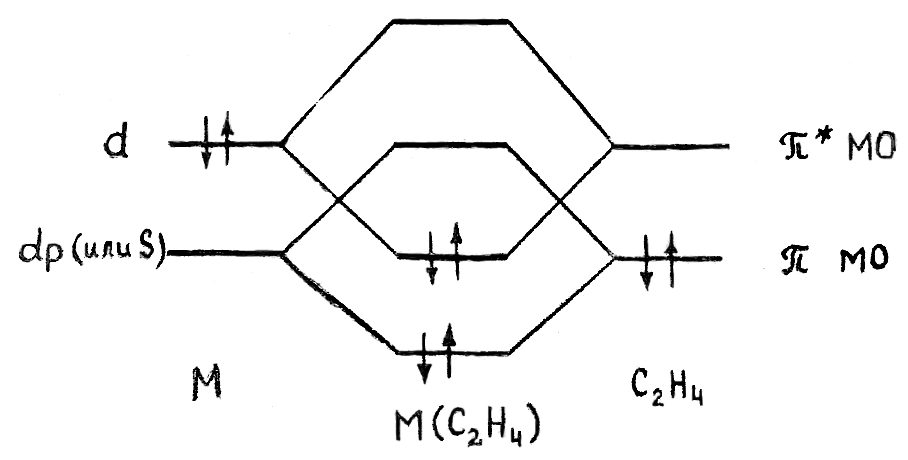
Обе трехцентровые связи вносят вклад в повышение прочности связи M-C2H4. Однако эти компоненты по разному влияют на свойства координированного π-лиганда.
В частности, образование дативной связи увеличивает заселенность разрыхляющей орбитали π-лиганда, что приводит к сильной дестабилизации координированной молекулы. Соотношение двух компонент связи металл-лиганд будет зависеть от свойств центрального атома, других лигандов и заместителей в молекуле π-лиганда. По степени изменения свойств π-лиганда все π-комплексы делятся на две группы.
I тип – π-комплексы, в которых изменение π-лиганда носит характер слабого возмущения.
II тип – π-комплексы, в которых сильно меняются порядок связи С-С и валентные углы.
Комплексы I типа обычно образуются металлами в высоких степенях окисления, связанных с электроотрицательными лигандами. Комплексы II типа образуют металлы в низких степенях окисления, связанные с мягкими основаниями. Так, например, соль Цейзе – K[PtCl3(C2H4)] – является примером комплекса I типа, а соединение (Ph3P)2Pt(C2H4) – примером комплекса II типа ( табл. 6).
Таблица 6
Характеристики π-комплексов этилена первого и второго типа
Комплекс |
Тип |
ΔνС=С, см-1 |
LC=C, Ǻ |
Положение С=С |
K[PtCl3(C2H4)] (Ph3P)2Pt(C2H4) |
I II |
118 > 200 |
1.37 1.43 |
Перпендикулярно пл. PtCl3 В плоскости Pt(PPh3)2 |
В комплексах c сильными
электроотрицательными π-лигандами
длины связей С-С приближаются к длине
простой связи С-С в алканах. Например,
в комплексе L2Pt(C2F4)
длина связи С-С составляет 1.54 Ǻ, т.е.
двойная связь по существу превращается
в о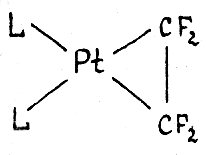 динарную.
Значения химсдвигов 19F
и констант спин-спинового взаимодействия
в спектре ЯМР комплекса также хорошо
объясняются “циклопропановой”
структурой. Таким образом, взаимодействие
сильного донора L2Pt
(0) с сильным акцептором C2F4
приводит к существенному переносу
d-электронов на π-лиганд
и образованию металлоцикла. Происходит
окислительное присоединение π-лиганда
к Pt(0) с образованием Pt(II)
и аниона C2F42-. Особенно
отчетливо различие двух групп π-комплексов
можно проследить в случае алкиновых
лигандов (табл. 7).
динарную.
Значения химсдвигов 19F
и констант спин-спинового взаимодействия
в спектре ЯМР комплекса также хорошо
объясняются “циклопропановой”
структурой. Таким образом, взаимодействие
сильного донора L2Pt
(0) с сильным акцептором C2F4
приводит к существенному переносу
d-электронов на π-лиганд
и образованию металлоцикла. Происходит
окислительное присоединение π-лиганда
к Pt(0) с образованием Pt(II)
и аниона C2F42-. Особенно
отчетливо различие двух групп π-комплексов
можно проследить в случае алкиновых
лигандов (табл. 7).
Таблица 7
Характеристики π-комплексов алкинов
Комплекс |
Тип |
ΔνС=С, см-1 |
LC=C, Ǻ |
Положение С=С |
(Bu2C2PtCl2L* (Ph2C2)Pt(PPh3)2 |
I II |
200 490 |
1.27 1.36 |
Перпендикулярно пл. PtCl3 В плоскости Pt(PPh3)2 |
* L - амин
