
- •Химия и технология гомогенного катализа Конспект лекций Москва 2012
- •Предисловие
- •Общие проблемы катализа
- •1.1 Краткая история открытия каталитических реакций и теории катализа
- •Краткая история открытия каталитических реакций
- •1.2 Теории катализа
- •1.3 Классификации каталитических процессов и катализаторов
- •1.3.1 Классификация каталитических процессов
- •1.3.2 Классификации катализаторов
- •2. Выбор катализаторов
- •2.1 Современное содержание термина «активация»
- •2.1.1 Классификация комплексов
- •Карбеновые комплексы:
- •Карбиновые комплексы
- •2.2 Активация молекул
- •2.2.1 Молекула водорода
- •2.2.2 Молекула монооксида углерода
- •2.2.3 Активация алкенов и алкинов
- •2.2.3.1 Реакции координированных алкенов
- •2.2.3.2 Реакции координированных алкинов
- •2.2.4 Активация полярных молекул
- •2.3 Проблема выбора катализатора и возможные пути ее решения
- •2.3.1 Эмпирический подход.
- •2.3.2 Полуэмпирический метод.
- •2.3.3 Теоретический подход.
- •2.4 Требования к промышленным катализаторам
- •2.4.1 Активность (производительность)
- •2.4.2 Селективность.
- •2.4.3 Стабильность.
- •2.4.4 Наличие методик регенерации и утилизации
- •2.4.5 Воспроизводимость.
- •2.4.6 Экологичность.
- •2.4.7 Экономичность.
- •Технология гомогенного катализа
- •Методы приготовления и исследования гомогенных катализаторов
- •3.1 Приготовление гомогенных катализаторов
- •3.2 Методы исследования гомогенных катализаторов и процессов с их участием
- •3.2.1 Дифракционные методы
- •3.2.2 Электронографический анализ (эга)
- •3.2.3 Спектроскопические методы.
- •3.2.4 Масс-спектрометрия
- •Технология синтеза и разделения реакционных систем на основе гомогенных катализаторов
- •4.1 Выбор реактора
- •4.2 Методы разделения катализаторов и продуктов, используемые для гомогенно-каталитических реакционных систем
- •4.2.1. Выделение наиболее ценных компонентов каталитической системы (чаще всего благородных металлов).
- •4.2.2 Выделение продуктов гомогенно-каталитической реакции.
- •4.3 Гидроформилирование алкенов (Оксосинтез)
- •4.3.1 Схемы с термической декобальтизацией (выделение кобальта в виде металла на поверхности твердой фазы носителя)
- •4.3.2 Солевые схемы (выделение металла в виде соли за счет экстракции)
- •4.3.3 Испарительные схемы (отделение продуктов за счет отгонки )
- •Оксосинтез в двухфазных системах вода-органический растворитель
- •4.4 Технология производства ацетальдегида
- •4.4.1 Механизм и кинетика Вакер-процесса.
- •4.4.2 Технология получения ацетальдегида
- •4.5 Технология производства уксусной кислоты.
- •4.6 Технология производства высших олефинов фирмы Шелл (shop process)
- •4.6.1 Олигомеризация
- •4.6.2 Гидроформилирование
- •4.6.3 Изомеризация
- •4.6.4 Метатезис
- •4.6.5 Технология shop процесса
2.2.4 Активация полярных молекул
Полярные молекулы НХ, где Х – ОН, OR, Hal, CN, NH2, NR2, NHR, SR и др. активируются по механизму, близкому к механизму активации апротонными кислотами. Образование донорно-акцепторной связи между донорным атомом полярной молекулы и комплексом переходного металла, имеющим вакантные орбитали, приводит к ослаблению связи Н – Х. Ослабление связи H-X при координации этих молекул подтверждается, как правило, данными ИК-спектров координированных молекул. При этом в образующемся комплексе происходит смещение σ-пары электронов донорных атомов O, N или S к иону металла, обладающему акцепторными свойствами. Молекула лиганда поляризуется, что приводит к ее ионизации и облегчает диссоциацию (в полярных растворителях):
Смещение электронов и ослабление связи Х-Н при координации подтверждается данными ИК-спектров координированных молекул. Например, координация RNH2 в комплексах с PtCl2 приводит к понижению νN-H (на 80-100 см-1). В результате повышается способность связи Н-Х к гетеролитической диссоциации с передачей протона на растворитель, на другой субстрат или его окислительному присоединению к переходному металлу (в зависимости от степени окисления металла и состояния его внутренней координационной сферы).
HX + MLn —→ H--X→MLn-1 + L
Даже такие слабые кислоты, как молекула аммиака или аминов, легко депротонируются в водных или неводных средах в координационной сфере переходных металлов:
TiCl4 + 6NH3 → TiCl(NH2)3 + 3 NH4Cl
Или
Pt(NH3)X5- + H2O → Pt(NH2)X52- + H3O+
В результате в комплексе металла появляется фрагмент молекулы HX (например, NH2), реакционная способность которого, конечно, ниже, чем свободного иона NH2-, но концентрация которого на много порядков выше, чем в отсутствие комплексообразователя. Константа диссоциации циановодорода HCN, например, составляет 10-10. Образование комплексов с металлами позволяет существенно повысить концентрацию группы M-CN. Так, при взаимодействии HCN с полиядерными комплексами меди(I) концентрация CuCN в
CumCln(n-m)- + HCN → ClnCum-1(CuCN) + HCl
растворе может достигать 15% масс. Координированный анион CN может далее участвовать в различных реакциях с образованием изонитрила CH3N=C, β-цианвинильного производного Cu(I) или изомера цианистого водорода NH=C, быстро присоединяющего нуклеофил Х- с образованием имина в координационной сфере металла:
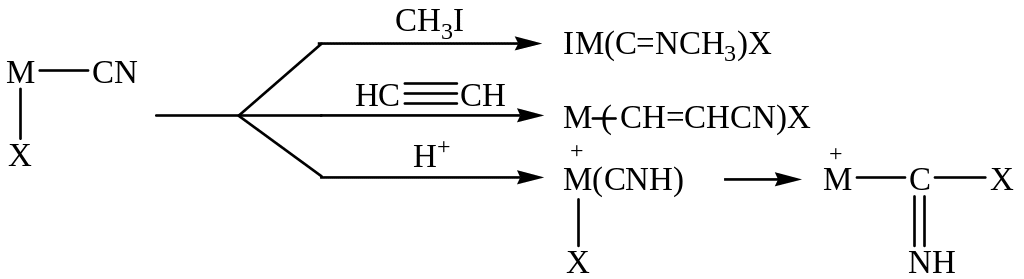
Для катализа особенно важны две последние реакции.
2.3 Проблема выбора катализатора и возможные пути ее решения
Поиск новых катализаторов для известных реакций и катализаторов для проведения новых реакций до настоящего времени является серьезной проблемой. Исторически эту проблему решали эмпирическим путем методом проб и ошибок, перебирая и испытывая в качестве катализатора имевшиеся в распоряжении исследователя вещества. Все теории катализа, часть из которых кратко описана выше, пытались найти подходы к теоретическому решению этой проблемы. В полной мере это не удалось до настоящего времени, тем не менее, накопленные знания о механизме действия катализаторов различного типа позволяют подойти к решению этого вопроса в теоретическом плане. Можно выделить три различных подхода к решению этой проблемы, различающихся долей используемых эмпирических и теоретических методов.
