
- •Предисловие
- •Глава 1. Аминокислоты и белки
- •1.1 Общая характеристика
- •1.2 Классификация аминокислот
- •1.3 Модификация аминокислот
- •1.4 Ионизация аминокислот
- •1.5 Пептидная связь
- •1.6 Пептиды и белки
- •1.7 Функции белков
- •1.8 Уровни структурной организации белков
- •А Первичная структура белка
- •Б Вторичная структура белка
- •В Третичная структура белка
- •Д Четвертичная структура белка
- •1.9 Глобулярные и фибриллярные белки
- •А Кератин
- •1.10 Простые и сложные белки
- •1.11 Денатурация и ренатурация белков
- •1.12 Методы работы с белками
- •А Очистка и выделение белка
- •Б Высаливание
- •В Диализ
- •Д Аналитические методы работы с белками
- •Термины
- •Вопросы к семинарскому занятию (1-я часть)
- •Вопросы к семинарскому занятию (2-я часть)
- •Дополнительные вопросы и ключевые слова
- • Аминокислоты
- •Вопросы для самопроверки
- •Глава 2. Ферменты
- •2.1 Общая характеристика
- •2.2 Номенклатура ферментов
- •2.3 Свойства ферментов
- •2.4 Строение фермента
- •2.5 Специфичность ферментов
- •А Модель «ключ-замок»
- •Б Модель индуцированного соответствия
- •2.7 Термодинамика ферментативных реакций
- •2.8 Кинетика ферментативных реакций
- •А Вывод уравнения Михаэлиса-Ментен (по Бергу)
- •В Уравнение Лайнуивера-Берка
- •2.9 Механизмы ферментативного катализа
- •2.10 Влияние факторов среды на скорость протекания ферментативной реакции
- •А Концентрация субстрата
- •2.12 Мультисубстратные реакции
- •А Последовательный механизм
- •2.13 Ингибирование ферментов
- •Б Бесконкурентные ингибиторы
- •В Неконкурентные ингибиторы
- •2.14 Кооперативные взаимодействия внутри молекул ферментов
- •А Параллельная модель
- •2.15 Аллостерическая регуляция активности ферментов
- •2.16 Регуляция активности ферментов с помощью ковалентной модификации
- •2.17 Анти-, мульти- и изоферменты
- •2.18 Ферменты в медицине
- •А Энзимодиагностика
- •Термины
- •Вопросы к занятию (1-я часть)
- •Вопросы к занятию (2-я часть)
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 3. Нуклеиновые кислоты
- •3.1 Общая характеристика
- •3.2 Строение нуклеотида
- •3.3 Первичная структура ДНК
- •3.4 Вторичная структура ДНК
- •3.5 Денатурация и ренатурация ДНК
- •3.6 Третичная структура ДНК
- •3.7 Четвертичная структура ДНК
- •3.8 Виды РНК и их функции
- •3.9 Первичная структура РНК
- •3.10 Вторичная структура РНК
- •3.11 Третичная структура РНК
- •3.12 Четвертичная структура РНК
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 4. Репликация
- •4.1 Общая характеристика
- •4.2 Инициация репликации у прокариот
- •4.3 Элонгация репликации у прокариот
- •Б Механизм ферментативной реакции
- •4.4 Терминация репликации у прокариот
- •4.5 Репликация у эукариот
- •4.6 Проблемы репликации
- •Б Проблема высокой точности процесса
- •4.7 Плазмиды
- •В Типы плазмид
- •Д Механизмы репликации кольцевых плазмид
- •4.8 Репликация вирусов
- •Б Репликация генома РНК-вирусов
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 5. Транскрипция
- •5.1 Организация генетической информации
- •5.2 Общая характеристика транскрипции
- •5.3 Гипотеза Жакоба и Моно
- •5.4 Строение РНК-полимераз
- •5.5 Инициация транскрипции у прокариот
- •5.6 Элонгация транскрипции у прокариот
- •5.7 Терминация транскрипции у прокариот
- •5.8 Инициация транскрипции у эукариот
- •5.9 Элонгация транскрипции у эукариот
- •5.10 Терминация транскрипции у эукариот
- •А Кэпирование
- •Б Полиаденилирование
- •В Сплайсинг
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 6. Трансляция
- •6.1 Общая характеристика
- •6.2 Свойства генетического кода
- •6.3 Основные этапы биосинтеза белка
- •А Этап 1. Активация аминокислот
- •Д Этап 5. Фолдинг и посттрансляционная модификация
- •6.4 Рибосомы
- •6.5 Инициация у прокариот
- •6.6 Инициация у эукариот
- •6.7 Элонгация у прокариот
- •6.8 Элонгация у эукариот
- •6.9 Терминация у прокариот
- •6.10 Терминация у эукариот
- •6.11 Гипотеза «качания»
- •6.12 Фолдинг и посттрансляционная модификация белков
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 7. Регуляция биосинтеза белка
- •7.1 Регуляция экспрессии генов у прокариот
- •В Катаболическая репрессия. Лактозный оперон
- •Д Аттенуация. Триптофановый оперон
- •Е «Сильные» и «слабые» промоторы
- •Ж σ-Субъединица РНК-полимеразы
- •7.2 Регуляция экспрессии генов у эукариот
- •Хроматин-перестраивающие комплексы
- •Архитектурные белки высокомобильной группы
- •Ковалентная модификация гистонов
- •Метилирование ДНК
- •В Регуляция с помощью факторов транскрипции
- •7.3 Регуляция на уровне трансляции у про- и эукариот
- •А Дискриминация мРНК
- •Б Трансляционная репрессия
- •7.4 Другие механизмы регуляции у эукариот
- •Б РНК-интерференция
- •Интерференция с помощью малых интерферирующих РНК
- •Интерференция с помощью микроРНК
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- • Регуляция на уровне транскрипции (прокариоты)
- •Вопросы для самопроверки
- •Глава 8. Мутации и репарация
- •8.1 Мутации
- •8.2 Классификация мутаций по вызвавшим их причинам
- •8.3 Классификация мутаций по степени изменений генома
- •8.4 Классическая классификация
- •8.5 Репарация
- •А Прямая репарация
- •8.6 Эксцизионная репарация оснований (BER)
- •8.7 Эксцизионная репарация нуклеотидов (NER)
- •8.8 Мисметч репарация
- •8.9 Репарация двунитевых разрывов
- •8.10 Негомологичное соединение цепей ДНК при двунитевых разрывах
- •8.11 SOS-репарация (SOS-ответ)
- •8.12 Рекомбинационная репарация
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 9. Иммунитет и антитела
- •9.1 Иммунитет: его виды и элементы
- •9.2 Врожденный (неспецифический) иммунитет
- •В Химические медиаторы врожденного иимунитета
- •Е Классический путь активации комплемента
- •Ж Альтернативный путь активации комплемента
- •З Активация терминальных компонентов комплемента
- •И Как фагоциты отличают чужеродные клетки от «своих»?
- •9.3 Приобретенный (специфический) иммунитет
- •А T-лимфоциты
- •В Антитела
- •Е Вторичный иммунный ответ
- •Ж Активация гуморального иммунитета
- •9.4 Группы крови
- •9.5 Трансфузионные реакции
- •9.6 Правила переливания
- •9.7 Резус-фактор (Rh)
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 10. Биологические мембраны
- •10.1 Строение биомембран
- •В Липиды биомембран
- •10.2 Функции мембран
- •10.3 Мембранный транспорт
- •10.4 Эндо- и экзоцитоз
- •10.5 Трансмембранная передача сигнала
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 11. Энергетический обмен
- •11.1 Энергия в клетке
- •11.2 Дыхательная цепь митохондрий
- •11.3 Сопряжение дыхания и окислительного фосфорилирования
- •11.4 Разобщение дыхания и окислительного фосфорилирования
- •Термины
- •Вопросы к занятию
- •Дополнительные вопросы и ключевые слова
- •Вопросы для самопроверки
- •Глава 12. Введение в метаболизм
- •12.1 Общая характеристика
- •А Метаболические пути
- •Б Метаболиты
- •В Гомеостаз
- •12.2 Функции метаболических путей
- •А Образование энергии
- •Б Катаболизм органических соединений
- •Переваривание
- •Гликолиз
- •Окисление жирных кислот
- •Катаболизм аминокислот
- •В Синтез органических соединений и предшественников макромолекул
- •Глюконеогенез: синтез глюкозы
- •Синтез жирных кислот
- •Синтез гема
- •Креатинфосфат
- •Гликоген
- •Жиры или триацилглицеролы
- •Д Выведение потенциально опасных соединений
- •Цикл мочевины
- •Синтез желчных кислот
- •Катаболизм гема
- •Е Образование регуляторных молекул
- •12.3 Ключевые положения всех метаболических путей
- •А АТФ — донор энергии для синтеза
- •В Эссенциальные органические соединения
- •Д Взаимосвязи метаболических путей
- •Е Нелинейность метаболических путей
- •Ж Локализация метаболических путей в клетке
- •З Тканеспецифичность метаболических путей
- •И Метаболизм при голодании
- •12.4 Интеграция метаболизма
- •А Основные физиологические состояния организма и роль различных органов в интеграции метаболизма
- •Состояние насыщения
- •Состояние голодания
- •Б Интеграция метаболизма в различных физиологических состояниях
- •Состояние голодания
- •Продолжительное голодание
- •Состояние насыщения
- •Физические нагрузки
- •В Регуляция метаболизма
- •Инсулин
- •Глюкагон
- •Адреналин
- •Гидрокортизон
- •Адипоцитокины
- •Рекомендуемая литература
- •Приложение 1. Аминокислоты и белки
- •Классификация аминокислот
- •Приложение 2. Ферменты
- •Строение химотрипсина
- •Приложение 3. Нуклеиновые кислоты
- •Приложение 4. Репликация
- •Приложение 5. Транскрипция
- •Приложение 6. Трансляция
- •Приложение 7. Регуляция биосинтеза белка
- •Приложение 8. Мутации и репарация
- •Приложение 9. Иммунитет и антитела
- •Приложение 10. Биологические мембраны
- •Приложение 11. Энергетический обмен
- •Оглавление
16Глава 1 Аминокислоты и белки
—Аминокислоты, образующие β -листы: серин, гистидин, цистеин, треонин,
тирозин, фенилаланин, триптофан, изолейцин, валин.
—Аминокислоты, образующие повороты (шпильки): глицин, аспарагин, аспар-
тат, пролин, серин.
В Третичная структура белка
Третичная структура белка — это общее пространственное расположение всех атомов в молекуле белка (см. Рис. 12 ▼). Химические связи, стабилизирующие третич-
ную структуру: координационные связи (с ионами металлов), гидрофобные взаимодей-
ствия (между неполярными аминокислотами), дисульфидные связи (–S–S–), ионные связи (между заряженными радикалами) и водородные связи (участвуют как радикалы, так и пептидные группы).
Таблица 2 Химические связи и их энергии
|
Тип химической связи |
|
|
Примеры |
|
|
|
Энергия связи |
|
|
|
|
|
|
|
(кДж/моль) |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O — H |
|
|
|
460 |
|
Ковалентные |
|
|
C — H |
|
|
|
414 |
|
|
|
|
|
|
C — C |
|
|
|
348 |
|
Нековалентные |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|||
1. |
Ионные связи |
|
|
|
|
86 |
|
||
|
|
|
|
|
|
|
|
|
|
2. |
Силы ван-дер-Ваальса |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
— Водородные связи |
|
|
|
|
20 |
|
||
|
|
|
|
|
|
|
|
|
|
|
— Диполь-дипольные |
|
|
|
|
9,3 |
|
||
|
взаимодействия1 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||
|
— Лондоновские |
|
|
|
|
0,3 |
|
||
|
дисперсионные силы |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
1 См. Приложение 1. Аминокислоты и белки
Уровни структурной организации белков 17
Третичная структура глобулярных белков представляет собой глобулу (или клубок). Большинство глобулярных белков растворимы в клетке. Как правило, ядро глобулярного белка содержит много неполярных аминокислотных остатков (валин, лейцин, изолейцин, фенилаланин, метионин), которые изолированы от водной среды и образуют гидрофобное ядро (гидрофобный эффект). Это ядро плотно упаковано, внутри него действуют слабые силы ван-дер-Ваальса
(обуславливающие гидрофобные взаимодействия). Могут воз-
никать водородные связи между полярными незаряженными радикалами (серин, треонин, аспарагин, глутамин, тирозин и триптофан). Заряженные полярные аминокислотные радикалы часто расположены на поверхности белка и формируют ионные пары (ионные связи) между собой (таким образом сближаются удаленные участки полипептидной цепи) или вступают в контакт с растворителем — молекулами воды (см. Рис. 13 ▼). Кроме того, заряженные радикалы часто связываются с неорганическими ионами (в т.ч. ионами металлов с образованием координационных связей), что снижает силы отталкивания между фрагментами цепи. Внутри полипептидной цепи и между цепями могут образовываться дисульфидные мостики (в их образовании участвуют сульфгидрильные группы цистеина, –S—S–).
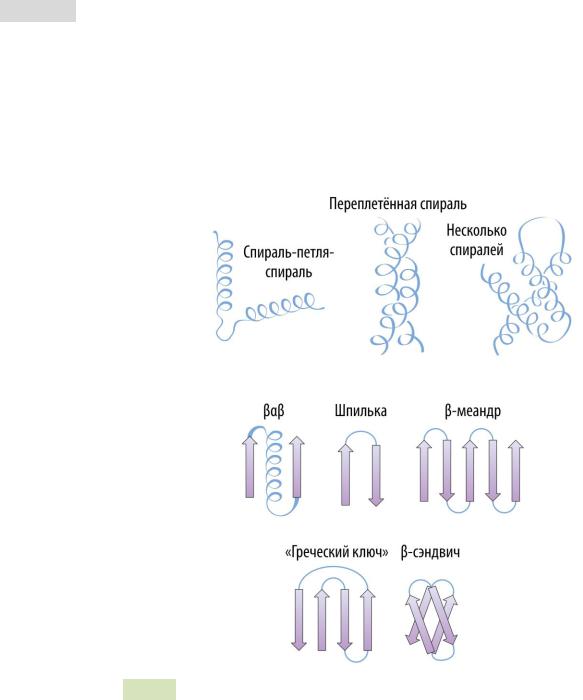
В рамках третичной структуры можно выделить неко-
торые надвторичные структуры: спираль-поворот-спираль,
переплетённая спираль, β αβ , шпилька, β -меандр и др. (см. Рис. 14 и Рис. 15 ▼).
Многие белки состоят из отдельных фрагментов, имеющих свою индивидуальную укладку, функцию и стабильность — доме́нов. Длина аминокислотной цепочки одного домена может составлять от 25 до 300 и более аминокислотных остатков.
Домены белков по своему составу и структуре классифицируют на 4 группы:
—«α»-белки содержат только α-спирали.
—«β»-белки — только β -структуры.
—«α/β»-белки состоят из параллельных β -структур
ипараллельных α -спиралей, которые антипараллельны друг другу.
—«α+β»-белки подразделяют на две класса:
Белки первого класса напоминают «α/β »- белки тем, что в них слой α-спиралей лежит на β -листе. Их α и β участки в цепи и в пространстве регулярно чередуются.
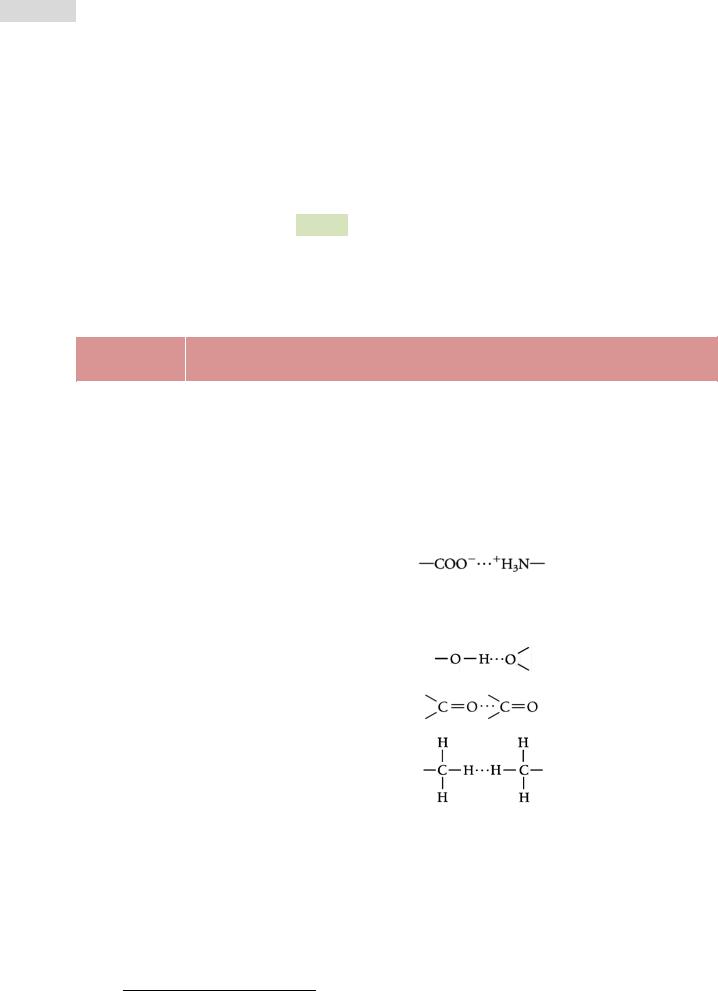
Рис. 12. Третичная структура цитохрома b562 кишечной па-
лочки E. coli (ленточ-
ная модель).
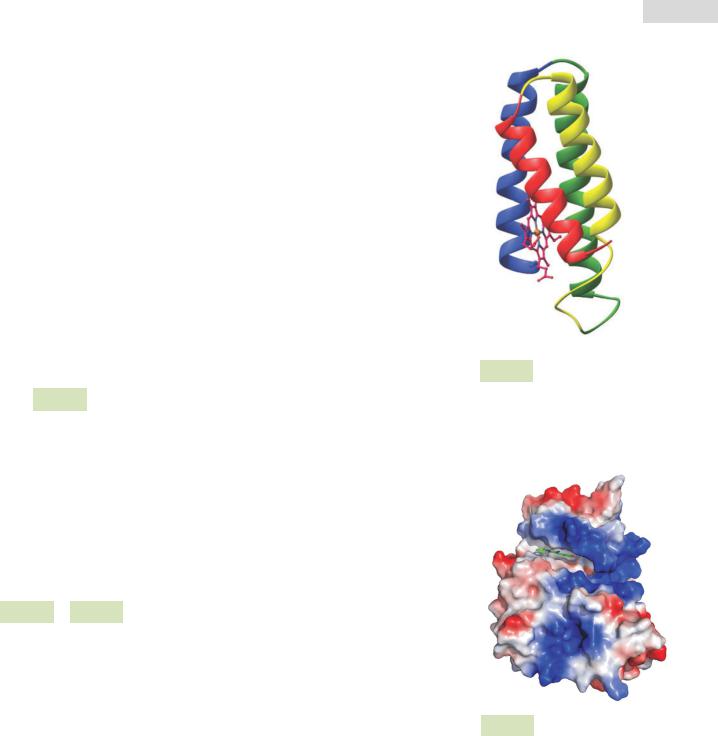
Рис. 13. Компьютерная визуализация молекулы протеинкиназы CK2 (белок-фермент): синим цветом обозначены положительно заряженные радикалы, красным цветом — отрицательно заряженные, а серым — нейтрально заряженные.
18Глава 1 Аминокислоты и белки
Белки другого класса («собственно» «α+β »-белки) не имеют такого чередования, в их цепях α-спирали пространственно удалены от β -
структур.
Стоит упомянуть, что некоторые белки вовсе лишены вторичной и упорядоченной третичной структур (или содержат неупорядоченные фрагменты). Это вызвано большим количеством заряженных аминокислот и пролина в их цепях.
Рис. 14. Надвторичные структуры белков.
ГАнализ и предсказание третичной структуры белка
Третичную структуру можно определить с помощью рентгеновской кристаллогра́фии, пропуская рентгеновские лучи через чистые белковые кристаллы, выращенные в определенных условиях, и затем анализируя дифракционную картину. Данная картина создаётся в результате рассеивания лучей электронами каждого атома молекулы. Рассеянные рентгеновские лучи могут взаимно усиливаться или ослабляться, создавая характерную картину для каждой молекулы.
Третичную структуру белка можно отчасти «предсказать», зная первичную структуру белка. Разработаны компьютерные алгоритмы, позволяющие сделать это, используя банк данных с уже известными конформациями белков. Другие методы основаны на анализе конформации отдельных участков молекулы: существуют данные о том, какие аминокислоты чаще всего образуют α-спирали и β -листы, а какие
Уровни структурной организации белков 19
наоборот препятствуют этому и не формируют регулярных структур. Эту информацию успешно используют при прогнозировании третичной структуры белка.
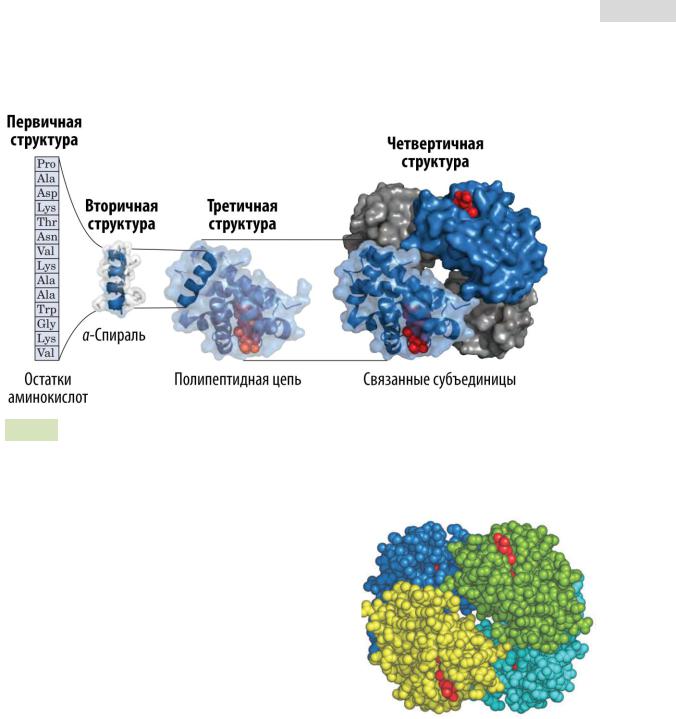
Рис. 15. Уровни структурной организации белков.
Д Четвертичная структура белка
Четвертичной структурой обладают лишь те белки, которые содержат две и более полипептидные цепи. Каждую цепь при этом называют субъединицей (или протоме́ром). Белок, состоящий из нескольких протомеров, называют олигомерным. Количество цепей может варьироваться от 2 до 10 и более. Чаще всего встречаются димерные (две цепи), тримерные (три цепи) и тетрамерные (четыре цепи) белки. Четвертичной структу-
рой обладает, например, белок гемоглобин (см. |
|
|
|
|
|
|
|
|
|
Рис. 16 |
). Он имеет 4 субъединицы (т.е. 4 |
|
|
|
|
Рис. 16. |
Четвертичная струк- |
||
полипептидные цепи). |
|
|||
|
тура гемоглобина. |
|||
Субъединицы в полисубъединичных бел- |
|
|||
|
|
|
||
ках связаны с помощью нековалентных связей: |
|
|
|
|
|
|
|
||
гидрофобных и электростатических взаимодействий. Поскольку эти связи достаточно слабые, субъединицы часто можно разделить в лабораторных условиях. Однако in vivo они остаются прочно связанными.
Некоторые факторы, способствующие образованию четвертичной структуры:
1.Олигомеры обычно более стабильны, чем их диссоциировавшие субъединицы. По всей вероятности, четвертичная структура продлевает «время жизни» белка.
2.Активные центры некоторых олигомерных ферментов формируются из аминокислотных остатков, относящихся к разным полипептидным цепям.
