
- •Молекулярна фізика. Лабораторний практикум
- •Перелік лабораторних робіт
- •Список рекомендованої літератури
- •Частина і. Молекулярна фізика. Розділ 1. Будова речовини
- •1.1. Модель речовини. Маси атомів і молекул
- •1.2. Сили міжмолекулярної взаємодії. Агрегатні стани речовини
- •1.3. Енергія міжмолекулярної взаємодії. Потенціал Ленарда–Джонса
- •1.4. Структура речовини
- •1.4.1. Газоподібний стан
- •1.4.2. Рідини
- •1.4.3. Тверді тіла
- •Розділ 2. Основи молекулярно-кінетичної теорії газів
- •2.1. Ідеальний газ. Ізопроцеси. Рівняння стану ідеального газу
- •2.2. Тиск і температура ідеального газу. Основне рівняння молекулярно-кінетичної теорії
- •2.3. Поняття про статистичний розподіл. Функції розподілу
- •2.3.1. Закони розподілу молекул ідеального газу за швидкостями й енергіями теплового руху (розподіл Максвелла)
- •2.3.2. Барометрична формула. Розподіл Больцмана
- •2.3.3. Розподіл Максвелла–Больцмана
- •2.3.4. Квантові аспекти розподілів. Розподіли Бозе–Айнштайна і Фермі–Дірака
- •2.4. Середня кількість зіткнень молекул. Середня довжина вільного пробігу
- •Розділ 3. Основи термодинаміки
- •3.1. Головні поняття й означення
- •3.2. Внутрішня енергія ідеального газу Молекули ідеального газу не взаємодіють на відстані, тому
- •Вище доведено, що середня кінетична енергія теплового руху молекули ідеального газу
- •3.3. Теплоємність ідеального газу
- •Для ізобарного процесу
- •3.4. Теплоємність рідин
- •3.5. Теплоємність твердих тіл
- •3.5.1. Класична теорія теплоємності твердих тіл
- •3.5.2. Квантові теорії теплоємності твердих тіл.
- •3.6. Адіабатний процес
- •3.7. Політропні процеси
- •3.8. Робота в термодинамічних процесах
- •3.9. Стисливість газів
- •3.10. Ентропія
- •3.11. Циклічні процеси. Теплові машини
- •Розділ 4. Реальні гази
- •4.1. Рівняння стану реального газу. Рівняння Ван-дер-Ваальса
- •4.2. Внутрішня енергія і теплоємність реального газу
- •Розділ 5. Поверхневий натяг. Капілярні явища
- •На підставі (5.3) рівняння (5.4) запишемо у вигляді
- •Розділ 6. Фазові переходи
- •6.1. Агрегатні стани і фази речовини
- •6.2. Фазові переходи першого і другого роду
- •Розділ 7. Явища перенесення
- •7.1. Самодифузія і взаємна дифузія
- •7.2. Теплопровідність
- •7.4. Розріджені гази. Вакуум
- •Частина іі. Молекулярна фізика. Лабораторний практикум. Лабораторна робота № 201. Визначення коефіцієнта в’язкості рідини методом стокса
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 202. Дослідження залежності коефіцієнта в’язкості рідини від температури
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 203. Визначення коефіцієнта в’язкості рідини за допомогою капілярного віскозиметра оствальда
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №205. Визначення коефіцієнта поверхневого натягу рідини методом відривання кільця
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 206. Дослідження залежності коефіцієнта поверхневого натягу рідини від температури методом максимального тиску в бульбашці
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №208. Дослідження теплового розширення металів
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №209. Визначення питомої теплоємності металів методом охолодження
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 210. Визначення сталої больцмана та універсальної газової сталої
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №211. Визначення середньої довжини вільного пробігу та ефективного діаметра молекул повітря
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 212 визначення співвідношення теплоємностей повітря сp/сv методом клемана–дезорма
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 213. Визначення співвідношення теплоємностей повітря ср / сv методом стоячої хвилі
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 214. Вимірювання вологості повітря психрометром
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 215. Дослідження критичного стану речовини
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №216. Дослідження процесу плавлення кристалічних речовин
- •Порядок виконання роботи
- •Контрольні запитання
- •Додатки Головні фізичні сталі
- •Густина твердих тіл . За температури 20ºС
- •Густина рідин за температури 20ºС
- •Густина газів
- •Додаток 4 Теплофізичні коефіцієнти твердих тіл
- •Додаток 5 Пружні властивості твердих тіл
- •Додаток 6 Коефіцієнти лінійного теплового розширення твердих тіл в інтервалі 0–100 ºС
- •Додаток 7 Швидкість поширення звуку в різних середовищах
- •Додаток 8 Деякі фізичні характеристики рідин
- •Додаток 11 Коефіцієнт об’ємного теплового розширення деяких рідин
Порядок виконання роботи
Зволожити водою тканину 2 першого термометра.
Ключ 5 вентилятора психрометра повернути за годинниковою стрілкою на п’ять–шість обертів і спостерігати за показами сухого і вологого термометрів. Коли настане термодинамічна рівновага, записати ці покази в таблицю.
Повторити експеримент ще двічі через 8–10 хв. Отримані значення t°B і t°C усереднити. Розрахувати t°=t°C–t°B.
За отриманими в експерименті значеннями t° і t°C обчислити відносну вологість повітря f. Шукане значення f визначають на перетині горизонтального рядка психрометричної таблиці, який відповідає t°C , і вертикального стовпця, який відповідає t°.
За таблицею „Тиск і густина насиченої водяної пари при різних температурах” визначити PH і PHB, які відповідають температурам t°C і t°B. Визначити атмосферний тиск P0 за показами барометра. Результати записати в таблицю:
Номер за пор. |
t°C, °C |
t°C,°C |
t°B, °C |
t°B,°C |
PH, мм. рт.ст |
PH, мм. рт.ст |
PHB, мм. рт.ст |
PHB, мм. рт.ст |
f, % |
f, % |
1 |
|
|
|
|
|
|
|
|
|
|
…. |
|
|
|
|
|
|
|
|
|
|
C.з. |
|
|
|
|
|
|
|
|
|
|
6. Розрахувати за формулою (4) тиск водяної пари в повітрі за умов виконаного експерименту (аналог абсолютної вологості).
7. Обчислити за формулою (2) сталу психрометра .
8. Похибки PH, PHB і f обчислити за середнім арифметичним кількості вимірювань, а P0 – як похибку приладу.
Абсолютні похибки вимірювань обчислити за формулами
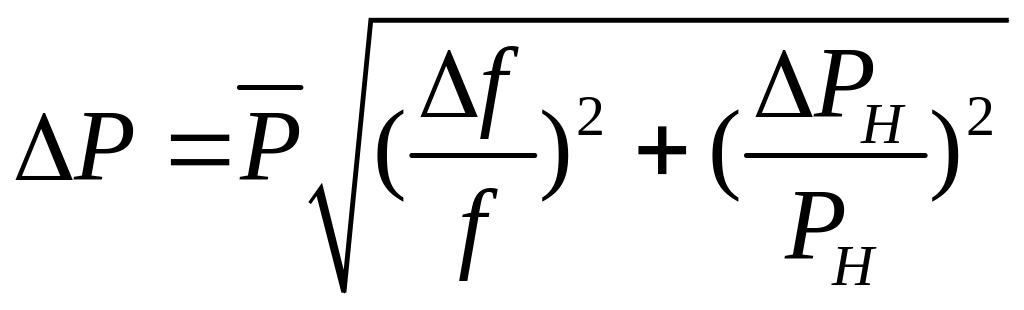 ;
;
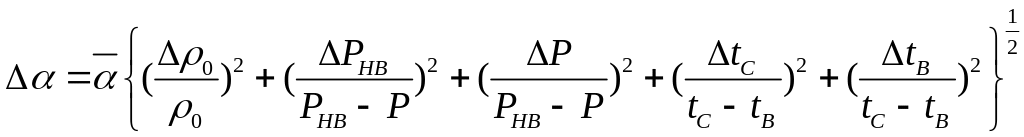 .
.
10. Записати кінцевий результат експерименту у вигляді
f =f f, Ef =…%;
= , E =…%;
P =P P, EP =…%.
Контрольні запитання
Яку пару називають насиченою і як залежить її тиск від температури рідини?
Дайте означення абсолютної і відносної вологості повітря.
Що таке точка роси?
Яке рівняння описує стан насиченої пари? Запишіть його.
Як змінюється внутрішня енергія рідини в процесі випаровування?
Які чинники впливають на різницю показів сухого і вологого термометрів?
Від чого залежить швидкість випаровування рідини? Чому покази сухого термометра більші, ніж покази вологого? Чи завжди виконується це співвідношення?
Лабораторна робота № 215. Дослідження критичного стану речовини
Завдання: визначити критичну температуру ефіру.
Приладдя: установка для дослідження критичного стану речовини ампула з ефіром.
Теоретичний матеріал, який необхідно засвоїти під час підготовки до виконання роботи: ідеальний і реальний гази; рівняння Ван-дер-Ваальса; ізотерми ідеального та реального газів, метастабільні стани; критичний стан речовини, критичні параметри та їхнє виведення з рівняння стану; зрідження газів; фазові переходи.
Література:
1) § 17.1–17.3, с. 326–336; § 17.5, c. 341–344;
2) § 17.2–17.5, c. 56–62;
3) § 64–66, с. 203–210.
4) § 60–65, с. 103–111.
О
Рис. 18
Рис. 17
Ідея роботи та виведення робочої формули. Теоретичною основою дослідження критичного стану речовини є рівняння стану реального газу – рівняння Ван-дер-Ваальса. Для одного моля (кіломоля) реального газу це рівняння записують так:
![]() ,
(1)
,
(1)
де P, V i Т – відповідно, тиск, об’єм і температура одного моля газу; а і b – поправки Ван-дер-Ваальса на внутрішній тиск і власний об’єм усіх молекул газу; R – універсальна газова стала.
Для різних газів поправки а і b різні за значенням. На рис. 18 показані ізотерми реального газу для різних значень температур. Суцільні криві відповідають експериментальним, а криві з штрих-пунктирними ділянками ВВ1СС1 – теоретичним ізотермам. З графіків видно, що з підвищенням температури горизонтальна ділянка ізотерми ВС, яка відповідає двофазовому стану речовини (рідина + насичена пара), зменшується, стягуючись за критичної температури ТK в точку, і дві фази речовини стають нерозрізнюваними. Цій точці відповідають параметри ТK, PK, VK, які визначають критичний стан речовини. Критичні параметри речовини ТK, PK, VK можна визначити, розв’язавши рівняння (1):
![]()
![]()
![]() .
(2)
.
(2)
Критична температура – це температура, за якої зникає різниця між рідиною та її насиченою парою. При ТK питома теплота пароутворення і коефіцієнт поверхневого натягу рідини дорівнюють нулю. При Т>ТK речовина може існувати лише в стані газу, який неможливо перевести в рідину шляхом ізотермічного стиску. При Т<ТK речовина може існувати у стані як рідини, так і насиченої пари.
К
Рис. 19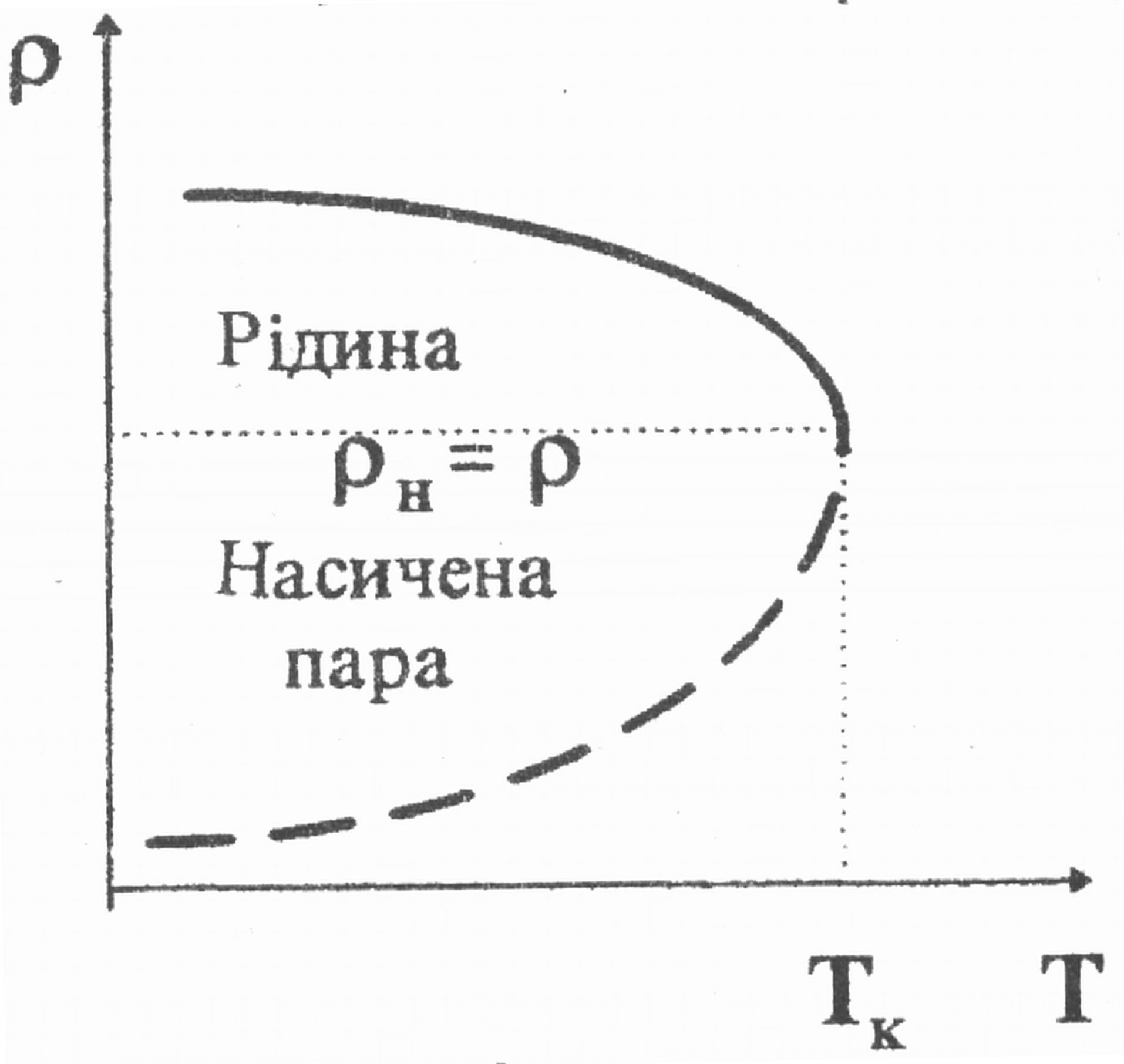
У нашому випадку досліджувана речовина перебуває в замкнутому об’ємі (ефір у запаяній скляній ампулі). Над поверхнею ефіру є насичена пара. З підвищенням температури інтенсивність випаровування ефіру збіль-шується, отже, густина пари н також збільшується, а густина рідини р – зменшується (рис. 19). Коли температура досягає критичної, то н=р. Поряд з цим, як зазначено вище, за такої температури =0, тоді межа поділу між рідиною та її насиченою парою зникне.
Отже, експериментально ТK можна визначити шляхом візуального спостереження за зникненням (появою) меніска в запаяній скляній ампулі під час її нагрівання (охолодження). Цей метод, уперше запропонований київським фізиком М. Авенаріусом, застосований у нашій роботі.
Якщо в експерименті виміряти t1C (температуру, при якій зникає меніск в ампулі) і t2C – (температуру, за якої меніск з’являється, якщо ампулу охолоджувати), то ТK можна визначити так:
![]() .
(3)
.
(3)
Вираз (3) є робочою формулою лабораторної роботи.
