
- •Молекулярна фізика. Лабораторний практикум
- •Перелік лабораторних робіт
- •Список рекомендованої літератури
- •Частина і. Молекулярна фізика. Розділ 1. Будова речовини
- •1.1. Модель речовини. Маси атомів і молекул
- •1.2. Сили міжмолекулярної взаємодії. Агрегатні стани речовини
- •1.3. Енергія міжмолекулярної взаємодії. Потенціал Ленарда–Джонса
- •1.4. Структура речовини
- •1.4.1. Газоподібний стан
- •1.4.2. Рідини
- •1.4.3. Тверді тіла
- •Розділ 2. Основи молекулярно-кінетичної теорії газів
- •2.1. Ідеальний газ. Ізопроцеси. Рівняння стану ідеального газу
- •2.2. Тиск і температура ідеального газу. Основне рівняння молекулярно-кінетичної теорії
- •2.3. Поняття про статистичний розподіл. Функції розподілу
- •2.3.1. Закони розподілу молекул ідеального газу за швидкостями й енергіями теплового руху (розподіл Максвелла)
- •2.3.2. Барометрична формула. Розподіл Больцмана
- •2.3.3. Розподіл Максвелла–Больцмана
- •2.3.4. Квантові аспекти розподілів. Розподіли Бозе–Айнштайна і Фермі–Дірака
- •2.4. Середня кількість зіткнень молекул. Середня довжина вільного пробігу
- •Розділ 3. Основи термодинаміки
- •3.1. Головні поняття й означення
- •3.2. Внутрішня енергія ідеального газу Молекули ідеального газу не взаємодіють на відстані, тому
- •Вище доведено, що середня кінетична енергія теплового руху молекули ідеального газу
- •3.3. Теплоємність ідеального газу
- •Для ізобарного процесу
- •3.4. Теплоємність рідин
- •3.5. Теплоємність твердих тіл
- •3.5.1. Класична теорія теплоємності твердих тіл
- •3.5.2. Квантові теорії теплоємності твердих тіл.
- •3.6. Адіабатний процес
- •3.7. Політропні процеси
- •3.8. Робота в термодинамічних процесах
- •3.9. Стисливість газів
- •3.10. Ентропія
- •3.11. Циклічні процеси. Теплові машини
- •Розділ 4. Реальні гази
- •4.1. Рівняння стану реального газу. Рівняння Ван-дер-Ваальса
- •4.2. Внутрішня енергія і теплоємність реального газу
- •Розділ 5. Поверхневий натяг. Капілярні явища
- •На підставі (5.3) рівняння (5.4) запишемо у вигляді
- •Розділ 6. Фазові переходи
- •6.1. Агрегатні стани і фази речовини
- •6.2. Фазові переходи першого і другого роду
- •Розділ 7. Явища перенесення
- •7.1. Самодифузія і взаємна дифузія
- •7.2. Теплопровідність
- •7.4. Розріджені гази. Вакуум
- •Частина іі. Молекулярна фізика. Лабораторний практикум. Лабораторна робота № 201. Визначення коефіцієнта в’язкості рідини методом стокса
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 202. Дослідження залежності коефіцієнта в’язкості рідини від температури
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 203. Визначення коефіцієнта в’язкості рідини за допомогою капілярного віскозиметра оствальда
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №205. Визначення коефіцієнта поверхневого натягу рідини методом відривання кільця
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 206. Дослідження залежності коефіцієнта поверхневого натягу рідини від температури методом максимального тиску в бульбашці
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №208. Дослідження теплового розширення металів
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №209. Визначення питомої теплоємності металів методом охолодження
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 210. Визначення сталої больцмана та універсальної газової сталої
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №211. Визначення середньої довжини вільного пробігу та ефективного діаметра молекул повітря
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 212 визначення співвідношення теплоємностей повітря сp/сv методом клемана–дезорма
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 213. Визначення співвідношення теплоємностей повітря ср / сv методом стоячої хвилі
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 214. Вимірювання вологості повітря психрометром
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 215. Дослідження критичного стану речовини
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №216. Дослідження процесу плавлення кристалічних речовин
- •Порядок виконання роботи
- •Контрольні запитання
- •Додатки Головні фізичні сталі
- •Густина твердих тіл . За температури 20ºС
- •Густина рідин за температури 20ºС
- •Густина газів
- •Додаток 4 Теплофізичні коефіцієнти твердих тіл
- •Додаток 5 Пружні властивості твердих тіл
- •Додаток 6 Коефіцієнти лінійного теплового розширення твердих тіл в інтервалі 0–100 ºС
- •Додаток 7 Швидкість поширення звуку в різних середовищах
- •Додаток 8 Деякі фізичні характеристики рідин
- •Додаток 11 Коефіцієнт об’ємного теплового розширення деяких рідин
3.3. Теплоємність ідеального газу
Теплоємністю тіла С називають фізичну величину, що дорівнює кількості теплоти, яку потрібно надати тілу, щоб підвищити його температуру на 1 К:
![]() .
(3.8)
.
(3.8)
Теплоємність, віднесену до одиниці маси речовини або до кількості молів, називають питомою теплоємністю, або молярною теплоємністю.
![]() ; (3.9)
; (3.9)
![]() . (3.10)
. (3.10)
Виразимо молярну теплоємність ідеального газу, скориставшись формулами (3.1) і (3.10). Для одного моля газу
![]() .
(3.11)
.
(3.11)
У випадку ізохорного процесу pdVM=0, тому
![]() .
(3.12)
.
(3.12)
Для ізобарного процесу
![]() .
(3.13)
.
(3.13)
Ц
Рис. 3.1. Залежність
теплоємності двохатомних газів від
температури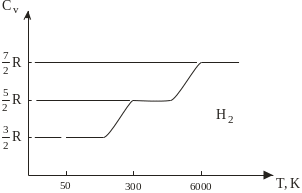
Класична теорія добре описує теплоємність одноатомних газів. Зокрема, ізохорна теплоємність інертних газів (Не, Аr, Xe, Kr), за даними експерименту, справді становить 3/2R і не залежить від температури. Водночас теплоємність двохатомних газів виявляє залежність від температури (рис. 3.1). Цю невідповідність класичної теорії та експерименту пояснює квантова теорія теплоємності, згідно з якою для енергії обертального та коливального рухів складних молекул характерний дискретний спектр:
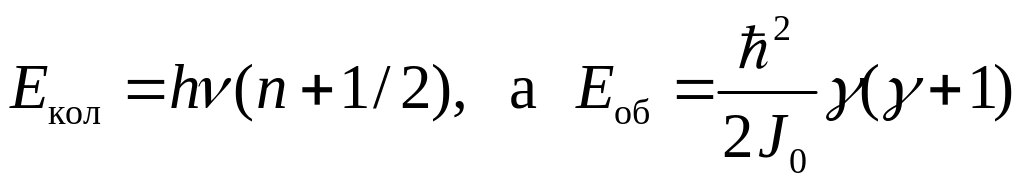 ,
(3.14)
,
(3.14)
де ν
– частота коливань атомів у молекулі;
J0
–
момент інерції молекули; ħ![]() – стала Планка; n=0,1,2,3...
i
j=0,1,2,3...
– квантові числа.
У
квантовій теорії замість статистики
Максвелла–Больцмана
використовують статистику Бозе–Айнштайна.
На
підставі (3.14)
можна визначити температури, за яких
збуджуються коливальні й обертальні
ступені вільності молекул:
– стала Планка; n=0,1,2,3...
i
j=0,1,2,3...
– квантові числа.
У
квантовій теорії замість статистики
Максвелла–Больцмана
використовують статистику Бозе–Айнштайна.
На
підставі (3.14)
можна визначити температури, за яких
збуджуються коливальні й обертальні
ступені вільності молекул:
 .
(3.15)
.
(3.15)
Для водню ці температури становлять 85,5 і 5 410 К, відповідно. З погляду квантової теорії ізохорна теплоємність двохатомного газу
 .
(3.16)
.
(3.16)
За
умови hν>>kТ
вираз (3.16) перетворюється в класичний
![]() .
Отже, квантова теорія повніше описує
теплоємність ідеального газу.
.
Отже, квантова теорія повніше описує
теплоємність ідеального газу.
3.4. Теплоємність рідин
Теорія,
що описує теплоємність газів, незастосовна
до рідин, оскільки їхня внутрішня будова
суттєво різна. Водночас для рідин, як і
для газів, характерні ізохорна
![]() та ізобарна
та ізобарна
![]() теплоємності, однак для рідин
теплоємності, однак для рідин
![]() .
У разі розрахунку
.
У разі розрахунку
![]() –
–![]() для рідин треба враховувати залежність
цих величин від коефіцієнта ізотермічної
стисливості
для рідин треба враховувати залежність
цих величин від коефіцієнта ізотермічної
стисливості
![]() і коефіцієнта теплового розширення
і коефіцієнта теплового розширення
![]() .
Зокрема,
.
Зокрема,
![]() ,
(3.17)
,
(3.17)
д
Рис. 3.2. Аномальна залежність теплоємності
води від температури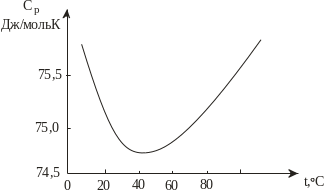
![]() – молярний об’єм.
– молярний об’єм.
Температурна залежність теплоємності рідин неоднозначна і суттєво залежить від їхньої будови та характеру міжмоле-кулярних зв’язків. Результати експериментальних досліджень свідчать, що органічних рідин з підвищенням температури зростає, а одноатомних рідин зменшується. У деяких речовин, зокрема у води, теплоємність з підвищенням температури спочатку зменшується, а потім зростає (рис. 3.2). Сьогодні повна теорія теплоємності рідин ще не розроблена.
3.5. Теплоємність твердих тіл
3.5.1. Класична теорія теплоємності твердих тіл
У 1918 р. П. Дюлонг і А. Пті експериментально визначили, що за кімнатної температури молярна теплоємність одноатомних кристалічних твердих тіл не залежить від їхньої природи і становить 3R. Цей експериментальний факт, який назвали законом Дюлонга і Пті, частково можна пояснити з погляду класичної теорії. Зокрема, класична теорія розглядає кристал як сукупність незалежних атомів-осциляторів, що коливаються з однаковою частотою у вузлах кристалічної ґратки. Оскільки кожен з атомів має три ступені вільності, то енергія його коливного руху становить 3kT, а внутрішня енергія одного моля кристалічної речовини
![]() .
(3.18)
.
(3.18)
Тоді ізохорна теплоємність твердого тіла
![]() ,
(3.19)
,
(3.19)
щ
Рис. 3.3. Температурна залежність
теплоємності твердих тіл
