
- •Обучающийся должен знать
- •Обучающий должен уметь
- •1.1. Анатомия молочной железы
- •1.2. Эпидемиология рака молочной железы
- •1.3. Факторы риска рака молочной железы
- •1.3.1. Факторы риска, которые нельзя изменить
- •1.3.2. Факторы, увеличивающие риск развития рмж
- •1.3.3. Индивидуальные факторы риска рмж
- •1.3.4. Профилактика рака молочной железы
- •1.4. Мастопатии и предраковые заболевания
- •1.4.1. Мастопатии
- •I. Диффузная форма мастопатии
- •II. Узловая форма мастопатии
- •1.4.2. Доброкачественные опухоли молочной железы
- •I. Фиброаденома
- •II. Листовидная (филлоидная) фиброаденома
- •III. Аденома молочной железы
- •IV. Папилломы протоков молочной железы
- •V. Липома
- •1.5. Классификация рака молочной железы
- •1.5.1. Клинико-анатомическая классификация рмж
- •1.5.2. Гистологическая классификация рмж
- •1.5.3. Международная классификация tnm (2002 год)
- •1.6. Диагностика рака молочной железы
- •1.6.1. Скрининг рака молочной железы
- •1.6.2. Самообследование молочной железы
- •1.6.3. Клиническая симптоматика рака молочной железы
- •1.6.4. Клинические проявления рака молочной железы
- •1.6.5. Инструментальные методы диагностики рака молочной железы
- •1.6.5.1. Рентгенодиагностика
- •1.6.5.2. Ультразвуковая диагностика
- •1.6.5.3. Ультразвуковая допплерография молочных желез
- •1.6.5.4. Томографические методы исследования
- •1.6.5.5. Термография
- •1.6.6. Морфологическое исследование молочной железы
- •1.6.7. Клинический пример комплексной диагностики рака молочной железы
- •1.6.8. Прогнозирование и маркерная диагностика
- •1.7. Лечение рака молочной железы
- •1.7.1. Оперативное лечение рака молочной железы
- •I. Органонесохраняющие операции
- •II. Органосохраняющие операции
- •III. Реконструктивные операции при раке молочной железы
- •1.7.2. Постмастэктомический синдром
- •1.7.3. Лучевая тарапия рака молочной железы
- •1.7.4. Химиотерапия рака молочной железы
- •1.7.5. Иммунотерапия
- •1.7.6. Гормонотерапия рака молочной железы
- •1.7.7. Комбинированное лечение рака молочной железы
- •1.7.8. Комплексное лечение рака молочной железы
- •1.7.9. Алгоритмы лечения рака молочной железы
- •I. Стадия 0
- •II. Стадии I, iIа, iIb
- •III. Местно распространенный рак молочной железы III стадии
- •1.7.10. Реабилитация больных раком молочной железы
- •1.8. Рак молочной железы у мужчин
- •1.9. Контрольные вопросы
- •1.10. Тестовые задания
- •1.11. Рекомендуемая литература
- •2.1. Патоморфологическая характеристика сарком мягких тканей
- •2.2. Международная классификация tnm
- •2.3. Факторы риска развития сарком мягких тканей
- •2.4. Клинические проявления сарком мягких тканей
- •2.5. Особенности роста и распространения сарком
- •2.6. Диагностика сарком мягких тканей
- •2.7. Современные подходы в лечении сарком мягких тканей
- •2.7.1. Хирургическое лечение сарком мягких тканей
- •2.7.2. Лучевая терапия сарком мягких тканей
- •2.7.3. Комбинированное лечение сарком мягких тканей
- •2.7.4. Химиотерапия сарком мягких тканей
- •2.7.5. Отдаленные результаты лечения сарком мягких тканей
- •2.9. Тестовые задания Задание с выбором одного правильного ответа
- •10. К особенностям роста сарком мягких тканей относятся
- •2.10. Рекомендуемая литература
- •3.2. Классификация по системе tnm
- •3.3. Диагностика опухолей костей
- •3.4. Принципы лечения опухолей костей
- •3.5. Остеосаркома
- •3.6. Паракостальная (юкстакотикальная) саркома
- •3.7. Хондросаркома
- •3.8. Опухоль Юинга
- •3.9. Фибросаркома кости
- •3.10. Злокачественная фиброзная гистиоцитома
- •3.11. Алгоритмы диагностики и лечения сарком костей
- •I. Остеогенная саркома
- •II. Юкстакортикальная остеогенная саркома
- •III. Хондросаркома
- •IV. Саркома Юинга
- •V. Фибросаркома кости
- •3.12. Контрольные вопросы
- •3.13. Тестовые задания
- •10. Особенности роста сарком костей заключаются в том, что они
- •3.14. Рекомендуемая литература
- •Ошибки в клинической онкологии: Руководство для врачей / Под ред. В.И.Чиссова, а.Х.Трахтенберга. – м.: Медицина, 2001. – 544с. Варианты итоговых тестов Первый вариант
- •Второй вариант
- •Матрицы ответов к заданиям в тестовой форме для самоконтроля
- •Раздел 1. Рак молочной железы
- •Раздел 2. Саркомы мягких тканей
- •Раздел 3. Рак Саркомы костей
- •Матрицы ответов к итоговым тестам Вариант 1
- •Глоссарий
- •Интернет ресурсы
- •Онкологические заболевания молочной железы, саркомы мягких тканей и костей
- •644043 Г. Омск, ул. Ленина, 12; тел. 23-05-98
1.7.1. Оперативное лечение рака молочной железы
Совершенствование методов лечения РМЖ ведет к уточнению показаний к различным видам оперативного вмешательства. Основным критерием является степень распространенности процесса и возможность сочетания хирургического метода с другими.
Хирургическое лечение имеет ряд противопоказаний:
1) неблагоприятные формы роста;
2) рожистоподобный рак;
3) распространённый отёк кожи молочной железы, грудной стенки;
4) отёк верхней конечности в результате множественного метастазирования в лимфатические узлы;
5) обширное изъязвление кожи;
6) прорастание опухолью грудной стенки;
7) сопутствующие заболевания;
8) тяжёлая сердечно-сосудистая и лёгочная недостаточность;
9) выраженные нарушения обменных процессов декомпенсация сахарного диабета, тяжёлая почечная, печёночная недостаточность;
10) выраженные нарушения мозгового кровообращения.
В широкой онкологической практике можно выделить несколько вариантов оперативных вмешательств.
I. Органонесохраняющие операции
Простая мастэктомия. Эту операцию выполняют при распространенном раке с распадом и кровотечением (санационная операция). Цель – исключительно улучшение качества жизни. В этом случае железу удаляют без фасции большой грудной мышцы. Подмышечную лимфодиссекцию не проводят, т.к. это повышает риск осложнений.
Паллиативная мастэктомия. Удаление молочной железы с фасцией большой грудной мышцы. Данный тип операции применяется либо как паллиативное мероприятие при изъязвлениях, распадающихся опухолях, либо при противопоказаниях к радикальной мастэктомии в связи с сопутствующими заболеваниями, возрастом.
Радикальные мастэктомии. Подразумевают полное удаление опухоли с окружающими тканями и регионарными лимфоузлами. Радикальная мастэктомия – метод выбора при лечении местно распространенного РМЖ (стадии IIB, IIIA). Некоторым пациентам невозможно выполнить органосохраняющую операцию из-за большого размера опухоли; небольшого размера груди; мультифокальности поражения; медицинских противопоказаний к лучевой терапии (коллагенозы, предшествующая лучевая терапия). В некоторых случаях пациентки сознательно настаивают на мастэктомии из-за опасения возможного рецидива.
В 1891 году W. Halsted (Холстед) впервые опубликовал результаты предложенного им оперативного вмешательства. Почти одновременно с ним W. Меуег (Мейер) в 1894 году представил свой опыт использования аналогичной операции. Так возникла и затем сложилась классическая операция по Halsted-Meyer, которая в течение длительного времени была основной в хирургическом лечении РМЖ. Мастэктомия по Холстеду-Мейеру предусматривает удаление молочной железы единым блоком с малой и большой грудными мышцами и клетчаткой (с лимфатическими узлами) подкрыльцовой, подключичной и подлопаточной областей.
Радикальную мастэктомию Холстеда в настоящее время проводят только при прорастании опухоли в большую грудную мышцу. При этом выполняют различные разрезы кожи в зависимости от локализации и размеров опухоли, требований к закрытию раневого дефекта. Кожные лоскуты отсепаровывают кверху до ключицы, медиально – до грудины, книзу – до верхней трети прямой мышцы живота, латерально – до широчайшей мышцы спины. Молочную железу, большую и малую грудные мышцы, а также жировую клетчатку подмышечно-подлопаточной области с лимфатическими узлами удаляют единым блоком. В последние годы хирурги допускают удаление не всей, а только части большой грудной мышцы. Показание к операции Холстеда – прорастание опухоли в большую грудную мышцу, обширное метастатическое поражение лимфатических узлов подмышечной области или наличие неподвижного конгломерата метастатических узлов.
В 1948 году D. Patey и W. Dyson предложили свой вариант радикальной операции. Операция по Пейти – удаление молочной железы единым блоком с малой грудной мышцей (но с сохранением большой) и клетчаткой (с лимфатическими узлами) подмышечной, подключичной и подлопаточной областей. Большую грудную мышцу сохраняют для облегчения доступа к подключичным лимфатическим узлам.
После отсепаровывания кожи молочную железу отсекают от большой грудной мышцы вместе с её фасцией. Ассистент отводит крючком большую грудную мышцу, хирург отсекает малую грудную мышцу и удаляет клетчатку с лимфатическими узлами подключичной области (рис. 33).
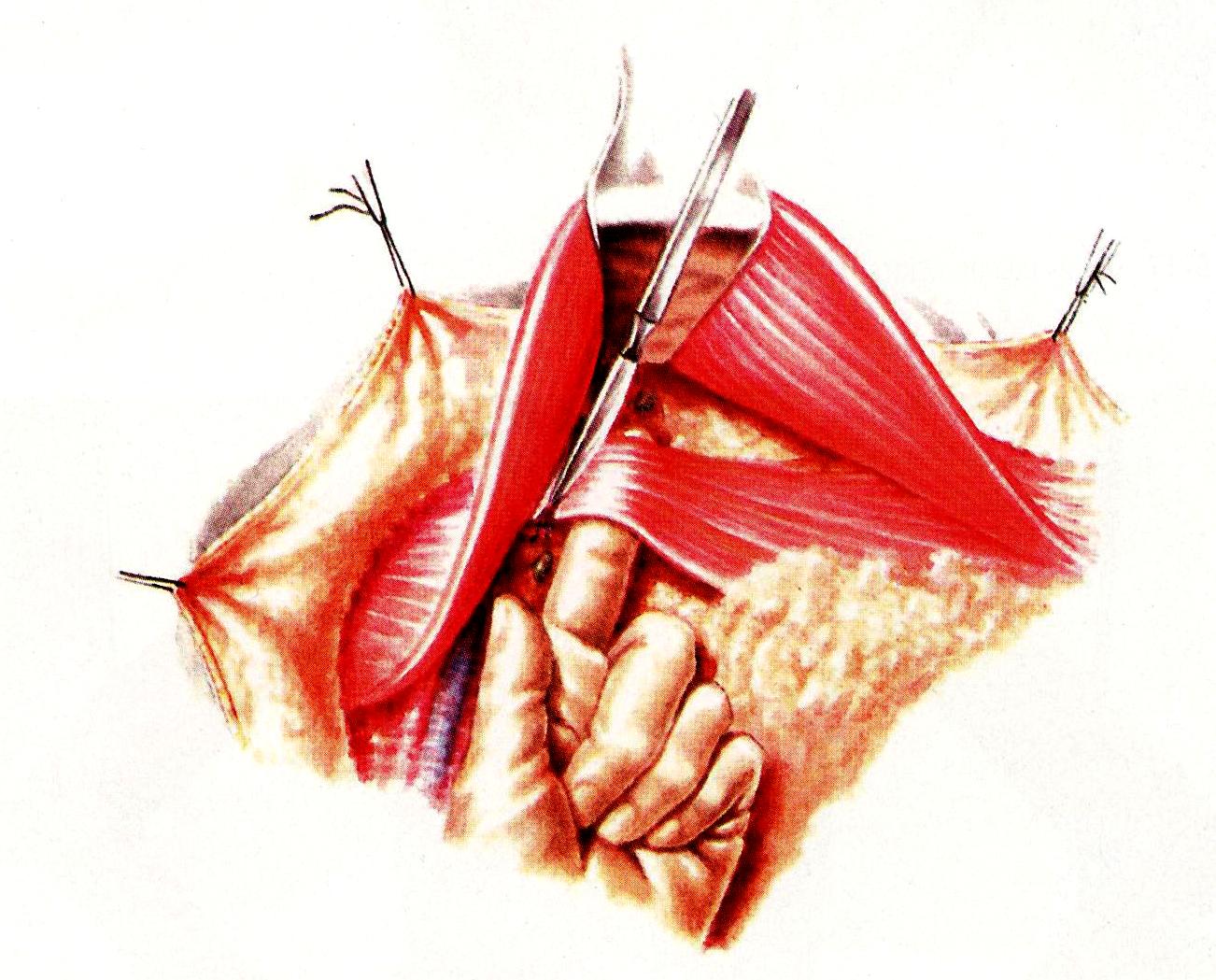
Рис. 33. Этап операции Пэйти.
Сохранение большой грудной мышцы снижает инвалидизацию больных, улучшает условия для последующего протезирования или реконструкции молочной железы. Операцию Пэйти выполняют при местно распространенной узловой форме рака молочных желёз при прорастании опухоли к малой грудной мышце или при наличии технических трудностей при удалении конгломерата подмышечных лимфоузлов.
Выживаемость больных после операции по Пейти не уступает результатам операции Холстеда. Лучше функциональные и косметические результаты.
Следующим этаном в развитии щадящих методик операции было предложение J. Madden (1965) удалять лимфоузлы подмышечной межпекторальной области в едином блоке с молочной железой, сохранив обе грудные мышцы (рис. 34). При этом выполняют подключично-подмышечную лимфаденэктомию в полном объеме и удаляют подмышечную клетчатку, несмотря на некоторые технические сложности. Это вызвано тем, что малая грудная мышца затрудняет доступ в подключичную область и удаление подключичной клетчатки.
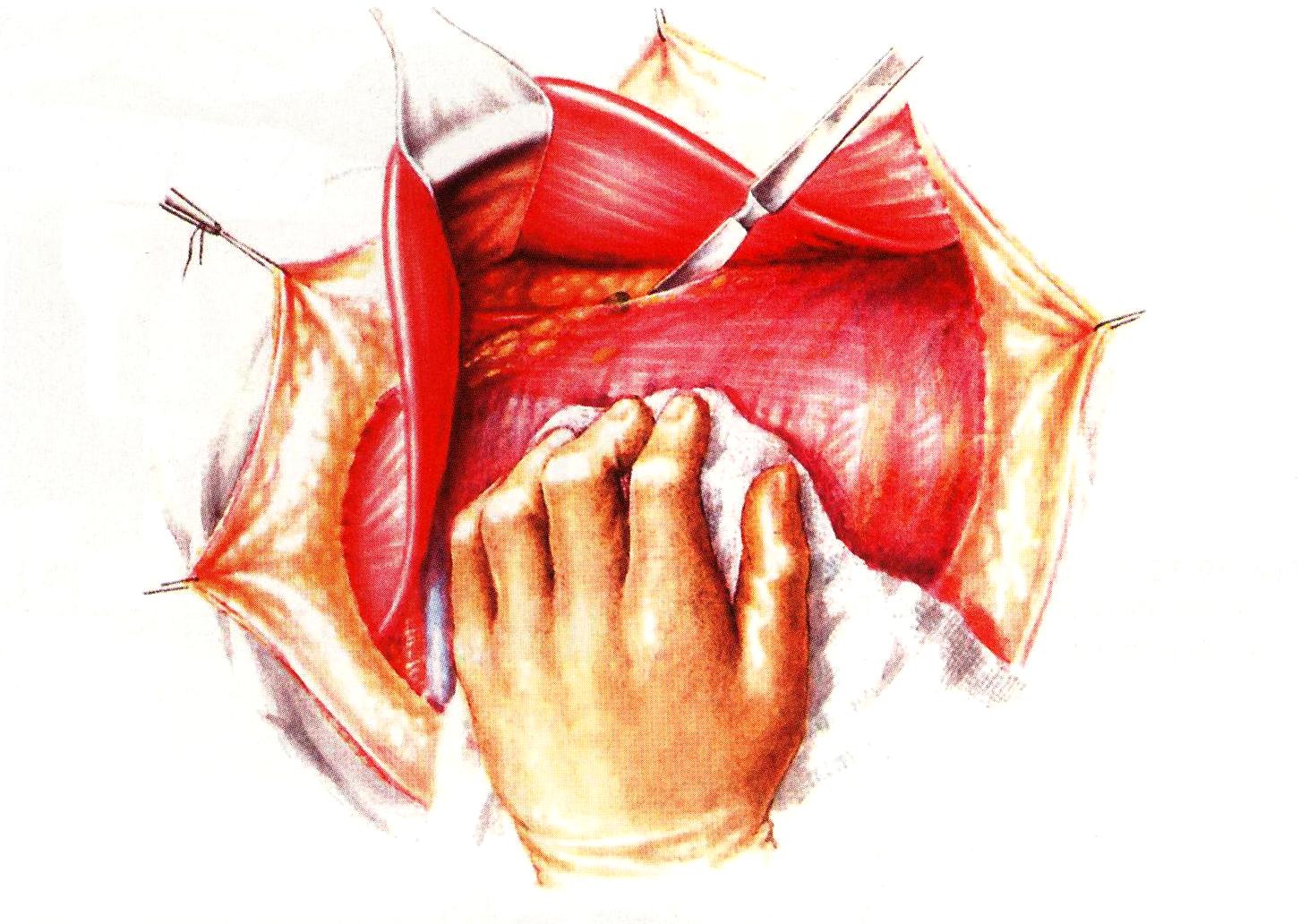
Рис. 34. Этап операции Маддена.
Малая грудная мышца прикрывает подключичные сосуды, поэтому её сохранение предотвращает послеоперационное рубцевание, вызывающее сужение просвета подключичной вены (основная причина постмастэктомических отёков руки). Данную операцию в настоящее время считают оптимальной при узловых формах РМЖ – она носит функционально-щадящий характер и не увеличивает частоту возникновения местных рецидивов, по сравнению с операциями Холстеда и Пэйти.
В отечественной практике с 90-х гг. XX века выполняется модифицированный вариант радикальной мастэктомии – радикальная резекция молочной железы – с сохранением большой и малой грудных мышц, предложенный в клинике опухолей молочных желез в Российского онкоцентра им. Н.Н. Блохина РАМН. Операция заключается в удалении молочной железы в одном блоке с лимфатическими узлами надключично-подмышечно-подлопаточной зоны (рис. 35).
Одновременно с железой удаляют прилежащую к ней кожу с подкожной клетчаткой на расстоянии 5 см от макроскопических краев железы (границы: сверху – второе межреберье, медиально – противоположный край грудины, латерально – задняя подмышечная линия, снизу – на 5 см ниже субмаммарной складки).
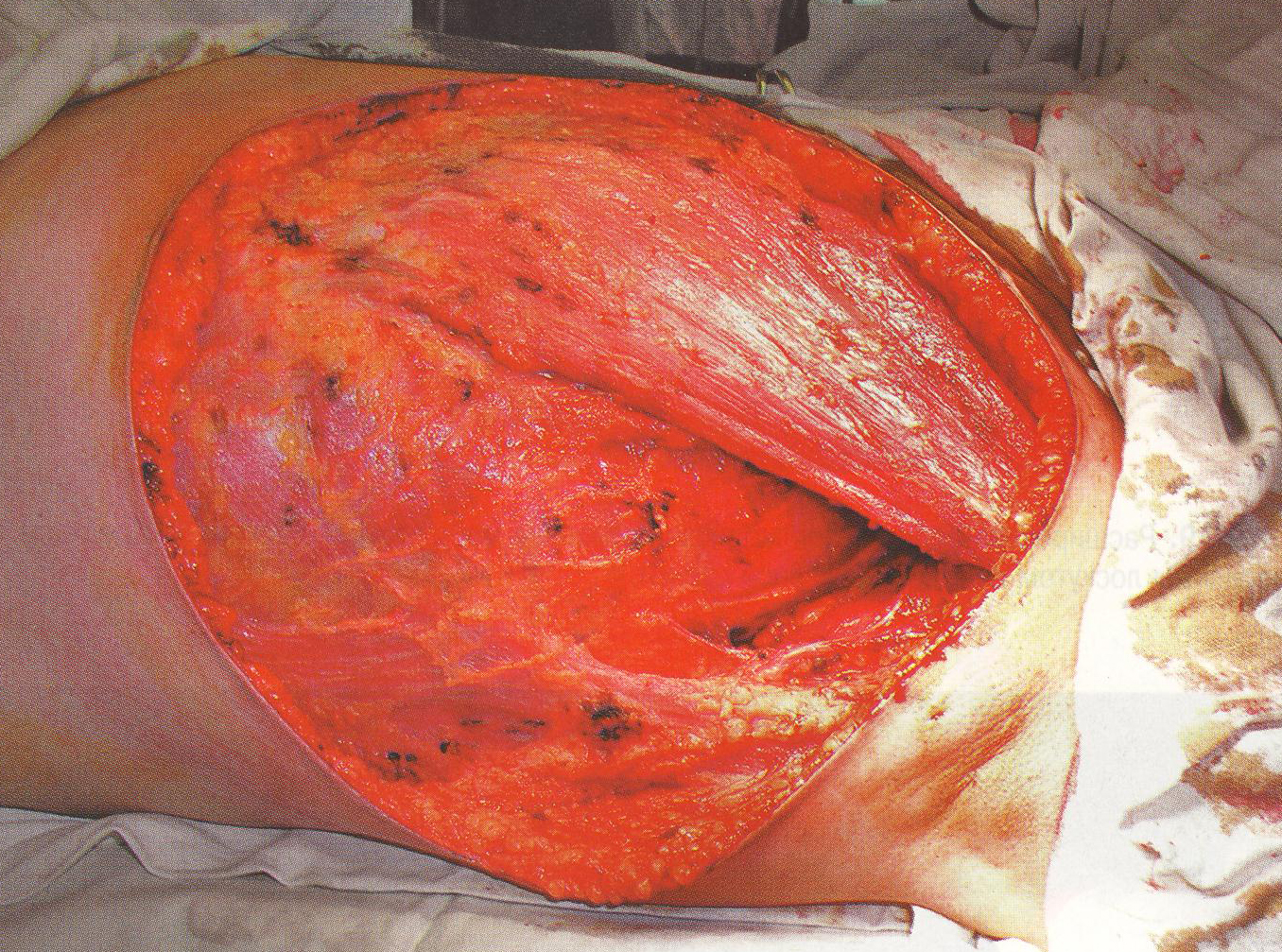
Рис. 35. Радикальная расширенная модифицированная мастэктомия.
Тканевый дефект закрывают кожно-подкожным лоскутом, формируемым путем продления разреза из углов раны вниз и кнаружи или перемещенным на сосудистой ножке или без нее нижнеабдоминальном лоскутом. Данную операцию применяют для лечения отечных форм РМЖ, больших опухолей с изъязвлением и «рожеподобного» рака, т.е. при существовании вероятности продолжения роста новообразования после выполнения традиционных мастэктомий Холстеда, Пэйти, Маддена.
В настоящее время в широкую клиническую практику вошли оперативные вмешательства меньшего, чем радикальная резекция, объема. Это – туморэктомия, лампэктомия, которые используются при ранних стадиях РМЖ, когда достаточно велики размеры самой молочной железы, а границы резекции проходят, отступив 1 см от видимого края опухоли. При этом необходимо подчеркнуть 2 обязательных обстоятельства: рентгенологический контроль удаленного препарата и срочное гистологическое исследование краев резекции. Выполнение этого типа операции возможно только при отсутствии указаний на поражение краев разреза.
Тенденция сокращения объема операций на молочной железе коснулась и лимфодиссекции при ранних стадиях РМЖ. В этой связи В.М. Cabanas et al. выдвинули концепцию «сторожевого» лимфатического узла, куда в первую очередь осуществляется лимфоотток из пораженного участка. Узел является своеобразным фильтром для опухолевых клеток и, таким образом, первым поражается метастазами (рис. 36).
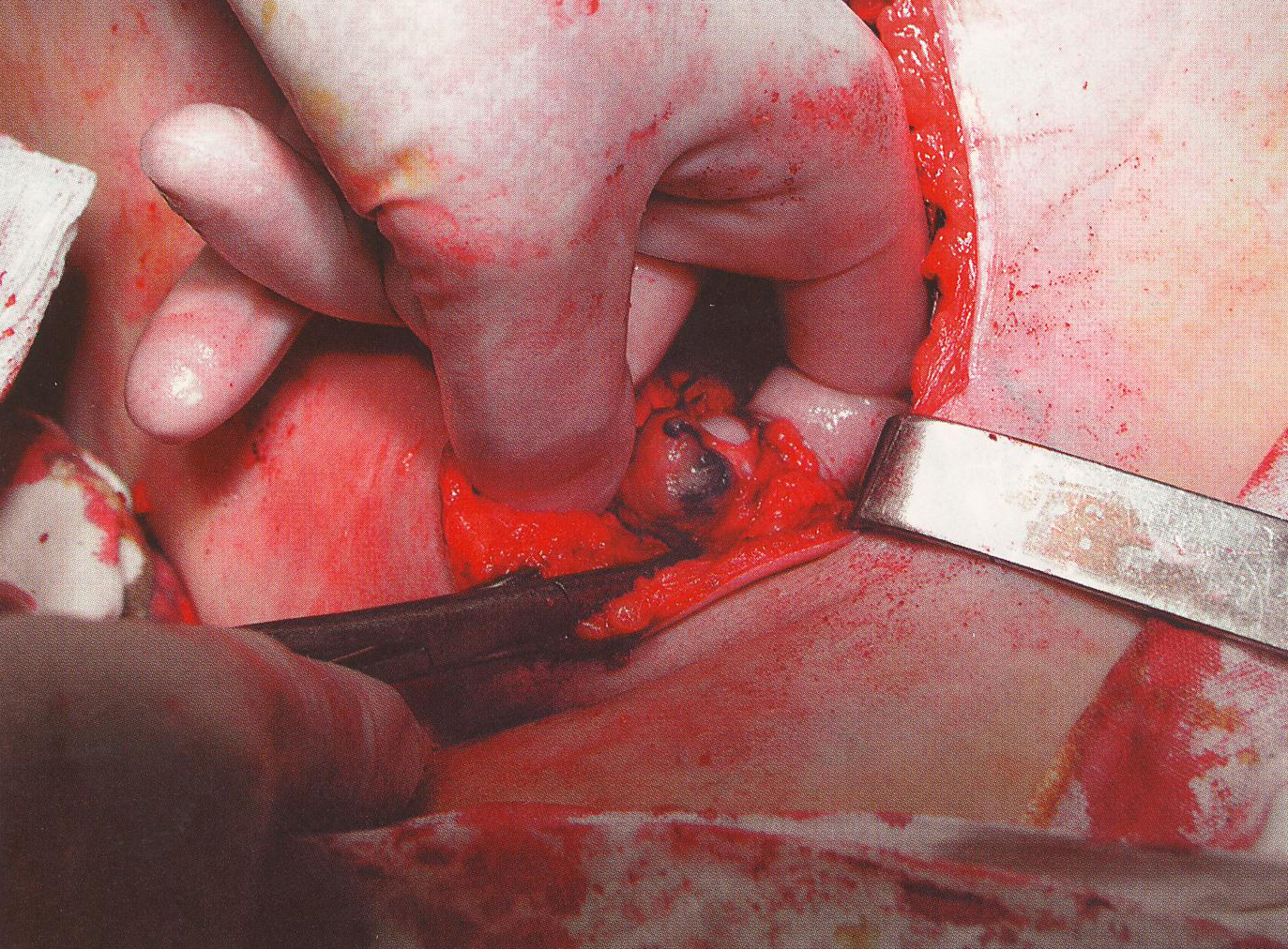
Рис. 36. Удаление сторожевого лимфатического узла.
Для определения возможных путей лимфогенного метастазирования и «сторожевых» лимфоузлов применяются лимфотропный радиофармацевтический препарат (99mТе «Наноцисс»), обзорная сцинтиграфия с использованием компьютерного гамма-томографа до операции и портативного гамма-сканера C-TRAC (Arrow-Medical, США), состоящего из датчика-щупа и счетной камеры. А для визуализации «сторожевых» лимфатических узлов применяется синий краситель, вводимый в несколько точек по периметру опухоли за 1 ч. до оперативного вмешательства.
В последующем выполняется морфологическое исследование удаленных лимфоузлов с изготовлением парафиновых блоков, окрашенных гематоксилин-эозином, причем «сторожевые» лимфатические узлы исследуются на 10 срезах, а все остальные – с изготовлением 3 срезов с каждого лимфоузла.
Истинноположительным считается результат, при котором в «сторожевом» лимфатическом узле выявляли метастазы рака, истинноотрицательным – при котором ни в «сторожевых», ни в других лимфоузлах метастатического поражения не обнаружено. Точность и чувствительность метода составляет 96,8 и 93,2% соответственно. В результате методика позволяет значительно сократить объем оперативного вмешательства на зонах регионарного метастазирования и может быть рекомендована для широкого применения.
