
- •Введение в экологическую химию
- •Глава 1
- •§ 1.1. Биосфера и происхождение жизни на земле
- •§ 1.2. Энергетический и материальный баланс биосферы
- •§ 1.3. Антропогенное воздействие на окружающую среду
- •§ 1.4. Ограниченность природных ресурсов
- •§ 1.5. Энергетика и экология
- •1.5.1. Тепловые электростанции
- •1.5.2. Гидроэлектростажцжи
- •1.5.3. Атомные эяею1росташщи
- •1.5.4.1. Утилизация солнечной энергии
- •1.5.4.2. Термоядерная энергетика
- •1.5A3. Энергия ветра
- •1.5.4.4. Энергия прилива
- •1.5.4.5. Геотермальная энергия
- •1.5.4.6. Другие нетрадиционные источники
- •§ 1.6. Экономические и социальные проблемы охраны окружающей среды
- •Глава 2
- •§ 2.1. Мониторинг как система наблюдения и контроля за состоянием окружающей среды
- •§ 2.2. Процессы массопереноса загрязняющих веществ
- •§ 2.3. Методы контроля загрязняющих веществ в объектах окружающей среды
- •2.3.1. Спектральные методы анализа
- •Глава 3 круговорот веществ в биосфере
- •§ 3.1. Круговорот кислорода, фотосинтез
- •§ 3.2. Круговорот азота
- •§ 3.3. Круговорот фосфора и серы
- •Глава 4 экохимические процессы в атмосфере
- •§ 4.1. Физико-химические свойства атмосферы
- •§ 4.2. Химические процессы в верхних слоях атмосферы
- •§ 4.3. Химические процессы в тропосфере с участием свободных радикалов
- •§ 44. Вода в атмосфере
- •§ 4.5. Проблемы локального и глобального загрязнений воздушной среды
- •4.5.4.1. Монооксид углерода
- •4.5.5. Тяжелые металлы
- •§ 4.6. Способы очистки газовых выбросов
- •4.6.1. Очистка газов от твердых частиц
- •4.6.2. Очистка от газовых примесей
- •Глава 5
- •§ 5.1. Почвенные ресурсы
- •§ 5.3. Почва и вода, эрозия почв
- •§ 5.5. Загрязнение почв пестицидами
- •§ 5.6. Утилизация и переработка твердых отходов
- •Глава 6
- •§ 6.1. Краткие сведения о гидрохимии и гидробиологии
- •§ 6.2. Ашропошнное эвтрофиговжниё водоемов
- •§ 6.3. Лигандный состав и формы существования
- •§ 6.4. Внутриводоемный круговорот пероксида
- •§ 6.5. Роль донных отложений в формировании качества водной среды
- •Глава 7
- •§ 7.1. Виды загрязнений и каналы самоочищения водной среды
- •§ 7.2. Физико-химические процессы на границе раздела фаз
- •§ 7.3. Микробиологическое самоочищение
- •§ 7.4. Химическое самоочищение
- •7.4.1. Гидролиз
- •7.4.2. Фотолиз
- •7.4.3. Окисление
- •§ 7.6. Свободные радикалы в природных водах
- •7.6.2. Свойства радикалов Oj, он
- •§ 7.7. Моделирование поведения загрязняющих веществ в природных водах
- •Глава 8
- •§ 8.1. Молекулярный кислород как окислитель. Образование и свойства металл-кислородных комплексов
- •§ 8.2. Механизмы активации пероксида водорода,
- •§ 8.3. Типовые механизмы каталитических процессов окисления с участием 02, н202
- •§ 8.4. Перспективы технологического использования 02 и н202 как экологически чистых окислителей
- •§ 8.5. Внутриклеточные окислительно-восстановительные процессы с участием 02 и н202
- •Глава 9
- •§ 9.1. Общие сведения о структуре и функции
- •§ 9.2. Виды токсического воздействия загрязняющих веществ
- •§ 9.3. Биотесгирование в оценке загрязнения водной среды
- •Глава 10
- •§ 10.1. Характеристики сточных вод и виды их загрязнений
- •§ 10.3. Особенности биохимической очистки сточных вод
- •10.3.1. Аэробные методы очистки
- •10.3.1.1. Биологические пруды
- •10.3.1.3. Биофильтры
- •10.3.3. Биохимические процессы с участием минеральных форм азота
- •Глава 11
- •§ 11.1. Подготовка питьевой воды
- •§ 11.2. Применение хлора, озона и пероксида водорода в обработке воды и очистке сточных вод
- •1L2.2. Озонирование воды
- •§ 11.3. Методы локальной очистки сточных вод
- •11.3.3. Деструктивные методы очистки
1L2.2. Озонирование воды
В поисках альтернативных путей обеззараживания и очистки сточных вод с применением сильных окислителей большие надежды возлагаются на озонирование вод. В процессе озонирования происходят
359
одновременное окисление примесей, обесцвечивание, дезодорация, обезвреживание сточной воды и насыщение ее кислородом. Достоинством метода является то, что в воду не вносятся химические реагенты. Хотя применение хлора экономически и технологически предпочтительнее, чем озонирование, но экологически целесообразней применение в качестве окислителя озона.
Метод озонирования, несмотря на дороговизну, имеет ряд преимуществ, Озонирование позволяет разрушать загрязнения, которые не подвергаются окислению хлором или биологическим способом. Сочетание озонирования с другими методами очистки промышленных сточных вод, такими, как У Ф-изл учение, обработка воды Оз совместно с Н2О2 с последующим биологическим окислением частично окисленных и гидроксилировашшх производных или с реагентным коагулированием, делает озонирование одним из наиболее перспективных методов очистки не только в экологическом, но и в гигиеническом, и в экономическом аспектах. Экономически применение озона оправдано еще и потому, что после озонирования сточных вод необходимо применение гораздо более низких доз коагулянтов, повышаются скорости и глубина очистки, разрушаются токсичные вещества, деструкция которых не достигается другими методами.
Озон может быть использован для очистки сточных вод от цианидов, роданидов, сероводорода, мышьяка и других токсичных веществ. Так, при рН > 13 эффективно осуществляется окисление цианида:
CN" + Од —► CNO" + 02 (б)
Окисление органических веществ озоном может протекать до образования таких промежуточных продуктов, как спирты, альдегиды, кетоны, кислоты, и более глубоко — до СОг и Н20. Однако расход озона при этом существенно возрастает и скорость по ходу процесса очистки резко уменьшается. Для ускорения процессов окисления органических примесей сточных вод озоном используют катализаторы, например соединения меди.
При использовании озона в очистке сточных вод ставится задача управления процессом очистки тайим образом, чтобы минимизировать затраты озона при достижении максимального эффекта. При решении этой задачи первостепенное значение имеют кинетические закономерности процесса озонирования.
При очистке многокомпонентных стоков начальная брутто-скорость очистки пропорциональна концентрации Оз и величине ХПК. После удаления 50—75% легкоокисляемых органических веществ скорость окисления оставшихся загрязнителей резко падает. Как правило, при 360
озонировании бытовых стоков наиболее интенсивно процесс протекает в первые 20—30 мин, после чего скорость процесса лимитируется способностью озона вступать в реакцию с трудноокисляемыми соединениями. Увеличение времени озонирования приводит к значительному повышению удельного расхода озона.
Дозы озона, обеспечивающие полное окисление органических соединений до С02 и Н20, достигают значительных величин. Например, для полной деструкции фенола (ХПК = 2,38 мг 02/мг) требуется 7,14 мгОз/мг или 14 моль Оз на 1 моль фенола. Проводить такой процесс на практике экономически не выгодно.
Тем не менее озон применяется для деструктивного окисления органических веществ в сточных водах целлюлозно-бумажных производств, для разрушения хлорированных углеводородов, для очистки стоков от фенолов, нефтепродуктов, СПАВ, нитросоединений, тетра-этилсвинца, канцерогенных веществ, циан- и ртутьсодержащих соединений, для доочистки биологически очищенных бытовых сточных вод. Кроме того, озон может использоваться для очистки природных вод от гумусовых веществ, от продуктов отмирания сине-зеленых водорослей и загрязняющих веществ (фенолов, нефтепродуктов, пестицидов). Обычно Оз применяют для подготовки питьевой воды.
Большое значение имеет использование озона для деструкции пестицидов. Особенно он эффективен при окислении таких токсичных пестицидов, как дихлофос, метафос, севин и др. Продуктами окисления этих соединений являются либо нетоксичные вещества, либо С02. Например, дихлофос медленно разрушается под действием Н202 и УФ-излучения, а при взаимодействии с хлором образует высокотоксичные хлорцроизводные. В то же время это соединение легко обезвреживается озоном при ничтожных дозах окислителя (0,2 мг Оа/мг). Севин устойчив по отношению к перманганату калия, оксиду марганца и Н202) тогда как при расходе 0,5 мг Оз/мт достигается полное разложение вещества.
Озон получается относительно просто. Обычно применяется метод пропускания воздуха или кислорода через электрический разряд высокого напряжения^ (5000—25 000 В). Ероизводительность такого озонатора в зависимости от его размеров — от 10 г до 10 кг озона в час. Имеются разработки озонаторов производительностью до 100 кг 08/ч.
Существующие способы озонирования имеют низкие показатели по использованию окислительного потенциала озона. При озонировании основные эксплуатационные затраты связаны с расходом электроэнергии на получение озона: в современных озонаторах расход электро-
361
энергии составляет 23 кВт-ч/кг, тогда как на получение хлора идет 1,46 кВт*ч/кг.
Озон, представляя собой модификацию кислорода, тем не менее сильно от него отличается. Он интенсивно окрашен, диамагнитен, токсичен и взрывоопасен. Предельно допустимая концентрация его в воздухе рабочей зоны — 0,0001 мг/л. Реакции, в которых участвует озон, обычно протекают быстро, в то же время растворимость у озона, как и у кислорода, очень низка и зависит от температуры. С ростом температуры увеличивается скорость разложения Оз в воде. Все это создает трудности для экспериментального изучения кинетики и механизмов процессов окисления с участием 03.
Окислительное действие озона связано с протеканием процессов двух типов: прямого молекулярного взаимодействия с веществом и через промежуточные свободные радикалы (см. § 7.6).
Озон реагирует с донорами Н и насыщенными органическими соединениями с образованием свободных радикалов:
DH" + 03 —► If + 02 + ОН (7)
RH + 03 —► Rz + 02 + ОН (8)
При наличии у органического соединения двойной связи озон присоединяется к ней с образованием реакционноспособных озонидов:
R~CH=CH2 + Оз —* R-CH-0-CH2 (9)
I I
о о
При взаимодействии Оз с ароматическими соединениями, в частности с бензолом, гидролитическое расщепление образующегося озо-нида приводит к получению глиоксаля, глиоксалевой и щавелевой кислот.
Низкая растворимость в воде приводит к потере 20—30% Оз, что значительно загрязняет воздушную среду. Эффективность применения озона при очистке сточных вод повышается в присутствии активированного угля за счет увеличения времени контакта разрушаемых примесей с озоном.
С целью увеличения эффективности озонирование используют в сочетании с другими окислителями. Такое сочетание не только повышает эффективность очистки сточных вод, но и снижает расход окислителей. Эффективность таких редокс-систем с использованием озона повышается за счет введения в раствор гетерогенных и гомогенных катализаторов. По-видимому, в таких системах озон выступает как источник свободных радикалов, а редокс-партнер совместно с 02 учас-362
твует в реакциях продолжения цепи при реализации радикально-цепного механизма окисления органических веществ.
Все большее применение находят редокс-системы с озоном для очистки сточных вод животноводческих ферм аграрно-промышленных комплексов. Сочетание 03 с Н202 позволяет эффективно очистить сточные воды одновременно от фенолов, род анидов и акрил атньрс производных. Степень очистки сточных вод от тетраэтилсвинца в присутствии диоксида марганца выше, чем в его отсутствие, и расход Оз при этом значительно сокращается.
Совместное озонирование и* хлорирование гумусовых веществ сопровождается их деструкцией до более простых соединений, вплоть до С02.
Эффективно применение озона в сочетании с биологической очисткой. При этом озонирование используется как промежуточная стадия для частичной окислительной деструкции и гидроксилирования соединений, не поддающихся биохимическому окислению. Такой технологический прием призван повысить эффективность биохимической очистки и снизить расход 03. В этой связи к недостаткам озона в качестве окислителя следует отнести его взаимодействие с содержащимися во многих видах промышленных сточных вод аммонийными соединениями. Очистка от этих соединений эффективно осуществляется биологическими методами. При использовании же озона для пред-очистки таких вод значительная часть его бесполезно расходуется на окисление аммонийных соединений.
11.2.3. Дероксид водорода как экологически чистый окислитель
По сравнению с озоном пероксид водорода обладает рядом преимуществ: он хорошо растворим в воде, устойчив в растворе в широком диапазоне рН и температур, позволяет осуществлять высокоселективное окисление различных примесей сточных вод при подборе условий проведения процесса, может инициировать неспецифические радикальные процессы окисления с участием радикалов ОН. Плюс к этому высокая стабильность по сравнению с другими окислителями, сравнительная простота аппаратурного оформления процессов окисления с участием Н202, отсутствие токсичности; остаточный пероксид водорода способствует процессам последующей аэробной биологической очистки и благоприятно сказывается на состоянии водных экосистем.
В силу своих технологических преимуществ пероксид водорода получил широкое распространение в зарубежной практике очистки промышленных сточных вод. В настоящее время он применяется для
363
очистки многих видов сточных вод различных отраслей промышленности, в том числе таких крупнотоннажных, как горнодобывающая, машиностроительная, химическая, целлюлозно-бумажная, легкая и др.
Широкому применению Н202 в технологии очистки промышленных сточных вод в нашей стране препятствуют сравнительно высокая его стоимость и дефицитность.
Пероксид водорода может эффективно использоваться для очистки сточных вод как от неорганических, так и органических соединений (А.А. Селюков, А.Й. Тринько, 1988).
Наиболее эффективно под действием Н202 окисляются соединения серы, в частности сероводород и растворимые сульфиды, являющиеся распространенными загрязнителями бытовых и промышленных вод.
Сероводород является побочным продуктом многих промышленных процессов, таких, как производство целлюлозы, переработка нефти, дубление кожи, коксование угля и т.д. Кроме того, сероводород образуется в бытовых сточных водах при возникновении анаэробных условий. При ограничении доступа воздуха к сточным водам свободный кислород быстро расходуется микроорганизмами, которые далее извлекают кислород из растворенных солей. Первыми разрушаются нитриты, затем нитраты и сульфаты. Этот процесс приводит к образованию аммиака и сероводорода.
При значениях рН, близких к нейтральным (< 8), что обычно
встречается в бытовых сточных водах, сероводород в течение 15—60 мин окисляется пероксидом водорода до элементарной серы:
H2S + Н202 —► 2Н20 + S (10)
В щелочной среде сульфиды окисляются до серной кислоты:
S2" + 4Н202 -» SOi" + 4Н20 (И)
По отношению к сероводороду и сульфидам пероксид водорода является селективным окислителем. Эта селективность обусловлена относительно быстрым протеканием реакции окисления соединений серы и химической инертностью пероксида водорода по отношению к аммонийным и другим органическим соединениям, обычно встречающимся в сточных водах. Это выгодно отличает Н202 от других окислителей.
С помощью Н202 могут быть легко окислены различные меркаптаны (RSH), сульфиты (SOi"), тиосульфаты (320з")> диалкилсульфиды (RSR) и диалкилдисульфиды (RSSR), присутствующие обычно в сточных водах производства целлюлозы, нефтеочистки и др.: 364
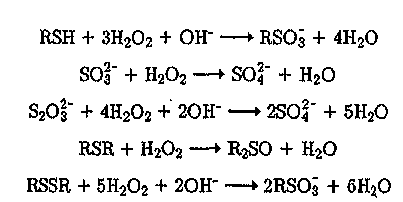
Кроме того, пероксид водорода эффективно окисляет полисульфиды
(SiDi использующиеся в качестве наполнителей, связующих добавок и в качестве инсектицидов:
![]() (17)
(17)
а также дитиониты (S2O4), применяемые в текстильных процессах крашения и при отбелке целлюлозы, соли, сахара и др. В щелочной
среде при 20°С окисление S2O4" до сульфата протекает за 20 мин по реакции
![]() (18)
(18)
В кислом растворе возможно образование дитионатов (БгОб")
![]() (19)
(19)
которые устойчивы к окислению, но при нагревании в щелочном растворе разлагаются на смесь сульфитов и сульфатов:
![]() (20)
(20)
Кроме того, пероксид водорода используется для очистки воды от цианидов, нитритов, нитрилов и ряда других соединений азота. Наиболее широкое применение находит Н2О2 для разрушения цианидов в сточных водах металлургии^ - гальванических производств и химической промышленности:
![]() (21)
(21)
Реакция протекает при рЫ 9—10, ускоряется при повышении температуры (до 50°С) и в присутствии ионов меди (5—10 мг/л), а также бромид-ионов в качестве катализаторов.
Эффективность очистки сточных вод, содержащих цианиды, может быть значительно повышена путем обработки их пероксидом водорода в присутствии озона (1:1), при использовании Н202 в сочетании с
365
формальдегидом, а также в присутствии элементарной серы или соединений, способных реагировать с пероксидом с образованием серы. Окисление цианидов пероксидом водорода значительно ускоряется прц одновременном воздействии УФ-излучения при рН 9—12.
Органические цианиды (нитрилы) и циангидрины, характерные для сточных вод производств акрилонитрила, метилметакрилата и ацетонитрила, также эффективно окисляются пероксидом водорода:
(22)
(23)
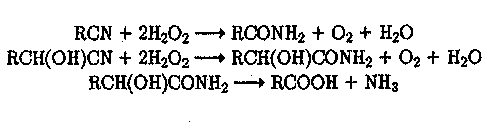 (24)
(24)
Реакции протекают быстро в щелочной среде при повышенной температуре.
Преимуществом обработки сточных вод, содержащих цианиды, пероксидом водорода над широко используемыми для этой цели производными хлора является эффективное окисление при относительно' низких значениях рН и возможность обработки высоких концентраций без опасности выделения таких токсичных соединений, как хлорциан. Возможность обработки при более низких значениях рН важна при очистке больших количеств низкоконцентрированных сточных вод, где основные затраты приходятся на реагенты для регулирования рН.
Пероксид водорода используется также для очистки сточных вод процессов вулканизации резины, нитрования, тепловой обработки металлов от нитрито.» (™™ «и 9—fiV
![]() (25)
(25)
За рубежом пероксид водорода широко используется в мокрой очистке газов, в том числе для обезвреживания соединений типа NOap. Основными источниками выделения оксидов азота (см. п. 4.5.3) являются производство азотной кислоты, нитрование органических соединений (производство взрывчатых веществ, красителей, пластмасс), высокотемпературное горение топлива и термическая обработка металлов. В водном растворе оксиды азота окисляются пероксидом водорода по уравнениям
(26)
(27)
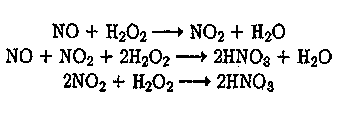 (28)
(28)
366
В действительности механизм сложен, предполагается, что проме-
жуточным продуктом является азотистая кислота, которая в воде разлагается:
![]() (29)
(29)
При окислении N0 в качестве промежуточных продуктов образуются также N203 (NO +. N02) и N2O4 (N02 + NO2). Эти соединения быстро реагируют с Н2О2 по уравнениям
(30)
![]() (31)
(31)
Пероксид водорода способен непосредственно окислить азотистую кислоту в азотную, что является одним из преимуществ этого окислителя. Эффект очистки газов от моноксида азота составляет .85—95%, а от диоксида — 95—99,9%. Все другие известные способы мокрой очистки газов от оксидов азота менее эффективны.
Пероксид водорода служит также эффективным реагентом для очистки сточных вод от активного хлора. Хлор в различных формах присутствует во многих промышленных сточных водах и обычно используется для обеззараживания сточных вод перед сбросом в водоемы. Содержание хлора особенно высоко в сточных водах хлорных заводов и водах тепловых электростанций, использующих его для борьбы с обрастаниями в охладительных системах.
Пероксид водорода взаимодействует со всеми формами свободного хлора, но скорость реакции зависит от рН. Хлор и хлорноватистая кислота реагируют медленно, гипохлорит — очень быстро. Поэтому дехлорирование пероксидом водорода должно проводиться при рН 7—9, где гипохлорит-ионы являются преобладающей формой активного хлора:
![]() (32)
(32)
Реакция заканчивается за несколько минут.
Пероксид водорода может использоваться и для очистки от соединений тяжелых металлов. Так, в сточных водах фотопромышленности, цехов гальванических покрытий, в отходах добычи и обогащения руд присутствуют соединения серебра. В форме свободных ионов серебро токсично для микроорганизмов, поэтому присутствие серебра в сточных водах, поступающих на биологическую очистку, нежелательно. При обработке таких сточных вод пероксидом водорода в кислой среде ионы серебра восстанавливаются до металлического состояния:
367
![]()
![]()
2Fe2+ + Н202 + 2Н+ —► 2Fe3+ + 2H20 (34)
Перманганат легко разрушается пероксидом водорода при очистке вод от Mn(VII). В кислой среде (* 10"2 М H2SO4) реакция протекает по стехиометрическому уравнению:
![]()
2Мп04 + 5Н202 + 6Н+ —> 2Мп2+ + б02 + 8Н20 (35)
Эта реакция обычно используется для определения концентрации растворов Н202. Катализатором ее служит МпОг, поэтому рекомендуется первую каплю МпС>4 добавить в титруемый раствор пероксида до закисления его серной кислотой.
Аналогичным образом соединения хрома (VI), содержащиеся в сточных водах гальванических цехов и предприятий кожевенной промышленности, восстанавливаются при рН < 3,5 до Сг(Ш):
![]()
2СгО^" + ЗН202 + ЮН+ —► 2Сг3+ + 302 + 8Н20 (36)
Пероксид водорода используется и для очистки сточных вод от некоторых органических* соединений. Так, в сточных водах текстильной промышленности, производстве строительных материалов и органических растворителей присутствует формальдегид. Окисление формальдегида пероксидом водорода протекает быстро, причем образующаяся муравьиная кислота окисляется далее до С02:
![]()
СН20 + 2Н202-~КЮ2 + ЗН20 (37)
Окисление до кислоты протекает за 10 мин, после чего реакция замед-ляется. реакция ускоряется в присутствии катализаторов - платини-рованного графита, палладия. Особенно эффективно реакция протекает при повышении температуры до 50°С и выше. При окислении высоких концентраций формальдегида совместно с другими органическими веществами предложено в качестве катализатора использовать активированный уголь при температуре 240°С.
Алифатические спирты (включая метанол) и карбоновые кислоты (за исключением муравьиной), а также жирные спирты эффективно окисляются пероксидом водорода лишь в присутствии катализаторов, главным образом ионов железа (реактив Фентона), инициирующими распад Н202 на ОН-радикалы. При использовании реактива Фентона 368
за 3 ч при комнатной температуре достигаются следующие эффекты очистки спиртов (при исходной концентрации общего органического углерода 255—275 мг/л): метанол — 98%, этанол — 52, пропанол — 67, бутанол — 66; кислот (365—445 мг С/л): муравьиная — 98%, уксусная — 36%, пропионовая — 60%.
Низкомолекулярные карбоновые и оксикарбоновые кислоты эффективно окисляются пероксидом водорода под действием УФ-излучения (рН 1—7). При этом достигается снижение ХПК стока с 3200 до 60 мг/л.
Среди наиболее распространенных компонентов промышленных сточных вод находятся различные фенолы. Они присутствуют в стоках процессов коксования угля, нефтеочистки, металлургии, фотопромышленности, различных химических производств и др. Реакции окисления фенолов пероксидом водорода протекают эффективно в широком диапазоне температур и концентраций. В качестве продуктов окисле-ния фенола первоначально образуются гидрохиноны и катехины, которые затем окисляются до соответствующих хинонов и далее до дикар-боновых кислот, в конечном итоге до С02. В качестве катализаторов при рН 3—4 используют соли железа (II), а также порошкообразные или гранулированные железо и медь либо марганцевый катализатор, получаемый нанесением на силикагель соединений марганца.
Окисление хлорфенолов и диметилфенолов пероксидом родорода протекает в присутствии катализаторов — солей железа (II) или железа (III) — более эффективно, чем окисление простых фенолов.
Глубокое окисление фенолов при концентрациях < 100 мг/л достигается применением H202 совместно с УФ-излучением.
Гидрохинон является компонентом отработанных фотографических растворов, сточных вод производств резины и различных органических продуктов. В присутствии соединений железа при рН 4—6 он окислялся за несколько минут до смеси двухосновных кислот (малеи-новая и др.), которые затем окисляются до СОг-
Реактив Фентона, а также совместное действие Н202 и УФ-излучения эффективно разрушают ПАВ, присутствующие в различных видах промышленных сточных вод. В качестве катализаторов наряду с солями железа используются соли меди (II).
При очистке сточных вод производства гидразингидрата используют пероксид водорода с ионами меди в качестве катализатора:
N2H4
• Н20
+ 2Н202
СП^
»
N2
+ 5H20 (38)
Серьезные затруднения вызывает очистка сточных вод от красите- 12-235 369
лей. Большинство красителей, применяемых в текстильной промыш-ленности, может практически в неизменном виде проходить через установки биохимического окисления. При использовании Н2О2 для разрушения красителей (включая дисперсные) в качестве катализатора используются реактив Фентона или соли меди.
Применение Н2О2 совместно с ионами железа (II, III) позволяет при рН 3--5 окислять 30—65% органических примесей бытовых сточных вод до СОг- При обработке сточных вод пероксидом водорода в присутствии солей меди и железа значительно снижается ХПК воды. При окислении пероксидом водорода органических компонентов сточных вод в качестве катализатора используется также продукт спекания солей Со (III) с активированным древесным углем.
В промышленности Н2Ог получают различными методами, главным образом при окислении кислородом изопропилового спирта с последующим каталитическим гидрированием образующегося ацетона. Разработан способ производства ЩОг, основанный на каталитическом окислении алкилантрахинонов с последующим гидрированием хинонов на Pt~, Pd-, алюмосиликатных катализаторах. Известен также метод электрохимического синтеза Н2О2 на основе процесса катодного восстановления кислорода. Затраты на получение 1 кг Н2О2 (100%) составляют сейчас 10 кВт*ч электроэнергии. В новых разработках затраты снижены до 4,5 кВт«ч, что намного ниже, чем затраты на производство Оз, хотя и несколько выше, чем на производство С1г (см. выше). В то же время, учитывая разность молекулярных масс Н2О2 и С1г в расчете на окислительный эквивалент, стоимость Н202 приближается к стоимости активного хлора.
Эффективность окислительного действия пероксида водорода связана с тем, что молекулу Н2О2 можно рассматривать как димер ОН~ радикала, который сравнительно легко рарпадается на радикалы ОН. Реализация условий для наиболее эффективного разложения Н2О2 на ОН-радикалы и создает предпосылки для глубокой деструкции практически любых органических соединений.
Городские сточные воды несут в себе множество легкоокисляемых веществ, в том числе и веществ, обладающих восстановительными свойствами, а также ионы металлов переменной валентности — потенциальные катализаторы процессов окисления.
При наличии в стоке веществ-восстановителей наряду с окислением LFe (II) кислородом воздуха (акваион железа (II) окисляется кислородом крайне медленно, процесс резко ускоряется при образовании хелатных комплексов с полидентатными кислородсодержащими лиган-дами типа ЭДТА, лимонной и винной кислот) будет происходить восстановление Fe (III). В этом случае реализуется циклический механизм 370
окисления легкоокисляемых веществ сточных вод с попеременным окислением — восстановлением ионов железа.
При добавке в такой аэрированный сток пероксида водорода он будет распадаться на радикалы, инициируя цепные радикальные процессы сопряженного окисления легко- и трудноокисляемых органических веществ с вовлечением растворенного кислорода. Разложение Н2О2 в сточной воде сопровождается уменьшением ХПК. В пересчете на мг Ог/л в коммунально-бытовых сточных водах величина ХПК изменяется примерно в 10 раз больше, чем распадается Н2Ог. Таким образом, относительно небольшие добавки Н2О2 могут использоваться как инициаторы радикальных процессов очистки сточных вод.
Смешение стоков, содержащих вещества восстановительной природы (это могут быть и газовые выбросы), с другими стоками, содержащими трудноокисляемые соединения, в присутствии Н2О2 и ионов металлов будет способствовать радикальному окислению этцх соединений.
В отсутствие дополнительных внешних воздействий процесс сопряженного окисления легко- и трудноокисляемых веществ тормозится по мере исчерпания веществ-восстановителей или деструкции лигандов, активирующих ионы железа. Эта трудность устраняется при использовании для разложения Н2О2 УФ-излучения.
Под действием УФ-излучения происходит распад H2Q2 на радикалы ОН:
Н202 —* 20Н (39)
При этом пероксид водорода добавляют в сточную воду несколько больше, чем в стехиометрических количествах (Н2О2/ХПК > 2,1). При значении ХПК 400 мг 02/л на цолную очистку 1000 м3 сточной воды расходуется 0,8 т Н2О2 (в расчете на 100%).
Снижение расхода Н202 (1,75 ХПК) достигается при применении импульсного УФ-излучения с добавками в раствор одновременно Н2О2 и ионов железа.
11.2.4. Фотохимическая и радиап^онно-химическая очистка воды
В практике очистки, обеззараживания и дехлорирования сточных вод все большее применение находит УФ-излучение. Так, УФ-излучение эффективно разрушает ксантогенаты, крезолы, нефтепродукты, циклогексанол, гексацианоферраты и другие соединения. Особенно эффективное действие оказывает УФ-излучение на очистку аэриру-
371
емых сточных вод в присутствии ионов железа при рН 2—4, когда фотолиз FeOH2+ служит источником ОН-радикалов.
Инициирование окислительных процессов УФ-излучением при очистке промышленных сточных вод от трудноокисляемых загрязняющих веществ позволяет значительно повысить степень очистки, расширить диапазон методов деструктивного окисления сточных вод. Экологические преимущества таких методов очевидны, так как практически не вносятся дополнительные загрязнения, а продукты частичного окисления и гидроксилирования ксенобиотиков, как правило, имеют повышенную лабильность в плане биодеградации, чем исходные вещества.
При воздействии УФ-излучения на многокомпонентный коммунально-промышленный сток в воде осуществляется множество фотохимических превращений с образованием свободных радикалов и других реакционноспособных частиц (см. § 7.4 и 7.6). Происходит и интенсивное образование НгОг- Присутствие в воде Ог и примесей ионов меди и железа способствует возникновению радикальных реакций с вовлечением в процесс окисления трудноокисляемых веществ. Вследствие этого разрушается значительная часть ароматических и трудноокисляемых соединений (понижается ХПК), сток становится биохимически легче усваиваемым. Сочетание УФ-излучения сточных вод, особенно с одновременными добавками Н2О2 в условиях аэрации, с последующей биохимической очисткой позволяет значительно улучшить функциональное состояние активного ила и параметры очистки стока, а также интенсифицировать процесс (увеличить на 20—30% пропускную способность очистных сооружений без существенных капитальных затрат).
Пока что широкое применение УФ-излучения находят лишь при бактерицидной обработке природных и сточных вод, прошедших биологическую очистку. В то же время преимущества этого способа, особенно в сочетании с Н202, по сравнению с озонированием очевидны.
Для стерилизации сточных вод, прошедших биологическую очистку, помимо ультрафиолета используется также ионизирующее излучение, являющееся источником свободных радикалов ОН, Oji. Прошедшие радиационную обработку биологически очищенные сточные воды обладают всем комплексом свойств, делающих ее пригодной для использования в теплоотводящих водооборотных системах. В качестве источников излучения применяют 7-изотопы 60Co, 137Cs, а также ускорители электронов.
Эффективно применение радиационного метода очистки сточных
372
вод при окислении таких примесей, как цианиды, фенолы, ПАВ при концентрации загрязняющих веществ 10"3—10"2 М.
Радиационно-химическая очистка, как и УФ-облучение, успешно сочетается с последующей биохимической очисткой сточных вод.
