
- •Введение в экологическую химию
- •Глава 1
- •§ 1.1. Биосфера и происхождение жизни на земле
- •§ 1.2. Энергетический и материальный баланс биосферы
- •§ 1.3. Антропогенное воздействие на окружающую среду
- •§ 1.4. Ограниченность природных ресурсов
- •§ 1.5. Энергетика и экология
- •1.5.1. Тепловые электростанции
- •1.5.2. Гидроэлектростажцжи
- •1.5.3. Атомные эяею1росташщи
- •1.5.4.1. Утилизация солнечной энергии
- •1.5.4.2. Термоядерная энергетика
- •1.5A3. Энергия ветра
- •1.5.4.4. Энергия прилива
- •1.5.4.5. Геотермальная энергия
- •1.5.4.6. Другие нетрадиционные источники
- •§ 1.6. Экономические и социальные проблемы охраны окружающей среды
- •Глава 2
- •§ 2.1. Мониторинг как система наблюдения и контроля за состоянием окружающей среды
- •§ 2.2. Процессы массопереноса загрязняющих веществ
- •§ 2.3. Методы контроля загрязняющих веществ в объектах окружающей среды
- •2.3.1. Спектральные методы анализа
- •Глава 3 круговорот веществ в биосфере
- •§ 3.1. Круговорот кислорода, фотосинтез
- •§ 3.2. Круговорот азота
- •§ 3.3. Круговорот фосфора и серы
- •Глава 4 экохимические процессы в атмосфере
- •§ 4.1. Физико-химические свойства атмосферы
- •§ 4.2. Химические процессы в верхних слоях атмосферы
- •§ 4.3. Химические процессы в тропосфере с участием свободных радикалов
- •§ 44. Вода в атмосфере
- •§ 4.5. Проблемы локального и глобального загрязнений воздушной среды
- •4.5.4.1. Монооксид углерода
- •4.5.5. Тяжелые металлы
- •§ 4.6. Способы очистки газовых выбросов
- •4.6.1. Очистка газов от твердых частиц
- •4.6.2. Очистка от газовых примесей
- •Глава 5
- •§ 5.1. Почвенные ресурсы
- •§ 5.3. Почва и вода, эрозия почв
- •§ 5.5. Загрязнение почв пестицидами
- •§ 5.6. Утилизация и переработка твердых отходов
- •Глава 6
- •§ 6.1. Краткие сведения о гидрохимии и гидробиологии
- •§ 6.2. Ашропошнное эвтрофиговжниё водоемов
- •§ 6.3. Лигандный состав и формы существования
- •§ 6.4. Внутриводоемный круговорот пероксида
- •§ 6.5. Роль донных отложений в формировании качества водной среды
- •Глава 7
- •§ 7.1. Виды загрязнений и каналы самоочищения водной среды
- •§ 7.2. Физико-химические процессы на границе раздела фаз
- •§ 7.3. Микробиологическое самоочищение
- •§ 7.4. Химическое самоочищение
- •7.4.1. Гидролиз
- •7.4.2. Фотолиз
- •7.4.3. Окисление
- •§ 7.6. Свободные радикалы в природных водах
- •7.6.2. Свойства радикалов Oj, он
- •§ 7.7. Моделирование поведения загрязняющих веществ в природных водах
- •Глава 8
- •§ 8.1. Молекулярный кислород как окислитель. Образование и свойства металл-кислородных комплексов
- •§ 8.2. Механизмы активации пероксида водорода,
- •§ 8.3. Типовые механизмы каталитических процессов окисления с участием 02, н202
- •§ 8.4. Перспективы технологического использования 02 и н202 как экологически чистых окислителей
- •§ 8.5. Внутриклеточные окислительно-восстановительные процессы с участием 02 и н202
- •Глава 9
- •§ 9.1. Общие сведения о структуре и функции
- •§ 9.2. Виды токсического воздействия загрязняющих веществ
- •§ 9.3. Биотесгирование в оценке загрязнения водной среды
- •Глава 10
- •§ 10.1. Характеристики сточных вод и виды их загрязнений
- •§ 10.3. Особенности биохимической очистки сточных вод
- •10.3.1. Аэробные методы очистки
- •10.3.1.1. Биологические пруды
- •10.3.1.3. Биофильтры
- •10.3.3. Биохимические процессы с участием минеральных форм азота
- •Глава 11
- •§ 11.1. Подготовка питьевой воды
- •§ 11.2. Применение хлора, озона и пероксида водорода в обработке воды и очистке сточных вод
- •1L2.2. Озонирование воды
- •§ 11.3. Методы локальной очистки сточных вод
- •11.3.3. Деструктивные методы очистки
7.4.3. Окисление
Процессы окисления ЗВ в природных водах могут быть двух типов: 1) в качестве окислителя участвуют ионы металлов в окисленной форме. Эти процессы наиболее вероятны для ЗВ, обладающих выраженными лигандными и восстановительными свойствами; 2) в окислении ЗВ участвуют свободные радикалы и другие реакционноспособные частицы, происхождение которых в природных водах будет подробно рассмотрено ниже.
Эффективная константа скорости каталитического окисления ЗВ (кц) может быть представлена в виде
![]()
где [М] — эффективная концентрация каталитически активной формы металла М в природной водной среде (см. § 6.3).
Оказалось, что среди ионов переходных металлов каталитические свойства в природных водах наиболее ярко проявляют ионы и комплексы меди, а также микроколлоидные частицы гидроксида железа. Растворимые фульватные комплексы железа малореакционноспособны.
Редокс-каталитические процессы самоочищения водной среды не ограничиваются лишь трансформацией загрязняющих веществ, обладающих электронно-донорными свойствами, за счет их прямого окисления ионами металлов переменной валентности. Наряду с фотохимическими реакциями редокс-каталитические процессы с участием Ог, Н2О2 приводят к образованию в природной водной среде активных промежуточных частиц, в частности свободных радикалов.
Эффективную константу скорости трансформации загрязняющего вещества Р под действием свободных радикалов можно представить в виде суммарного вклада различных радикалов и активных промежуточных частиц-окислителей
241
![]()
где к — бимолекулярная константа скорости взаимодействия радика-
R
л a R с веществом Р.
Следовательно, система самоочищения природной водной среды может быть охарактеризована совокупностью функциональных зависимостей между параметрами среды и внешних факторов, с одной стороны, и физико-химическими свойствами ЗВ — с другой. Зная свойства ЗВ, можно прогнозировать их наиболее вероятные пути трансформации в окружающей среде, а знал параметры водной среды — оценивать допустимую нагрузку на водоем по тому или иному ЗВ.
Эффективная константа скорости
самоочищения водной среды в отношении
вещества![]() Р
может быть представлена в виде
Р
может быть представлена в виде
где (р — значимые параметры среды (индексы Ь, г, ф, к, г соответствуют микробиологическому, гидролитическому, фотохимическому, каталитическому и радикальному каналам трансформации Р).
Очивидно, не все каналы трансформации одинаково значимы для разных ЗВ. Относительный вклад каждого из них зависит от природы вещества Р.
7.5. БИОГЕННОЕ ИНИЦИИРОВАНИЕ РАДИКАЛЬНЫХ ПРОЦЕССОВ САМООЧИЩЕНИЯ
Важное место в системе самоочищения природной водной среды занимают процессы образования и разрушения пероксида водорода. Наряду с каталазным разложением Н2О2 внутриводоемный круговорот пероксида водорода включает реакции пероксидазного окисления органических субстратов, а также абиотические каталитические и фотохимические процессы, сопровождающиеся образованием реакци-онноспособных частиц. При наличии в водной среде загрязняющих веществ — доноров Н (фенолов, аминов) — возможно их пероксидазное окисление с участием микроводорослей в качестве катализаторов. Клетки водорослей содержат относительно большие концентрации пероксидазы, эффективно обмениваются водой с внешней средой и участвуют в образовании внутриклеточной Н2О2 под действием солнечного излучения. Вследствие этих особенностей водоросли являются активными участниками процессов самоочищения от загрязняющих 242
веществ, обладающих субстратными свойствами в отношении перокси-дазного окисления.
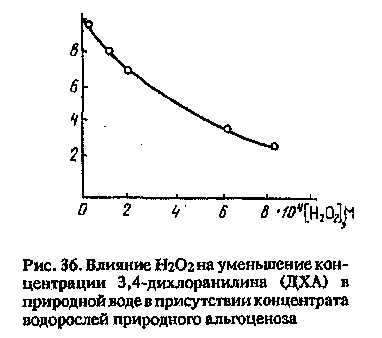
Если взять загрязняющее вещество — донор Н (например, 3,4-ди-хлоранилин — продукт гидролиза многих фениламидных гербицидов, широко используемых при выращивании риса) — и поместить его в природную воду, содержащую водоросли, то в отсутствие солнечного излучения или добавок Н2О2 это вещество практически не fOslJjXA],M окисляется. Стоит же добавить в воду Н2О2 или экспонировать воду на солнце, 3,4-дихлоранилин (и любой другой амин или фенол) эффективно окисляется (рис. 36). Трансформация ЗВ происходит в результате окислительных процессов с участием пероксида водорода, образующегося под действием солнечного света или добавляемого в раствор.
Оказывается, трансформации подвержены не только субстраты пероксидазной реакции, но и трудноокисляемые соединения. Так, краситель пйфя-нитрозодиметиланилин (ПНДМА), добавляемый в воду, содержащую микроводоросли, обесцвечивается. Этот краситель используется в радиационной химии как специфический акцептор ОII-радикала. Можно было бы предположить, что и в природной воде он обесцвечивается за счет взаимодействия с ОН.

Краситель ПНДМА оказался удобным тестом на реакции, протекающие в природных водах с участием ОН. По скорости его обесцвечивания в условиях принудительного инициирования ОН-радикалов можно оценить эффективное содержание в водной среде "ловушек" ОН:
Wi —► ОН
к-
ОН -f E Sf —*-► гибель радикалов на "ловушках" (1)
к ОН •+■ ПНДМА ► обесцвечивание красителя (2)
В качестве источника радикалов ОН можно использовать фотолиз Н202:
243
![]()
(3)
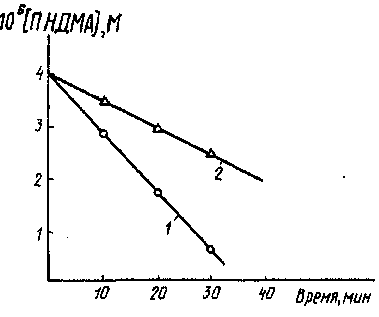
Измеряя скорость обесцвечивания ПНДМА при фотолизе Н202 в дистиллированной воде и при разных добавках природной воды (рис. 37), можно определить ингибиторную способность водной среды в отношении радикальных процессов самоочищения с участием ОН:
![]()
где У0бщ — общий объем смеси; Vn.B — объем природной воды в анализируемой пробе; к = l^'lO^M^c"1 — константа скорости взаимодействия ОН с ПНДМА; мд.в (мп.в) — начальная скорость обесцвечивания ПНДМА при фотолитическом разложении Н2О2 в дистиллированной (природной) воде.
Поскольку для большинства органических и многих неорганических соединений константы скорости взаимодействия с ОН лежат в диапазоне 108 - Ю^М^с"1, полагая к{ » 109М"1с'1, по значению параметра £fy[S(| можно оценить эффективное содержание в воде "ловушек" ОН:
![]()
Рис. 37. Влияние
добавок природной воды на
кинетику
обесцвечивания паранитро-
зодиметиланилина
(ПНДМА) при фотолизе
H2O2(tH2O2]o-10-3M):
1 ■— дистиллированная
вода; 2 —в присутствии добавок
природной воды
Размерность и физический смысл параметра ингйбиторной способ-244
ности позволяют трактовать его как эффективную константу скорости гибели ОН в природной водной среде. Зная скорость инициирования щ и параметр Е ^[Sj], можно оценить стационарную концентрацию ОН в водной среде:,
![]()
Зная же константу скорости взаимодействия ОН' с загрязняющим веществом Р (Ж0,р)> можно оценить эффективную константу скорости
радикального канала трансформации этого вещества:
![]()
Чем ниже Е fy[S{], тем при прочих равных параметрах больше вклад радикального канала в самоочищение среды.
При наличии в природной воде ЩОг и микроводорослей параметр Е ki[Sj\, как правило, невелик. Более того, разложение вводимого в воду (в замкнутый объем) Н2О2 сопровождается уменьшением величины Е ki[Si\ — снижением содержания "ловушек" радикалов в среде. Это означает, что в природной воде пероксид водорода распадается на свободные радикалы, выедающие часть "ловушек". Измерения показывают, что до половины всего вносимого в природную воду пе-роксида водорода распадается через промежуточное образование радикалов ~ 10—50%.
Коль скоро абиотические процессы каталитического разложения Н2О2 с образованием свободных радикалов в природных водах протекают крайне медленно, спрашивается: в чем же заключается роль водорослей; каким образок водоросли стимулируют радикальные процессы в природной водно*
среде!
Оказывается, водоросли в процессе своей жизнедеятельности образуют вещества восстановительной природы не только те, которые участвуют во внутриклеточных окислительно-восстановительных про-
245
цеесах, но и такие, которые выделяются во внешнюю среду, инициируя внеклеточные процессы радикального окисления растворенных в воде веществ.
Этот процесс косвенного биогенного инициирования свободных радикалов можно смоделировать в искусственной редокс-каталитиче-ской системе.
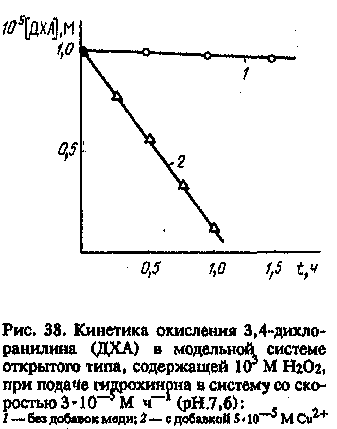
Возьмем раствор, содержащий ионы меди, Н2О2 и какое-либо загрязняющее вещество, которое может быть окислено ОН-радикалами (например, 3,4-дихлоранилин). В отсутствие других добавок процесс будет развиваться крайне медленно — только за счет каталитического разложения Н2О2. Однако если в воду добавлять с малой скоростью гидрохинон — экзометаболит многих видов водорослей, то загрязняющее вещество начнет эффективно окисляться (рис. 38).
В стационарном режиме скорость инициирования свободных радикалов в системе примерно совпадает со скоростью поступления в раствор гидрохинона. Так же, по-видимому, происходит инициирование радикалов и в природных водах: водоросли продуцируют во внешнюю среду вещества — восстановители, которые в присутствии Н2О2 способствуют образованию свободных ОН-радикалов, взаимодействуя с ионами меди (как основными претендентами на роль природных катализаторов редокс-процессов).
Общая схема биогенного инициирования радикальных процессов самоочищения может быть представлена в виде:
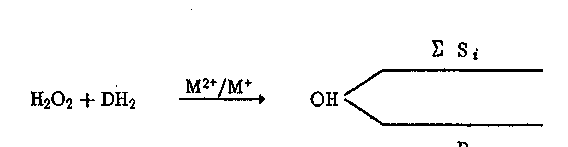
биота
/\
V
Абиотические источники
В этой схеме не учитывается, что продуцируемый биотой восстановитель DH2 может участвовать в других процессах окисления, в частности окисляться кислородом. Не учитывается также, что пероксид водорода может взаимодействовать с другими компонентами среды, а также разрушаться по каталазному механизму.
В качестве катализаторов могут участвовать ионы металлов переменной валентности. Если в воде постоянно присутствует Н2О2, то скорость инициирования радикалов будет определяться скоростью выделения DH2 во внешнюю среду. Восстановители могут образовы-246
ваться и в качестве промежуточных продуктов трансформации веществ, которые сами восстановительными свойствами не обладают. Например, трансформация винной кислоты сопровождается образованием дигидроксифумаровой кислоты, которая обладает ярко выраженными восстановительными свойствами.
