
- •Введение в экологическую химию
- •Глава 1
- •§ 1.1. Биосфера и происхождение жизни на земле
- •§ 1.2. Энергетический и материальный баланс биосферы
- •§ 1.3. Антропогенное воздействие на окружающую среду
- •§ 1.4. Ограниченность природных ресурсов
- •§ 1.5. Энергетика и экология
- •1.5.1. Тепловые электростанции
- •1.5.2. Гидроэлектростажцжи
- •1.5.3. Атомные эяею1росташщи
- •1.5.4.1. Утилизация солнечной энергии
- •1.5.4.2. Термоядерная энергетика
- •1.5A3. Энергия ветра
- •1.5.4.4. Энергия прилива
- •1.5.4.5. Геотермальная энергия
- •1.5.4.6. Другие нетрадиционные источники
- •§ 1.6. Экономические и социальные проблемы охраны окружающей среды
- •Глава 2
- •§ 2.1. Мониторинг как система наблюдения и контроля за состоянием окружающей среды
- •§ 2.2. Процессы массопереноса загрязняющих веществ
- •§ 2.3. Методы контроля загрязняющих веществ в объектах окружающей среды
- •2.3.1. Спектральные методы анализа
- •Глава 3 круговорот веществ в биосфере
- •§ 3.1. Круговорот кислорода, фотосинтез
- •§ 3.2. Круговорот азота
- •§ 3.3. Круговорот фосфора и серы
- •Глава 4 экохимические процессы в атмосфере
- •§ 4.1. Физико-химические свойства атмосферы
- •§ 4.2. Химические процессы в верхних слоях атмосферы
- •§ 4.3. Химические процессы в тропосфере с участием свободных радикалов
- •§ 44. Вода в атмосфере
- •§ 4.5. Проблемы локального и глобального загрязнений воздушной среды
- •4.5.4.1. Монооксид углерода
- •4.5.5. Тяжелые металлы
- •§ 4.6. Способы очистки газовых выбросов
- •4.6.1. Очистка газов от твердых частиц
- •4.6.2. Очистка от газовых примесей
- •Глава 5
- •§ 5.1. Почвенные ресурсы
- •§ 5.3. Почва и вода, эрозия почв
- •§ 5.5. Загрязнение почв пестицидами
- •§ 5.6. Утилизация и переработка твердых отходов
- •Глава 6
- •§ 6.1. Краткие сведения о гидрохимии и гидробиологии
- •§ 6.2. Ашропошнное эвтрофиговжниё водоемов
- •§ 6.3. Лигандный состав и формы существования
- •§ 6.4. Внутриводоемный круговорот пероксида
- •§ 6.5. Роль донных отложений в формировании качества водной среды
- •Глава 7
- •§ 7.1. Виды загрязнений и каналы самоочищения водной среды
- •§ 7.2. Физико-химические процессы на границе раздела фаз
- •§ 7.3. Микробиологическое самоочищение
- •§ 7.4. Химическое самоочищение
- •7.4.1. Гидролиз
- •7.4.2. Фотолиз
- •7.4.3. Окисление
- •§ 7.6. Свободные радикалы в природных водах
- •7.6.2. Свойства радикалов Oj, он
- •§ 7.7. Моделирование поведения загрязняющих веществ в природных водах
- •Глава 8
- •§ 8.1. Молекулярный кислород как окислитель. Образование и свойства металл-кислородных комплексов
- •§ 8.2. Механизмы активации пероксида водорода,
- •§ 8.3. Типовые механизмы каталитических процессов окисления с участием 02, н202
- •§ 8.4. Перспективы технологического использования 02 и н202 как экологически чистых окислителей
- •§ 8.5. Внутриклеточные окислительно-восстановительные процессы с участием 02 и н202
- •Глава 9
- •§ 9.1. Общие сведения о структуре и функции
- •§ 9.2. Виды токсического воздействия загрязняющих веществ
- •§ 9.3. Биотесгирование в оценке загрязнения водной среды
- •Глава 10
- •§ 10.1. Характеристики сточных вод и виды их загрязнений
- •§ 10.3. Особенности биохимической очистки сточных вод
- •10.3.1. Аэробные методы очистки
- •10.3.1.1. Биологические пруды
- •10.3.1.3. Биофильтры
- •10.3.3. Биохимические процессы с участием минеральных форм азота
- •Глава 11
- •§ 11.1. Подготовка питьевой воды
- •§ 11.2. Применение хлора, озона и пероксида водорода в обработке воды и очистке сточных вод
- •1L2.2. Озонирование воды
- •§ 11.3. Методы локальной очистки сточных вод
- •11.3.3. Деструктивные методы очистки
§ 8.5. Внутриклеточные окислительно-восстановительные процессы с участием 02 и н202
Реакции с участием Ог и Н2О2 играют в живом организме исключительно важную роль. Не вдаваясь во все многообразие внутриклеточных редокс-процессов1, рассмотрим действие металлоферментов, катализирующих реакции с участием О2, H2O2. Реакции с участием 02 катализируются оксидазами и оксигеназами.
Окшдазы катализируют редокс-процессы, в которых кислород выступает как электронный акцептор. Наиболее детально изучены ферменты, катализирующие 4-электронный перенос: лакказы, аскорба-токсидаза, цитохром с-оксидаза. Общее свойство этих ферментов — наличие пространственно разделенных центров окисления субстрата и восстановления кислорода.
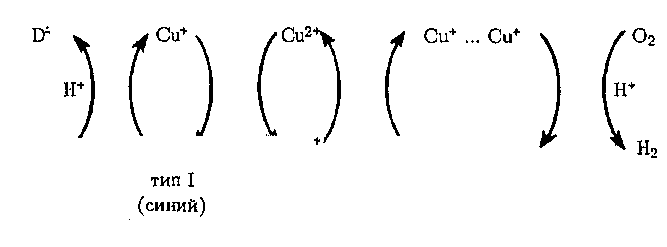
Лакказа и аскорбатоксидаза — сходные ферменты, содержат в активных центрах ионы меди, которые в зависимости от ядерности и спектральных характеристик могут быть трех типов.
Механизм ферментативной реакции окисления субстрата — восстановление 02 до воды при участии этих ферментов может быть представлен схемой
1 Подробнее см.: Метелица Д.И. Моделирование окислительно-восстановительных ферментов; Лукьянова Л.Д., Балмуханов B.C., Уголев А.Т. Кислород-зависимые процессы в клетке и ее функциональное состояние. 284
тип II тип HI
(бесцветный) (не детектируемый методом ЭПР)
из которой видно, что в центре связывания субстрата происходит окисление его ионами меди типа I. Затем через посредничество ионов меди типа Ц электроны поочередно передаются на биядерный центр типа III связывания Ог, восстанавливая кислород до воды.
Цитохром с-оксидаза локализована в митохондриях и играет ключевую роль в процессах клеточного дыхания, катализируя реакцию окисления цитохрома с:
4Н+ 4 Цитохром с (2+) + Ог ——> 4 Цитохром с (3+) + НгО (1)
Механизм этой реакции качественно аналогичен приведенному выше для случая лакказы и аскорбатоксидазы. Отличие заключается в том, что имеется два независимых центра акцептирования электрона
от субстрата — гемовый (гем а) и медный (Си ), а биядерный центр
1
восстановления Ог формируется не из двух ионов меди, а из тема а3 и
иона меди Си. . °з
Другая распространенная группа оксидаз катализирует восстановление Ог до НгОг. Как правило, эти оксидазы содержат в активном центре один бесцветный ион меди (тип И). Представителями этой группы ферментов являются: уриказа, катализирующая окисление мочевой кислоты; полифенолоксидаза, катализирующая окисление катехина в соответствующий о-хинон; оксидазы аминокислот, окисляющие аминокислоты в кето- или альдеги доки слоты с одновременным деаминированием (образование NHg); аминооксидазы, катализирующие окисление сложных аминов до соответствующего кетона или альдегида и NH3; гликольоксидаза, окисляющая гликолевую кислоту в глиокса-левую; ксантиноксидаза, катализирующая окисление ксантина в мочевую кислоту, и некоторые другие. Механизмы встречаются разные — циклические и активационные. Например, в случае галактозооксидазы реализуется циклический механизм двухэлектронного окисдения субстрата и Си+:
285
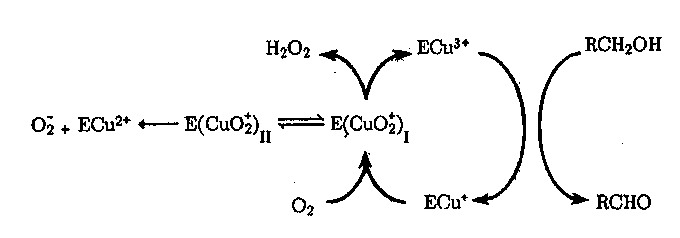
Окислительное действие уриказы и ряда других оксидаз связано с активацией непосредственно кислорода. Механизм процесса можно представить в виде
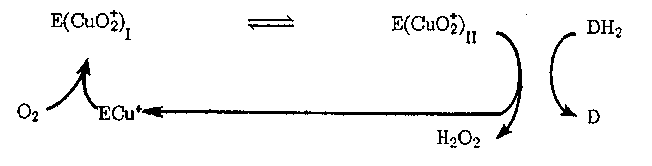
В механизме действия ксантиноксидазы эффективно реализуется одноэлектронное восстановление Ог (наряду с двухэлектронным). В этом ферменте субстрат окисляется под действием входящего в активный центр Мо5+. Электрон затем через посредство кластеров Fe2S2 по электронно-транспортной цепи передается флавину (ФАД), участвующему в восстановлении Ог до О::
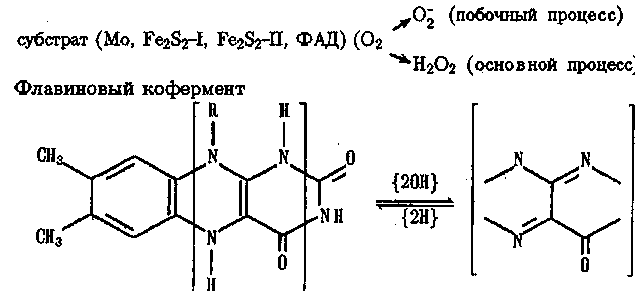
участвует и в механизме действия некоторых других оксидаз. 286
Оксигеназы катализируют включение одного или двух атомов кислорода в молекулу субстрата. В активном центре оксигеназ содержатся ионы меди и железа.
Монооксигеназы (гидроксилазы) включают в субстрат один атом О, а второй высвобождается в виде Н20. Как правило, гидроксилазы содержат в качестве кофактора ФАД. Наиболее распространены они у бактерий, например лактатмонооксигеназа катализирует реакцию
Ir-лактат + Ог ► ацетат + СОг + НгО
Этот фермент не требует наличия "внешнего" донора, донором служит сам субстрат.
Для многих других оксигеназ требуется внешний донор, в качестве которого обычно выступает НАДН или НАДФН. Например, салици-лат-1-монооксигеназа катализирует процесс окисления салицилата по реакции
салицилат + НАДН + Ог ► пирокатехин + НАД + НгО + СОг
В подобных реакциях флавин играет роль переносчика двух электронов от НАДН к одноэлектронному акцептору. Аналогичную функцию в некоторых Ге2+'3+-содержащих оксигеназах, например в фенилала-нинмонооксигеназе, играют птеридины:
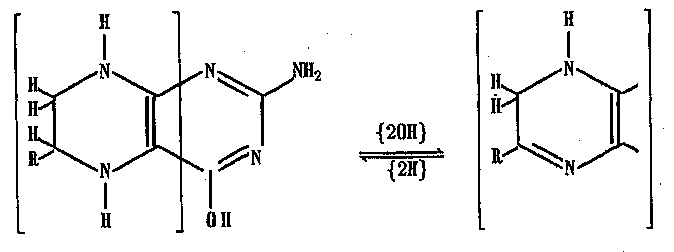
Наибольшее значение имеют гидроксилирующие ферменты микро-сомального окисления, содержащие цитохром Р-450 монооксигеназы. У человека и млекопитающих цитохром Р-450-содержащая оксигеназа печени является ферментной системой, которая обладает способностью окислять и таким образом переводить в водорастворимое состояние и удалять из организма десятки и сотни тысяч низкомолекулярных соединений, в отношении которых эта ферментная система выполняет функцию, аналогичную функции иммунной системы в отношении высокомолекулярных соединений.
Механизм действия цитохрома Р-450 связан с образованием кисло-
287
родного комплекса ЧПЗ с сильным переносом заряда, сорровождаю-щимся эффективным разрывом Q—О-связи:
![]()
Р — порфириновый лиганд активного центра фермента.
Распределение по предельным структурам в таком комплексе зависит от локальных свойств среды. В условиях клетки доля состояний
PFe3+0, РГе4+(У, по-видимому, значительна. Взаимодействие комплекса с субстратами как частицы PFe3tO будет сопровождаться внедрением атома О по связи С—Н. При взаимодействии комплекса РРеОг как
частицы РГе4+(У будет происходить окисление субстрата по радикальному механизму (подобно реакции с участием ОН-радикала).
В биологических системах элементарный акт переноса электрона в активном центре металлофермента зачастую сопряжен с системами переноса высвобождаемых окислительно-восстановительных эквивалентов на большие расстояния. Это осуществляется как через посредство Fe-, S-кластерных электронно-транспортных цепей, так и флавиновых и никотинамидных коферментов.
В системе гидроксилирования субстратов с помощью цитохрома Р-450 реализуется такая последовательность превращений:

Интересно отметить, что окисление многих субстратов в микросо-мальной гидроксилирующей системе происходит идентично при использовании вместо 02 гидропероксидов. Это указывает на однотипность промежуточных частиц, образующихся при взаимодействии Р-450 с 02 и ROOH.
Этот пример лишний раз показывает, что процессы активации Ог и Н2Ог тесно связаны друг с другом. 288
Природными катализаторами процессов с участием Н202 служат катал азы и пероксидазы, как правило, гемсодержащие ферменты. Каталаза приводит к разрушению избыточного пероксида водорода, содержащегося в клетке, до 02 и воды. Пероксидаза восстанавливает H202 до воды, используя высвобождающиеся окислительные эквиваленты для осуществления метаболических процессов и самоочищения внутренней среды клетки от вредных веществ с электронно-донорной функцией.
Каталаза — наиболее активна из всех ферментов. Кроме Н2О2 субстратами для нее (в качестве донора Н), хотя и в 10 000 раз менее активными, являются низшие алифатические спирты (метанол и этанол). Поэтому в организме помимо функции регулятора Н2С>2 каталаза участвует и в метаболизме этих спиртов, концентрация которых в крови может быть на много порядков больше, чем Н2О2. В обоих случаях (каталазы и пероксидазы) при взаимодействии Н202 с активным центром фермента образуется промежуточный комплекс (соединение I), который может быть отождествлен с частицей типа МО+:
![]() (2)
(2)
В случае каталазы окисляемым субстратом для этой частицы служит вторая молекула Н202:
![]() (3)
(3)
Суммарный каталитический процесс разложения Н2О2 при этом описывается реакцией
![]() (4)
(4)
В случае пероксидазы субстратами служат доноры электрона и водорода. Окисление наиболее низкомолекулярных доноров (например, формиата, формальдегида) осуществляется двухэлектронно. Большинство же более громоздких субстратов окисляется через последовательные одноэлектронные стадии с промежуточным образованием свободных радикалов субстрата и второго промежуточного комплекса (соединение Ц), реакционноспособного в отнощении DH2:
(5)
![]() (6)
(6)
Конечные продукты окисления DH2 образуются либо в результате рекомбинации радикалов, либо в результате их последующих превра щений с участием ионов металлов переменной валентности, молекуляр ного кислорода и H202. 10-235 289
Промежуточные комплексы, образующиеся при взаимодействии гемсодержащих ферментов с Н2О2 (соединения I, II), регистрируются спектрофотометрически, в том числе в живых клетках и в перфузиро-ванной (промываемой физиологическим раствором) печени. По стационарной концентрации соединения I удается оценить содержание внутриклеточного Н2Ог (в клетках млекопитающих оно порядка 10'7— 10'6 М). Очевидно, концентрация внутриклеточного Н202 зависит от вида клетки, содержания в ней клеточных ферментов и скорости метаболических процессов. Так, бактерии содержат много каталазы, растения — много пероксидазы, водоросли содержат и каталазу, и перокси-дазу. Много каталазы в крови, где она защищает эритроциты от окисления пероксидом водорода. С другой стороны, известны так называемые акаталаты — животные, в крови которых каталаза не обнаружена.
Ингибиторами каталазы и пероксидазы являются низкомолекулярные лиганды — комплексообразователи Fe3+: CN~, F", N3 и др.
Освобождение восстановительных эквивалентов из органических субстратов во внутриклеточных процессах происходит в результате деятельности дегидрогеназ — ферментов, переносящих восстановительные эквиваленты к НАД с образованием двухэлектронно-окисленного субстрата и НАДН. Многие дегидрогеназы содержат в качестве необходимого компонента ион Zn(II).
Редокс-состояние внутриклеточной среды определяется соотношением потоков окислительных эквивалентов в виде Н202 и восстановительных в виде НАДН и ФАДН. В нормальном состоянии клетки дегидрогеназные реакции, сопровождающиеся образованием восстановительных эквивалентов, сбалансированы с оксидазными реакциями, в которых образуется Н202. Регулирование внутрщклеточных потоков окислительных и восстановительных эквивалентов осуществляется с помощью глутатиона (GSH) и аскорбиновой кислоты (DH2):
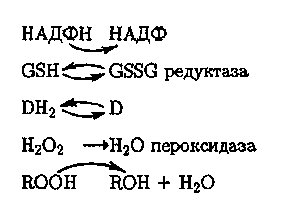
В некоторых клетках регуляция редокс-состояния осуществляется и без участия аскорбиновой кислоты (например, в клетках сине-зеленых водорослей). 290
Очевидно, при интенсивном водообмене с внешней средой возможно влияние редокс-состояния среды на внутриклеточное соотношение окислительно-восстановительных эквивалентов, выражаемое отношением НАД(Ф)/НАД(Ф) или АТФ/АДФ. Разбалансировка внутриклеточных редокс-процессов может приводить и к разбалансировке других функциональных систем клетки (см. § 9.1).
Большое значение для жизнедеятельности клетки имеет так называемое пероксидное окисление липидов. Под этим термином понимается окисление жирных кислот, входящих в состав мембран. Процесс пероксидного окисления липидов в норме регулируется ферментами, основным из которых является глутатион-пероксидаза. Физиологическая значимость пероксидного окисления липидов связана с тем, что пероксиды липидов могут выступать в качестве регуляторов проницаемости клеточных мембран и активности монооксигеназных реакций.
Активация пероксидного окисления липидов под влиянием внешних воздействий может привести к разрушению или структурному искажению мембран и прекращению деятельности полиферментных систем, связанных с транспортом электронов на большие расстояния. Пероксидному окислению липидов способствуют процессы, сопровождающиеся образованием внутриклеточных ОН-радикалов. Помимо радиационно-химических эффектов радикалы ОН могут образовываться и в результате каталитических окислительно-восстановительных процессов. В основном в клетке радикалы ОН образуются при катализе реакции 02 с Н202:
02 + Н202 ~♦ ОН + 02 + ОН" (7)
На интенсификации этой реакции основано действие многих сельскохозяйственных препаратов. Например, разобщители процесса фотосинтеза могут приводить к накоплению внутриклеточного пероксида
водорода и 02- При наличии в клетке соответствующих катализаторов происходит инициирование радикалов, сопровождающееся реализацией цепного вырожденного процесса окисления липидов и разрушением липидных мембран.
Среди ферментов, регулирующих внутриклеточное содержание 02, важное место занимает супероксиддисмутаза, катализирующая диспро-
порционирование 02. Обычно это Мп-, Cu-содержащие белки (БМ2+):

ЕМ2+ + 02 —> ЕМ++ 02 (8)
ЕМ+ + 02 -^—► ЕМ2++ Н202 (9)
291
Центральное место в "производстве" доноров Н в форме НАДН в клетке занимает цикл Кребса, осуществляющие заключительный этап окисления органических веществ до СОг и Н20 (см. § 9.1).
ЛИТЕРАТУРА
Арчаков А.И. Микросомальное окисление. — М.: Наука, 1975. — 326 с.
Лукьянов Л.Д., Балмуханова Б.С, Уголев А.Т. Кислородзависимые процессы в клетке и ее функциональное состояние. -~ М.: Наука, 1982. — 302 с.
Метелица ДЛЯ. Моделирование окислительно-восстановительных ферментов. — Минск: Наука и техника, 1984. — 293 с.
Методы и достижения бионеорганической химии/Под ред. К. Мак Олифф.
- М.: Мир, 1978. - 416 с.
Пикаев А.К., Кабакчи С.А. Реакционная способность первичных продуктов радиолиза воды. Справочник. — М.: Энергоиздат, 1982. — 2Q0 с.
Структура и связь. — М.: Мир, 1969. — 360 с.
Сычев А.Я. Окислительно-шсстановительный катализ комплексами металлов. — Кишинев: Штиинца, 1976. — 191 с.
Сычев AJL, Исак ВТ. Координационные соединения марганца в катализе.
— Кишинев: Штиинца, 1990. — 321 с.
Сычев АЛ., Исак В.Г. Гомогенный катализ соединениями железа. — Кишинев: Штиинца, 1988. — 216 с.
