
- •Введение в экологическую химию
- •Глава 1
- •§ 1.1. Биосфера и происхождение жизни на земле
- •§ 1.2. Энергетический и материальный баланс биосферы
- •§ 1.3. Антропогенное воздействие на окружающую среду
- •§ 1.4. Ограниченность природных ресурсов
- •§ 1.5. Энергетика и экология
- •1.5.1. Тепловые электростанции
- •1.5.2. Гидроэлектростажцжи
- •1.5.3. Атомные эяею1росташщи
- •1.5.4.1. Утилизация солнечной энергии
- •1.5.4.2. Термоядерная энергетика
- •1.5A3. Энергия ветра
- •1.5.4.4. Энергия прилива
- •1.5.4.5. Геотермальная энергия
- •1.5.4.6. Другие нетрадиционные источники
- •§ 1.6. Экономические и социальные проблемы охраны окружающей среды
- •Глава 2
- •§ 2.1. Мониторинг как система наблюдения и контроля за состоянием окружающей среды
- •§ 2.2. Процессы массопереноса загрязняющих веществ
- •§ 2.3. Методы контроля загрязняющих веществ в объектах окружающей среды
- •2.3.1. Спектральные методы анализа
- •Глава 3 круговорот веществ в биосфере
- •§ 3.1. Круговорот кислорода, фотосинтез
- •§ 3.2. Круговорот азота
- •§ 3.3. Круговорот фосфора и серы
- •Глава 4 экохимические процессы в атмосфере
- •§ 4.1. Физико-химические свойства атмосферы
- •§ 4.2. Химические процессы в верхних слоях атмосферы
- •§ 4.3. Химические процессы в тропосфере с участием свободных радикалов
- •§ 44. Вода в атмосфере
- •§ 4.5. Проблемы локального и глобального загрязнений воздушной среды
- •4.5.4.1. Монооксид углерода
- •4.5.5. Тяжелые металлы
- •§ 4.6. Способы очистки газовых выбросов
- •4.6.1. Очистка газов от твердых частиц
- •4.6.2. Очистка от газовых примесей
- •Глава 5
- •§ 5.1. Почвенные ресурсы
- •§ 5.3. Почва и вода, эрозия почв
- •§ 5.5. Загрязнение почв пестицидами
- •§ 5.6. Утилизация и переработка твердых отходов
- •Глава 6
- •§ 6.1. Краткие сведения о гидрохимии и гидробиологии
- •§ 6.2. Ашропошнное эвтрофиговжниё водоемов
- •§ 6.3. Лигандный состав и формы существования
- •§ 6.4. Внутриводоемный круговорот пероксида
- •§ 6.5. Роль донных отложений в формировании качества водной среды
- •Глава 7
- •§ 7.1. Виды загрязнений и каналы самоочищения водной среды
- •§ 7.2. Физико-химические процессы на границе раздела фаз
- •§ 7.3. Микробиологическое самоочищение
- •§ 7.4. Химическое самоочищение
- •7.4.1. Гидролиз
- •7.4.2. Фотолиз
- •7.4.3. Окисление
- •§ 7.6. Свободные радикалы в природных водах
- •7.6.2. Свойства радикалов Oj, он
- •§ 7.7. Моделирование поведения загрязняющих веществ в природных водах
- •Глава 8
- •§ 8.1. Молекулярный кислород как окислитель. Образование и свойства металл-кислородных комплексов
- •§ 8.2. Механизмы активации пероксида водорода,
- •§ 8.3. Типовые механизмы каталитических процессов окисления с участием 02, н202
- •§ 8.4. Перспективы технологического использования 02 и н202 как экологически чистых окислителей
- •§ 8.5. Внутриклеточные окислительно-восстановительные процессы с участием 02 и н202
- •Глава 9
- •§ 9.1. Общие сведения о структуре и функции
- •§ 9.2. Виды токсического воздействия загрязняющих веществ
- •§ 9.3. Биотесгирование в оценке загрязнения водной среды
- •Глава 10
- •§ 10.1. Характеристики сточных вод и виды их загрязнений
- •§ 10.3. Особенности биохимической очистки сточных вод
- •10.3.1. Аэробные методы очистки
- •10.3.1.1. Биологические пруды
- •10.3.1.3. Биофильтры
- •10.3.3. Биохимические процессы с участием минеральных форм азота
- •Глава 11
- •§ 11.1. Подготовка питьевой воды
- •§ 11.2. Применение хлора, озона и пероксида водорода в обработке воды и очистке сточных вод
- •1L2.2. Озонирование воды
- •§ 11.3. Методы локальной очистки сточных вод
- •11.3.3. Деструктивные методы очистки
4.6.2. Очистка от газовых примесей
При очистке выбросов от газовых примесей используют методы улавливания водорастворимых газов водными и водно-щелочными растворами, а также методы досжигания и каталитических превращений примесей. С применением каталитических методов осуществляют:
Окисление примесей до СОг и НгО (углеводородов, спиртов, других органических веществ).
Окисление примесей (хлорорганических веществ, SO2, оксидов азота) в ценные продукты с получением соответственно CI2, H2SO4, HN03.
Восстановление примесей в безвредные продукты (например, NO в N02).
Восстановление примесей в ценные продукты (например, SOg в S).
Разложение примесей до безвредных продуктов.
Немаловажное значение имеет очистка газовых выбросов от диоксида углерода — наиболее крупнотоннажного загрязнителя атмосферы. Ведется интенсивный поиск методов утилизации СОг (в помощь природному фотосинтезу) с целью получения продуктов его восстановления (низших углеводородов).
143
Синтез органических веществ из С02 и Н20 тесно связан с проблемой разложения воды на 02 и Н2. По оценкам специалистов, будущее за водородной энергетикой, поскольку водород может быть использован и как химический реагент-восстановитель и как топливо для двигателей внутреннего сгорания.
При наличии дешевого Н2 (например, при развитии солнечной энергетики) утилизация С02 открывает возможность каталитического синтеза в качестве вторичного сырья формальдегида или метанола:
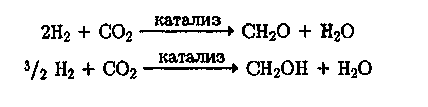
![]()
![]()
![]()
Метанол рассматривается как удобный источник энергии и химическое сырье, так как его легко хранить, транспортировать и использовать. В недалеком будущем водород как носитель энергии и метанол как вторичное сырье займут важное место и послужат синтетическими заменителями природного газа и нефти.
В настоящее время методы утилизации С02 еще не совершенны и малоэффективны для широкого применения их в химической технологии.
Гораздо лучше дела обстоят с очисткой газов от мопооксида углерода. Процесс очистки газовых выбросов с высоким содержанием СО основан на реакции водяного пара с СО в присутствии железа в качестве катализатора:
При низком содержании СО (< 2%) более эффективен каталитический процесс метанироваиия:
С применением медного катализатора СО в смеси с 02 может быть восстановлен до метанола:
Монооксид углерода может быть использован для синтеза многих алифатических углеводородов, спиртов и других кислородсодержащих соединений.
Зачастую при очистке газовых выбросов от СО стоит задача не 144
утилизации, а как можно более полного удаления СО из газовой сме си. iA Схема установки для дожигания СО представлена на рис. 14.
Газы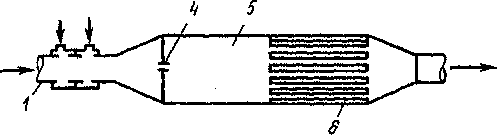 3
3
Рис 14. Схема установки для дожигания оксида углерода.
Г~ газоход; 2 - ввод природного газа;* - ввод воздуха; 4 - запальная св*»;5 -ра дожигания; 6—теплообменник-утилизатор теплоты
каме-
О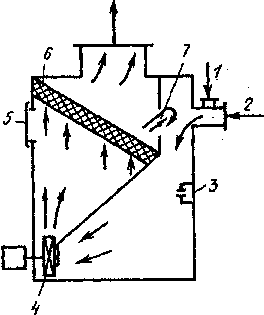 тработанные
газы, содержащие 9-16% СО, поступают в
установку по
газоходу L
С целью
повышения содержания горючих компонентов
к очищаемому газу через специальные
устройства В,
S
добавляются
природный газ и воздух. Газовая смесь
зажигается от горелки 4
и
сгорает в камере 5
при 900"
С. Горючие газы проходят через
теплообменник 6
и через
трубу выбрасываются в атмосферу.
тработанные
газы, содержащие 9-16% СО, поступают в
установку по
газоходу L
С целью
повышения содержания горючих компонентов
к очищаемому газу через специальные
устройства В,
S
добавляются
природный газ и воздух. Газовая смесь
зажигается от горелки 4
и
сгорает в камере 5
при 900"
С. Горючие газы проходят через
теплообменник 6
и через
трубу выбрасываются в атмосферу.
Каталитическое сжигание СО при атмосферном давлении может быть осу ществлено также на установке, схема которой приведена на рис. 15. Газы, содержащие СО, поступают в установку по трубе 2 за счет перепада давления, создаваемого вентилятором 4- К этим газам через патрубок 1 добавляется природный газ, количество которого зависит от требуемой температуры для рис. 15. Схема установки для ка- зависит ш xiwy п^пют газов талитического окисления СО в составе
поджига газовой смеси. Подогрев газов ^^^ ТШ)В.
ттписХОЛИТ ПРИ ПОМОЩИ ГОрвЛКИ J И 38 /_подача природного газа; 2-вход очищав. црши-лидюл. му* <-, „г* „*„„«* мого газа; J ~ горелка для подогрева при пуске;
СЧеТ ПОДСОса Через ЗаСЛОНКУ / часхи ^-.^пгпшятщЗ—люк для осмотра; б — кои-
горячих газов, прошедших через слой«с™*™**--»— катализатора 6. Подогретые до 340-35СГС газы проходят через вентилятор и под напором проталкиваются через контактный слой катализатора, окисляясь кислородом воздуха.
145
Для нейтрализации отработанных газов могут быть использованы катализаторы разных типов: одни предназначены для окислительного дожигания СО и углеводородов до С02 и воды; другие восстанавливают с помощью СО оксиды азота:
2NO + 2СО —» N2 + 2С02
Гетерогенное окисление СО и углеводородов кислородом осуществляется в адсорбционном слое на поверхности катализаторов (Pt, Pd, NiO, CuO, C03O4). Лимитирующей стадией при окислении СО служит активация адсорбированного кислорода. При адсорбции 02 на поверхности металлов и оксидов образуются различные формы поверхностно-связанного кислорода:
![]()
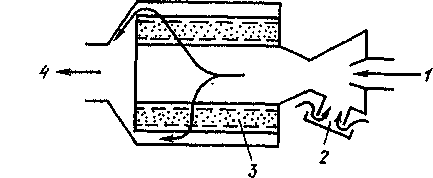
В настоящее время все автомобили, выпускае мые в США (около 10 млн.шт. в год), в обяза тельном порядке снаб жаются каталитически ми нейтрализаторами, устанавливаемыми в
выхлопную систему
Рис.
16. Нейтрализатор (каталитический
газоочиститель)
выхлопных газов:
1
—
вход газа из выхлопной трубы;2 — воздух;
3
—
катализатор; 4
—
очищенный
газ
Очистка газов от оксидов азота наиболее эффективно достигается с помощью активированного угля. Обезвреживаются оксиды азота и при 146
их каталитическом восстановлении до элементарного азота. Катализаторами служат сплавы из металлов платиновой группы (Pd, Ru, Pt, Rn и др.). В качестве восстановителей используют СНг, Щ, СО, NH3 и др. Некоторые производства содержат в воздушных выбросах до 4—10% диоксида серы, что вполне достаточно для получения серной кислоты. На заводах по производству серной кислоты каталитическое окисление S02 до SO3 при 450—600°С осуществляется не полностью и около 2% SO2 выбрасывается в атмосферу. Доочистку газовых выбросов от SO2 производят обычно путем поглощения диоксида серы щелочными растворами или твердыми щелочами с получением серной кислоты, серы или сульфата аммония. С этой целью обычно используют известь СаО или шламы оксидов кальция или магния:
СаО + S02 + V2 02 —♦ CaS04 MgO + S02 —► MgS03
Для поглощения SO2 часто используют раствор аммиака^ а также чистую воду с последующим окислением SO2 на активированном угле в качестве катализатора с образованием разбавленной (15%) серной кислоты.
Схема очистки газов от диоксида серы представлена на рис. 17. Очищенный горячий газ охлаждают до 100°С и насыщают водяным паром в скруббере Вентури 1. Здесь же происходит обеспыливание газа. Брызги орошающей жидкости задерживаются в циклоне 2, после чего газы проходят через увлажненный водой слой активированного угля 8. При этом диоксид серы адсорбируется, окисляется присутствующим в газе кислородом и превращается в серную кислоту, которая собирается в сборнике 4- Затем с помощью насоса 6 раствор кислоты подают на орошение горячих газов.
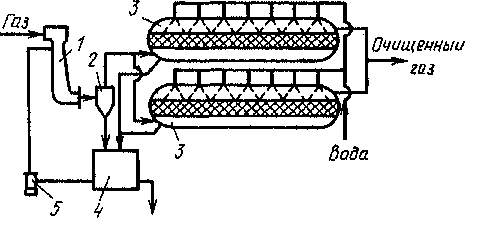
Кислота
Рис. 17. Схема очистки газов от диоксида серы:
I — скруббер Вентури; 2 — циклон; 3 — адсорберы с неподвижным слоем адсорбента; 4—сборник кислоты; 5 — циркуляционный насос
147
Для
поглощения SO2
и в качестве катализаторов используют
также плавленые
карбонаты щелочных металлов![]()
с последующим окислением сульфита:
![]()
Образующиеся сульфаты и сульфиты восстанавливаются углеродом при 800° С до сульфидов M2S, которые затем регенерируются с помощью СОг и водяного пара:
![]()
Образующийся сероводород окисляют затем до элементной серы (Кла-усс-процесс):
![]()
Этот процесс протекает в две стадии. Сначала H2S частично окисляется кислородом до SO2 (300—350°С), затем SO2 взаимодействует с H2S при наличии катализатора (220—250°С), которым служат оксид алюминия и бокситы. Значительное снижение выбросов SO2 в атмосферу достигнуто за счет разработки и внедрения способа получения серной кислоты методом каталитического жидкофазного окисления диоксида серы при повышенных температурах:
![]()
Степень улавливания S02 в этом процессе близка к 100%. Метод позволяет производить очистку как бедных газов тепловых станций и предприятий металлургии с содержанием 0,1—1% SO2, так и концентрированного (до 100%) диоксида серы.
Сероводород не только содержится в природном газе и нефти, но и образуется в процессе восстановления SO2 и при газификации угля. Очистка газов от H2S протекает проще и более полно, чем от БОг, и, как правило, достигается это каталитическим окислением H2S кислородом воздуха после абсорбции водными растворами Na2C03, K2CO3, NH3, Fe(OH)3 и др.:
![]()
Широкое распространение получил окислительно-восстановительный Стратфорд-процесс с использованием в качестве катализатора ванадата натрия и в качестве сокатализатора — дисульфоантрахинонов 148
(ДАХ). Реакция осуществляется при абсорбции H2S раствором карбоната натрия при рН 8,5—9,5:

Несмотря на сложные химические превращения, промышленный Стратфорд-процесс весьма прост. Концентрация H2S на выходе составляет около 1 млн."1 при концентрации на входе до 1%.

Широкое распространение получил также мышьяково-содовый способ очистки газов от сероводорода (рис. 18). Газ, содержащий сероводород, поступает в абсорбер 1, где орошается раствором тиоарсе-ната. Реакцияпротекает по уравнению
Насос 10 обеспечивает циркуляцию поглотительного раствора. Очищенный газ из абсорбера отводится в трубу.
Когда рН раствора снижается до 7,8, раствор нагревают в нагревателе 9 до 40—50° С. Горячий раствор поступает в регенератор 4i в который нагнетается воздух из компрессора 8. При этом процесс протекает по уравнению
149
![]()
Для удаления H2S используются также оксиды железа в виде водной суспензии.
На аналогичных реакциях основаны и процессы очистки газов от органических сульфидов и тиофена путем предварительного превращения их в Нг8 с помощью специальных катализаторов (хромата алюминия, кобальт-молибдена, оксидов цинка и др.).
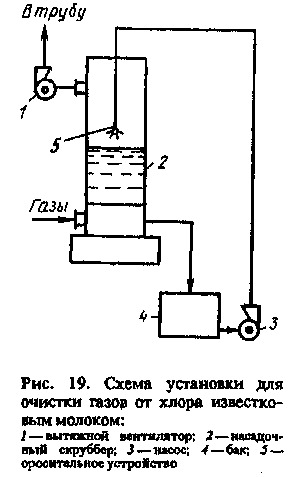
Для очистки газов от хлора чаще всего применяют щелочные растворы', например известковое молоко (рис. 19). Газы, загрязненные хлором, под действием вытяжного вентилятора 1 поступают в скруббер 2. Навстречу потоку газа сверху по насадке стекает известковое молоко. Хлор связывается известковым молоком за счет абсорбции и последующих химических превращений в растворе. Очищенные газы проходят через вентилятор и выбрасываются в атмосферу. Известковое молоко с исходной концентрацией 150 г/л подается из циркулярного бака 4 насосом 3 к оросительному устройству 5. При низкой температуре (20—30° С) протекает процесс
![]()
При этом в растворе накапливаются хлорид и гипохлорит кальция. При 80—90°С образуется хлорат кальция:
![]()
В настоящее время весьма остро стоит проблема утилизации хлорида водорода. На практике НС1 либо поглощают водой в скрубберах, либо утилизируют, каталитически превращая в С12: 150
![]()
![]() метана:
метана:
Однако промышленное производство хлорметанов по этому методу не реализовано, так как не найден достаточно эффективный катализатор процесса.
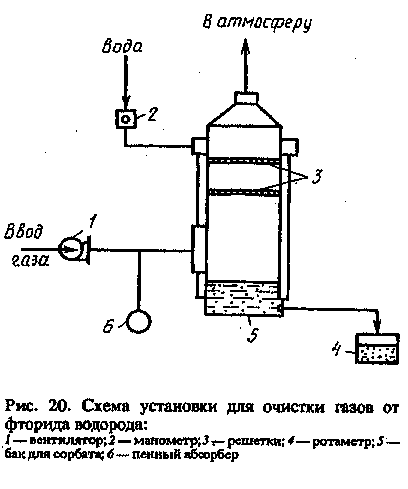
Вредное воздействие на окружающую среду оказывает фторид водорода, образующийся при производстве алюминия, суперфосфатных удобрений и при обжиге глины. Очистка газов от фтора основана на высокой растворимости F2 и HF в водных и щелочных растворах. Орошение проводят в полых и насадочных скрубберах, в пенных абсорберах и скрубберах с псевдоожижен-ной твердой насадкой. Схема промышленной установки для очистки вентиляционных газов в цехе по производству HF приведена на рис. 20. Очищаемые газы вентилятором 1 направляют
под решетку пенного абсорбера 6. Очищенные газы выводят в атмосферу.
Рассмотренные в данной главе вопросы влияния человеческой деятельности на химический состав и состояние атмосферы охватывают не все факторы отрицательного антропогенного воздействия на окружающую воздушную среду. В то же время со всей очевидностью ясно, что происходящие в атмосфере локальные и глобальные изменения чреваты не только ухудшением здоровья населения, но и представляют серьезнейшую опасность для биосферы в целом. В первую очередь это касается последствий изменения климата, неустойчивости
151
динамического состояния атмосферы, усиления дозы солнечного УФ-излучения, достигающего поверхности Землиг увеличения приземной концентрации озона, выпадения кислотных осадков, воздушного переноса огромного количества загрязняющих веществ от источников газовых выбросов на большие расстояния с последующим сухим и мокрым осаждением на поверхность растительности, почв, водоемов. Последний процесс служит одним из главных факторов ухудшения состояния почвенных и водных экосистем.
ЛИТЕРАТУРА
Абакумова Г.М., Евневич Т.В., Никольская Н.П. Влияние города на прозрачность атмосферы. — М.: Изд-во МГУ, 1983. -—94 с.
Берлянд М.Е. Прогноз и регулирование загрязнения атмосферы, — Л.: Гидрометеоиздат, 1985. — 272 с.
Власенко В.М. Каталитическая очистка газов. — Киев: Техника, 1973. — 199 с.
Гальперин В.М. Защита атмосферы от пьгаегазовых выбросов горно-химических предприятий. — М.: Недра, 1984. — 117 с.
Грушко А.М. Вредные органические соединения в промышленных выбросах в атмосферу: Справочник. — Л.: Химия, 1986. — 206 с.
Исидоров В.А. Органическая химия атмосферы. ~ Л.: Химия, 1985. — 264 с.
Пароль ИЛ., Розанов В.В., Тимофеев Ю.М. Газовые примеси в атмосфере: — Л.: Гидрометиздат, 1983. — 192 с.
Кондратьев К.Я. Окружающая среда и климат. — Л.: Об-во "Знание" РСФСР, 1985. - 32 с.
Кондратьев К.Я., Григорьев А.А., Покровский О.М. и др. Космическое дистанционное зондирование атмосферного аэрозоля. — Л.: Гидрометеоиздат,
1983. - 216 с.
Кузнецов И.Е., Троицкая Т.М. Защита воздушного бассейна от загрязнений вредными веществами химических предприятий. — М.: Химия, 1979. — 344 с.
Ровинский Ф.Я., Егоров В.И. Озон, окислы азота и серы в нижней атмосфере. — Л.: Гидрометеоиздат, 1986. — 182 с.
Спейшер В.А. Обезвреживание промышленных выбросов дожиганием. —-М.: Энергоатомиздат, 1986. — 167 с.
Шаприцкий В.Н. Защита атмосферы в металлургии. — М.: Металлургия,
1984. - 215 с.
Эльтерман В.М. Охрана воздушной среды на химических и нефтехимических предприятиях. — М.: Химия, 1985. — 160 с.
