
- •Введение в экологическую химию
- •Глава 1
- •§ 1.1. Биосфера и происхождение жизни на земле
- •§ 1.2. Энергетический и материальный баланс биосферы
- •§ 1.3. Антропогенное воздействие на окружающую среду
- •§ 1.4. Ограниченность природных ресурсов
- •§ 1.5. Энергетика и экология
- •1.5.1. Тепловые электростанции
- •1.5.2. Гидроэлектростажцжи
- •1.5.3. Атомные эяею1росташщи
- •1.5.4.1. Утилизация солнечной энергии
- •1.5.4.2. Термоядерная энергетика
- •1.5A3. Энергия ветра
- •1.5.4.4. Энергия прилива
- •1.5.4.5. Геотермальная энергия
- •1.5.4.6. Другие нетрадиционные источники
- •§ 1.6. Экономические и социальные проблемы охраны окружающей среды
- •Глава 2
- •§ 2.1. Мониторинг как система наблюдения и контроля за состоянием окружающей среды
- •§ 2.2. Процессы массопереноса загрязняющих веществ
- •§ 2.3. Методы контроля загрязняющих веществ в объектах окружающей среды
- •2.3.1. Спектральные методы анализа
- •Глава 3 круговорот веществ в биосфере
- •§ 3.1. Круговорот кислорода, фотосинтез
- •§ 3.2. Круговорот азота
- •§ 3.3. Круговорот фосфора и серы
- •Глава 4 экохимические процессы в атмосфере
- •§ 4.1. Физико-химические свойства атмосферы
- •§ 4.2. Химические процессы в верхних слоях атмосферы
- •§ 4.3. Химические процессы в тропосфере с участием свободных радикалов
- •§ 44. Вода в атмосфере
- •§ 4.5. Проблемы локального и глобального загрязнений воздушной среды
- •4.5.4.1. Монооксид углерода
- •4.5.5. Тяжелые металлы
- •§ 4.6. Способы очистки газовых выбросов
- •4.6.1. Очистка газов от твердых частиц
- •4.6.2. Очистка от газовых примесей
- •Глава 5
- •§ 5.1. Почвенные ресурсы
- •§ 5.3. Почва и вода, эрозия почв
- •§ 5.5. Загрязнение почв пестицидами
- •§ 5.6. Утилизация и переработка твердых отходов
- •Глава 6
- •§ 6.1. Краткие сведения о гидрохимии и гидробиологии
- •§ 6.2. Ашропошнное эвтрофиговжниё водоемов
- •§ 6.3. Лигандный состав и формы существования
- •§ 6.4. Внутриводоемный круговорот пероксида
- •§ 6.5. Роль донных отложений в формировании качества водной среды
- •Глава 7
- •§ 7.1. Виды загрязнений и каналы самоочищения водной среды
- •§ 7.2. Физико-химические процессы на границе раздела фаз
- •§ 7.3. Микробиологическое самоочищение
- •§ 7.4. Химическое самоочищение
- •7.4.1. Гидролиз
- •7.4.2. Фотолиз
- •7.4.3. Окисление
- •§ 7.6. Свободные радикалы в природных водах
- •7.6.2. Свойства радикалов Oj, он
- •§ 7.7. Моделирование поведения загрязняющих веществ в природных водах
- •Глава 8
- •§ 8.1. Молекулярный кислород как окислитель. Образование и свойства металл-кислородных комплексов
- •§ 8.2. Механизмы активации пероксида водорода,
- •§ 8.3. Типовые механизмы каталитических процессов окисления с участием 02, н202
- •§ 8.4. Перспективы технологического использования 02 и н202 как экологически чистых окислителей
- •§ 8.5. Внутриклеточные окислительно-восстановительные процессы с участием 02 и н202
- •Глава 9
- •§ 9.1. Общие сведения о структуре и функции
- •§ 9.2. Виды токсического воздействия загрязняющих веществ
- •§ 9.3. Биотесгирование в оценке загрязнения водной среды
- •Глава 10
- •§ 10.1. Характеристики сточных вод и виды их загрязнений
- •§ 10.3. Особенности биохимической очистки сточных вод
- •10.3.1. Аэробные методы очистки
- •10.3.1.1. Биологические пруды
- •10.3.1.3. Биофильтры
- •10.3.3. Биохимические процессы с участием минеральных форм азота
- •Глава 11
- •§ 11.1. Подготовка питьевой воды
- •§ 11.2. Применение хлора, озона и пероксида водорода в обработке воды и очистке сточных вод
- •1L2.2. Озонирование воды
- •§ 11.3. Методы локальной очистки сточных вод
- •11.3.3. Деструктивные методы очистки
§ 44. Вода в атмосфере
Помимо поддержания теплового баланса Земли вода играет исключительную роль в миграции и трансформации различных веществ в атмосфере. Циркуляция воды в природе осуществляется в так называемом глобальном цикле (рис. 7). 114
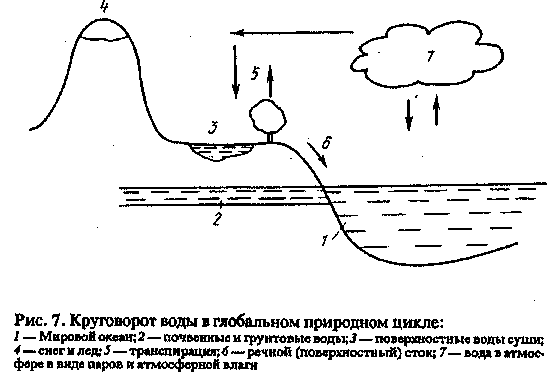
Вода испаряется в атмосферу с водных поверхностей, из почвы, путем транспирации (см. § 3.1). Поднимаясь в воздух, по мере охлаждения она конденсируется с образованием атмосферной влаги, переносится воздушными массами, выпадает в виде дождя или снега на поверхность суши, просачивается внутрь почвы с образованием грунтовых вод или стекает по поверхности, образуя поверхностный (речной) сток.
В среднем около 10% тропосферы Земли постоянно занято облаками, хотя доля; собственно жидкой воды в ней невелика — всего 10"7— 10-6.
Облачный слой постоянно покрывает более половины поверхности Земли и имеет толщину от нескольких сотен до тысяч метров. Эффективный объем облаков увеличивается за счет потока воздуха, проходящего через слой облаков со скоростью от 0,1 до 10 м/с.
Образование жидкой воды тесно связано с наличием в атмосфере аэрозолей — твердых или жидких частиц, обладающих малыми скоростями осаждения и находящихся во взвешенном состоянии. Жидкая вода присутствует в атмосфере во многих формах, главным образом в виде дымки, тумана, облаков и дождя.
Каждая капелька влаги в атмосфере, возникающая при конденсации водяных паров, — это своего рода микроводоем с определенным химическим составом. На границе раздела воздух — вода этого микроводоема интенсивно протекают процессы газожидкостйого обмена с окружающей воздушной средой.
115
Помимо растворенных атмосферных газов капли воды содержат также растворенные и твердые неорганические и органические загрязнители атмосферы. В результате капля атмосферной влаги представляет собой газожидкостиый микрореактор со сложным и изменчивым химическим составом. В этом реакторе под действием солнечного излучения и электрических зарядов могут происходить всевозможные химические превращения, главным образом окислительного характера с участием кислорода и продуктов его активации.
Время жизни капель невелико — от нескольких минут в случае больших дождевых капель до примерно часа в каплях облаков. Время жизни частиц "смога" размером меньше 1 мкм достигает недели. В табл. 12 приведены характерные размеры капель воды, содержание влаги на единицу объема воздуха, значения рН, ионной силы и содержание оксидов железа и марганца как потенциальных катализаторов окислительно-восстановительных превращений в атмосферной влаге. В частицах дымки вода присутствует в виде тонкой пленки жидкости на твердой поверхности, а в каплях дождя — в виде гомогенной жидкой фазы.

Чтобы конкурировать с газообразными процессами, химические реакции в атмосферных водных частицах должны быть весьма эффективными. Тем не менее многие процессы протекают именно в атмосферной влаге. Связано это с тем, что многие газовые компоненты обладают высокой растворимостью в воде.
Растворимость в воде тесно связана с коэффициентом Генри (табл. 13), устанавливающим пропорциональную связь между молярной долей вещества в жидкой и газовой фазах в условиях термодинамичес-, кого равновесия. 116

Как видно, многие газы растворяются в воде незначительно. В то же время вещества, участвующие в кислотно-основных или кето-еноль-ных превращениях, могут обладать повышенной растворимостью за счет образования в растворе других химических форм. Так, в случае SO2 растворимость будет повышаться вследствие взаимодействия SO2 с водой с последующей диссоциацией сернистой кислоты:
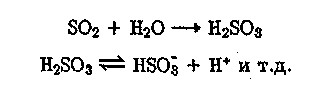
Аналогично, повышенная растворимость NO2 связана с протеканием следующих реакций:
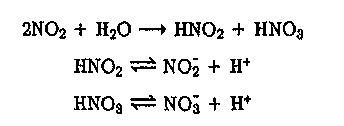
а повышенная растворимость формальдегида —- с реакцией
![]()
Вещества, для которых эффективный коэффициент Генри превышает 4-Ю4 моль/(л«атм), будут находиться в атмосфере преимущественно в растворенной форме.
Следовательно, из табл. 13 с учетом комментария к ней можно выделить наиболее растворимые загрязняющие вещества, которые будут окисляться в жидкой фазе (SO2, СИ20, NH3). Вопрос о количественном вкладе жидкофазных процессов окисления по сравнению с
117
газообразными не решен, поскольку не известны коэффициенты аккомодации (захвата) радикалов каплями. Так или иначе, но с осадками на сушу и в океан возвращаются сера и азот в форме H2SO4, HNO3, (NH4)2S04, NH4NO3.
В химии облаков и капель дождя играют роль присутствующие в газовой фазе окислители Оз, Н2О2 и образующиеся в результате фотохимических процессов свободные радикалы ОН, НОг, а также их органические аналоги — RO2, ROOH и др.
В силу большого коэффициента Генри у Н2О2 атмосферная влага содержит значительные концентрации пероксида водорода (см. § 6.4). 1?ак, в дожде содержание Н202 в среднем около 10"5 моль/л, в грозовом дожде концентрация Н2Ог может достичь 10"4 моль/л, в снеге содержание Н2О2 несколько меньше — 10"5 моль/л.
Поскольку пероксид водорода является сильным окислителем, в присутствии ионов железа и марганца он может участвовать в жидко-фазном окислении SO2:
Fe Mn S02
+ Н202
'
> H2SO4
Эта реакция служит основной причиной образования "кислых" дождей (см. § 4.5).
Пероксокислоты и органические пероксиды обладают высокой растворимостью и в водной фазе могут играть роль окислителей типа Н202. Содержание органических окислителей в облаках и дождевой воде достигает 4«Ю-5 моль/л, что сравнимо с содержанием в дождевой воде Н2О2. Как правило, в зимнее время содержание окислителей в атмосферной влаге гораздо ниже, чем летом. Органические окислители и Н2О2 ответственны за появление в атмосферной влаге и в дождевой воде органических кислот.
В случае радикалов Н02 (0<j) наблюдается сильная зависимость их содержания в атмосферной влаге от размеров капель: максимальная концентрация наблюдается в каплях размером * 1 мкм. Это свидетельствует о поступлении гидропероксидных радикалов из газовой фазы в жидкую при относительном движении воздуха и капель облаков.
Содержание ОН в каплях зависит от высоты над уровнем моря, что отражает тот факт, что за образование ОН ответственны фотохимические процессы с участием УФ-света.
Одним из источников ОН в каплях облаков служит реакция гидро-пероксидного радикала с растворенным в водной фазе озоном:
Н02 + 03—>НОз + 02 ■' НОз—•►ОН+.Ог ' 118
Эта реакция приводит к разрушению 03 в тропосфере (при наличии облаков). В то же время в отсутствие облаков в сочетании с NOx радикал НОг приводит к образованию Оз (см. § 4.3).
