
- •Введение в экологическую химию
- •Глава 1
- •§ 1.1. Биосфера и происхождение жизни на земле
- •§ 1.2. Энергетический и материальный баланс биосферы
- •§ 1.3. Антропогенное воздействие на окружающую среду
- •§ 1.4. Ограниченность природных ресурсов
- •§ 1.5. Энергетика и экология
- •1.5.1. Тепловые электростанции
- •1.5.2. Гидроэлектростажцжи
- •1.5.3. Атомные эяею1росташщи
- •1.5.4.1. Утилизация солнечной энергии
- •1.5.4.2. Термоядерная энергетика
- •1.5A3. Энергия ветра
- •1.5.4.4. Энергия прилива
- •1.5.4.5. Геотермальная энергия
- •1.5.4.6. Другие нетрадиционные источники
- •§ 1.6. Экономические и социальные проблемы охраны окружающей среды
- •Глава 2
- •§ 2.1. Мониторинг как система наблюдения и контроля за состоянием окружающей среды
- •§ 2.2. Процессы массопереноса загрязняющих веществ
- •§ 2.3. Методы контроля загрязняющих веществ в объектах окружающей среды
- •2.3.1. Спектральные методы анализа
- •Глава 3 круговорот веществ в биосфере
- •§ 3.1. Круговорот кислорода, фотосинтез
- •§ 3.2. Круговорот азота
- •§ 3.3. Круговорот фосфора и серы
- •Глава 4 экохимические процессы в атмосфере
- •§ 4.1. Физико-химические свойства атмосферы
- •§ 4.2. Химические процессы в верхних слоях атмосферы
- •§ 4.3. Химические процессы в тропосфере с участием свободных радикалов
- •§ 44. Вода в атмосфере
- •§ 4.5. Проблемы локального и глобального загрязнений воздушной среды
- •4.5.4.1. Монооксид углерода
- •4.5.5. Тяжелые металлы
- •§ 4.6. Способы очистки газовых выбросов
- •4.6.1. Очистка газов от твердых частиц
- •4.6.2. Очистка от газовых примесей
- •Глава 5
- •§ 5.1. Почвенные ресурсы
- •§ 5.3. Почва и вода, эрозия почв
- •§ 5.5. Загрязнение почв пестицидами
- •§ 5.6. Утилизация и переработка твердых отходов
- •Глава 6
- •§ 6.1. Краткие сведения о гидрохимии и гидробиологии
- •§ 6.2. Ашропошнное эвтрофиговжниё водоемов
- •§ 6.3. Лигандный состав и формы существования
- •§ 6.4. Внутриводоемный круговорот пероксида
- •§ 6.5. Роль донных отложений в формировании качества водной среды
- •Глава 7
- •§ 7.1. Виды загрязнений и каналы самоочищения водной среды
- •§ 7.2. Физико-химические процессы на границе раздела фаз
- •§ 7.3. Микробиологическое самоочищение
- •§ 7.4. Химическое самоочищение
- •7.4.1. Гидролиз
- •7.4.2. Фотолиз
- •7.4.3. Окисление
- •§ 7.6. Свободные радикалы в природных водах
- •7.6.2. Свойства радикалов Oj, он
- •§ 7.7. Моделирование поведения загрязняющих веществ в природных водах
- •Глава 8
- •§ 8.1. Молекулярный кислород как окислитель. Образование и свойства металл-кислородных комплексов
- •§ 8.2. Механизмы активации пероксида водорода,
- •§ 8.3. Типовые механизмы каталитических процессов окисления с участием 02, н202
- •§ 8.4. Перспективы технологического использования 02 и н202 как экологически чистых окислителей
- •§ 8.5. Внутриклеточные окислительно-восстановительные процессы с участием 02 и н202
- •Глава 9
- •§ 9.1. Общие сведения о структуре и функции
- •§ 9.2. Виды токсического воздействия загрязняющих веществ
- •§ 9.3. Биотесгирование в оценке загрязнения водной среды
- •Глава 10
- •§ 10.1. Характеристики сточных вод и виды их загрязнений
- •§ 10.3. Особенности биохимической очистки сточных вод
- •10.3.1. Аэробные методы очистки
- •10.3.1.1. Биологические пруды
- •10.3.1.3. Биофильтры
- •10.3.3. Биохимические процессы с участием минеральных форм азота
- •Глава 11
- •§ 11.1. Подготовка питьевой воды
- •§ 11.2. Применение хлора, озона и пероксида водорода в обработке воды и очистке сточных вод
- •1L2.2. Озонирование воды
- •§ 11.3. Методы локальной очистки сточных вод
- •11.3.3. Деструктивные методы очистки
§ 8.2. Механизмы активации пероксида водорода,
ОБРАЗОВАНИЕ И СВОЙСТВА СВЕРХОКИСЛЕННЫХ
ИОНОВ МЕТАЛЛОВ
Процесс активации 02 тесно связан с каталитической активацией пероксида водорода. В отличие от 02 молекула Н202 имеет вакантную лишь а *~разрыхляющую орбиталь, способную принять один или два
273
электрона, В то же время, обладая донорными свойствами, пероксид водорода может взаимодействовать с металлами и как восстановитель.
С ионами металлов в восстановленной форме реакция Н202 иожет осуществляться как внешнесферно, так и с вхождением молекулы пероксида водорода во внутреннюю координационную сферу по механизму обычного лигандного замещения.
При внутрисферном взаимодействии Н202 с ионами М+, имеющими потенциальновакантные места в координационной сфере, как и вч случае 02, возможны два типа координации молекулы пероксида водорода: монодентатный при наличии всего одного вакантного места и бидентатный при наличии двух таких мест. В обоих случаях в зависимости от редокс-характеристик металла возможно осуществление как одно-, так и двухэлектронного переноса. При внутрисферном двух-электронном переносе образуется промежуточный комплекс, в котором проявляются свойства сверхокисленного состояния иона металла либо атомарного кислорода:
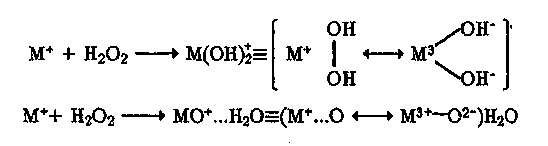
Термодинамические критерии образования пероксидных частиц типа М(ОН)2, МО+ определяются равенствами (а и 0,5)

В кислой среде частицы МО+, М(ОН)2 взаимодействуют с Н+ с образованием других реакционноспособных частиц: комплекса МОН2+=(М2+...ОН «—► М3+ОН") и иона металла в сверхокисленном состоянии М3+.
В нейтральной среде частицы МО+, М(ОН)2 гидролизуются (вследствие частичного нахождения этих частиц в состоянии М3+) с образованием гидроксопроизводных, причем гидролиз этих частиц может сопровождаться окислением воды до ОН-радикала.
При внутрисферном одноэлектронном переносе заряда металл-пероксидный комплекс распадается с образованием ОН-радикала:
![]()
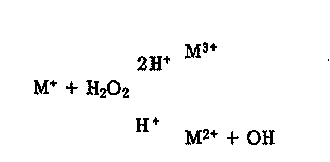
М(ОН)г, МОЙ2*, (МИ^Ог)* в протонной среде взаимодействие М* с Н2Ог сопровождается образованием в качестве продуктов либо М3+, либо ОН:
 (1)
(1)
Направление процесса определяется редокс-потенциалом пар М3+/М+, М2+/М+ в сопоставлении со значениями ^№02/2^0) = 1,77 эВ, ЫН2О2/ОН + Н20) = 0,71 эВ.
Таким образом, активация Н2О2 сопровождается образованием свободного либо комплексно связанного ОН-радикала или атомарного кислорода, либо иона металла в сверхокисленном состоянии. Реакци-онноспособные свойства производных М3+ представляют большой интерес как для понимания механизмов некоторых биологических процессов окисления, так и для применения в технологии.
Ионы
М3+
могут взаимодействовать с субстратами
как двухэлект-ронные
акцепторы, окисляя
спирты и насыщенные углеводороды:
окисляя
спирты и насыщенные углеводороды:
Частицы типа МО+ могут участвовать во внутрисферном двухэлект-ронном окислении донооов Н:
![]() (2)
а также в
реакциях гидроксилирования
(2)
а также в
реакциях гидроксилирования
![]() (3)
275
(3)
275
и эпоксидирования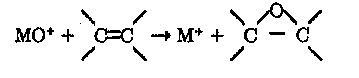
Как указывалось, в природных водах наиболее значимыми катализаторами процессов окисления с участием Н2О2 являются ионы и комплексы меди и железа. Несмотря на кажущуюся простоту реакций М+ с Н202, реальный механизм взаимодействия Си+ и Fe2+ с Н2О2 довольно сложен и включает несколько промежуточных стадий. Так, в случае меди он может быть представлен реакциями
i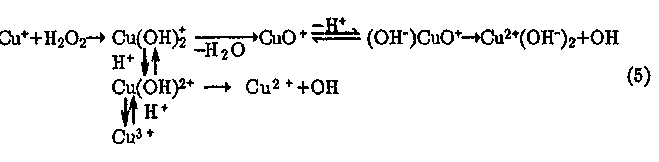
В случае ионов железа в зависимости от рН возможно образование как ОН-радикала, так и феррил-иона:

В реальных условиях каталитическая активация Ог и Н2О2 может осуществляться эффективно лишь в случае регенерации восстановленных форм металлов, т.е. при наличии в системе восстановительных эквивалентов.
