
- •Введение в экологическую химию
- •Глава 1
- •§ 1.1. Биосфера и происхождение жизни на земле
- •§ 1.2. Энергетический и материальный баланс биосферы
- •§ 1.3. Антропогенное воздействие на окружающую среду
- •§ 1.4. Ограниченность природных ресурсов
- •§ 1.5. Энергетика и экология
- •1.5.1. Тепловые электростанции
- •1.5.2. Гидроэлектростажцжи
- •1.5.3. Атомные эяею1росташщи
- •1.5.4.1. Утилизация солнечной энергии
- •1.5.4.2. Термоядерная энергетика
- •1.5A3. Энергия ветра
- •1.5.4.4. Энергия прилива
- •1.5.4.5. Геотермальная энергия
- •1.5.4.6. Другие нетрадиционные источники
- •§ 1.6. Экономические и социальные проблемы охраны окружающей среды
- •Глава 2
- •§ 2.1. Мониторинг как система наблюдения и контроля за состоянием окружающей среды
- •§ 2.2. Процессы массопереноса загрязняющих веществ
- •§ 2.3. Методы контроля загрязняющих веществ в объектах окружающей среды
- •2.3.1. Спектральные методы анализа
- •Глава 3 круговорот веществ в биосфере
- •§ 3.1. Круговорот кислорода, фотосинтез
- •§ 3.2. Круговорот азота
- •§ 3.3. Круговорот фосфора и серы
- •Глава 4 экохимические процессы в атмосфере
- •§ 4.1. Физико-химические свойства атмосферы
- •§ 4.2. Химические процессы в верхних слоях атмосферы
- •§ 4.3. Химические процессы в тропосфере с участием свободных радикалов
- •§ 44. Вода в атмосфере
- •§ 4.5. Проблемы локального и глобального загрязнений воздушной среды
- •4.5.4.1. Монооксид углерода
- •4.5.5. Тяжелые металлы
- •§ 4.6. Способы очистки газовых выбросов
- •4.6.1. Очистка газов от твердых частиц
- •4.6.2. Очистка от газовых примесей
- •Глава 5
- •§ 5.1. Почвенные ресурсы
- •§ 5.3. Почва и вода, эрозия почв
- •§ 5.5. Загрязнение почв пестицидами
- •§ 5.6. Утилизация и переработка твердых отходов
- •Глава 6
- •§ 6.1. Краткие сведения о гидрохимии и гидробиологии
- •§ 6.2. Ашропошнное эвтрофиговжниё водоемов
- •§ 6.3. Лигандный состав и формы существования
- •§ 6.4. Внутриводоемный круговорот пероксида
- •§ 6.5. Роль донных отложений в формировании качества водной среды
- •Глава 7
- •§ 7.1. Виды загрязнений и каналы самоочищения водной среды
- •§ 7.2. Физико-химические процессы на границе раздела фаз
- •§ 7.3. Микробиологическое самоочищение
- •§ 7.4. Химическое самоочищение
- •7.4.1. Гидролиз
- •7.4.2. Фотолиз
- •7.4.3. Окисление
- •§ 7.6. Свободные радикалы в природных водах
- •7.6.2. Свойства радикалов Oj, он
- •§ 7.7. Моделирование поведения загрязняющих веществ в природных водах
- •Глава 8
- •§ 8.1. Молекулярный кислород как окислитель. Образование и свойства металл-кислородных комплексов
- •§ 8.2. Механизмы активации пероксида водорода,
- •§ 8.3. Типовые механизмы каталитических процессов окисления с участием 02, н202
- •§ 8.4. Перспективы технологического использования 02 и н202 как экологически чистых окислителей
- •§ 8.5. Внутриклеточные окислительно-восстановительные процессы с участием 02 и н202
- •Глава 9
- •§ 9.1. Общие сведения о структуре и функции
- •§ 9.2. Виды токсического воздействия загрязняющих веществ
- •§ 9.3. Биотесгирование в оценке загрязнения водной среды
- •Глава 10
- •§ 10.1. Характеристики сточных вод и виды их загрязнений
- •§ 10.3. Особенности биохимической очистки сточных вод
- •10.3.1. Аэробные методы очистки
- •10.3.1.1. Биологические пруды
- •10.3.1.3. Биофильтры
- •10.3.3. Биохимические процессы с участием минеральных форм азота
- •Глава 11
- •§ 11.1. Подготовка питьевой воды
- •§ 11.2. Применение хлора, озона и пероксида водорода в обработке воды и очистке сточных вод
- •1L2.2. Озонирование воды
- •§ 11.3. Методы локальной очистки сточных вод
- •11.3.3. Деструктивные методы очистки
Глава 7
ПРОЦЕССЫ САМООЧИЩЕНИЯ ВОДНЫХ ЭКОСИСТЕМ
Под самоочищением водной среды понимают совокупность физических, биологических и химических внутриводоемных процессов, направленных на снижение содержания загрязняющих веществ (ЗВ) в воде до уровня, не представляющего угрозы для функционирования экосистемы.
§ 7.1. Виды загрязнений и каналы самоочищения водной среды
Вклад отдельных процессов в способность природной водной среды к самоочищению зависит от природы ЗВ. В соответствии с этим загрязняющие вещества условно можно разделить на три группы.
1. Так называемые консервативные вещества — неразлагающиеся или разлагающиеся в природной среде очень медленно. Это ионы металлов, минеральные соли, гидрофобные соединения тина хлорорга- нических пестицидов, нефтяные углеводороды. К этой группе ЗВ можно отнести и радионуклиды. Снижение концентраций консерватив ных веществ в водной среде происходит лишь за счет разбавления, физических процессов массопереиоса, физико-химических процессов комплексообразования, сорбции и биоиакошшшя. Самоочищение имеет кажущийся характер, поскольку происходит лишь перераспреде ление и рассеяние загрязняющего вещества в окружающей среде, загрязнение им сопредельных объектов.
2. Биогенные вещества, участвующие в биологическом круговороте, минеральные формы азота и фосфора, легкоусвояемые органические соединения. В этом случае самоочищение водной среды происходит преимущественно за счет биохимических процессов.
3. Водорастворимые вещества, но вовлекаемые в биологический круговорот, зачастую токсичные, промышленного и сельскохозяйствен ного происхождения. Самоочищение водной среды от этих веществ осуществляется в основном за счет их химической и микробиологиче ской трансформации.
226
В общем случае различные ЗВ участвуют в совокупности процессов массопереноса и трансформации.
Наиболее значимыми для самоочищения водной среды являются: а) физические процессы массопереноса: разбавление (перемешивание), вынос ЗВ в соседние водоемы (вниз по течению), испарение, сорбция (взвешенными частицами и донными отложениями), бионакопление; б) микробиологическая трансформация; в) химическая трансформация: гидролиз, фотолиз, окисление.
Рассмотрим некоторые из этих процессов подробнее.
§ 7.2. Физико-химические процессы на границе раздела фаз
Испарение и растворение газов на поверхности раздела воздух — вода имеет важное значение для массопереноса веществ с высокой летучестью. Поскольку процессы испарения — растворения зачастую
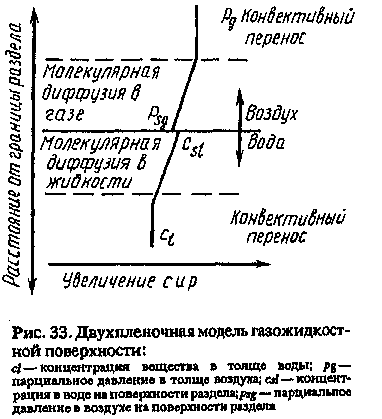
кинетики используют различ ные физико-математические модели. Наиболее широко при меняется так называемая двух- пленочная модель. Согласно этой модели, как в газовой, так и в жидкой фазах имеются две з-щы: зона молекулярной диф фузии с градиентом концентра ции вблизи поверхности разде ла фаз и зона конвективного транспорта вещества (при посто янной концентрации) вдали от поверхности (рис. 33).
В рамках модели можно рассчитать поток вещества через поверхность раздела в виде
функции независимо измеряемых параметров иидиии систем» « данного вещества. В частности, поток зависит от значения константы Генри (от отношения давления насыщенных паров к растворимости в воде) и от скорости молекулярной диффузии вблизи поверхности
раздела фаз.
Скорость молекулярной диффузии может быть оценена, например, из данных по скорости поглощения кислорода предварительно дезаэ-рированной водой (скорости реаэрации) с учетом испарения воды и
скорости ветра. При наличии турбулентности для потока вещества P[./V , моль/(см2«с)] из водной фазы в воздух применяется уравнение
Np = KA[P], (7.1)
где К — коэффициент массопереноса (испарения или растворения), см/с;' Д[Р] — градиент концентрации вещества Р в водной фазе. В случае испарения (или растворения) .коэффициент массопереноса ЗВ через границу раздела вода — воздух в выражении (7.1) может быть представлен в виде
1 _ 1 ■ Ч
К ~ Kl HKgCg '
где Кцд) — коэффициент массопереноса в жидкости (в газе); сцд) — молярная концентрация в воде (воздухе) при существующих температурах и давлении; Я — константа Генри, выраженная через молярные фракции Р в воздухе и в воде.
Величины Щ, Кд зависят от скорости воздуха над поверхностью воды. Обычно предполагается, что приповерхностная скорость воды составляет 3,5% от скорости ветра над водой.
На коэффициент испарения ЗВ заметное влияние оказывает испарение воды. Это связано с тем, что в силу высокой концентрации вода переходит через границу раздела воздух — вода со скоростью, в несколько тысяч раз превышающей скорость испарения любого другого компонента.
Для приближенной оценки скорости испарения веществ на поверх-ности раздела вода — воздух может быть использовано уравнение Кнудсена
Nv = top[M/(2*R7)]Ui, (7.2).
где /? = (2,0±0,2) • 10"5 — множитель, учитывающий испарение вещества
в воздух (а не в вакуум); р — давление даров вещества Р; М — моле-
Р
кулярная масса Р; Г— абсолютная температура.
Время, за которое концентрация вещества в жидкой фазе уменьшается вдвое за счет испарения, определяется соотношением
*1/2 = 0,б94/(/Ш)), (7.3)
где d — глубина слоя воды, из которого происходит испарение; Н —
= 16,04» M/(TS ) — константа Генри; S — растворимость вещества Р р р . р
в воде, мг/л; /= [М/(2жЛТ)}1/2.
228
Из уравнений (7.2) — (7.3) следует, что чем выше давление паров вещества, тем быстрее при прочих равных условиях оно испаряется. Напротив, вещества с низким давлением паров и высокой растворимостью в воде меньше подвержены процессам испарения по сравнению с веществами, характеризующимися высокими значениями р и меньшей растворимостью. Из данных табл. 28 следует, что наиболее быстро испаряются низкомолекулярные алифатические и ароматические углеводороды, в особенности алканы, циклоалканы и бензолы.
Таблица 28. Физико-химические параметры гаэожидкостных процессов (25 °С, рН = 7)
Вещество |
Давление |
Растворимость, |
<i/2. ч |
|
паров, Па |
мг/л |
|
Бензол |
12700 |
1780 |
0,065 |
п-Ксилол |
1170 |
180 |
0,71 |
Фенантрен |
0,2 |
1,2 |
4,2-10-* |
Антрацен |
0,001 |
0,04 |
5,3-105 |
Пирен |
0,001 |
0,14 |
8,3-105 |
Этилбензол |
035 |
152 |
0,81 |
Гексахлорбензол |
0,0015 |
0,11 |
5,7-10Б |
ддт |
2,2-10"5 |
0,003 |
3,1-107 |
м-Декан |
175 |
0,05 |
4,7 |
Линдан |
0,017 |
17 |
4,9-103 |
м-Пентан |
68400 |
40 |
0,012 |
Циклогексан |
10245 |
55 |
0,08 |
Сорбционные процессы занимают важное место в перераспределении в водных объектах нейтральных, как цравило, гидрофобных молекул. Равновесие сорбционного процесса можно записать в виде
•Кос
где Рш — вещество Р в водной фазе; Р5 •— вещество Р в сорбированном состоянии; Kqq — коэффициент распределения вещества Р в системе органическое вещество — вода:
Кос = PN/M.
Величины ЛТос для разных химических веществ зависят от коэффициентов активности веществ в воде при относительно постоянных коэф-
229
фициентах
активности в органической фазе. Этим,
в частности, обусловлено
существование корреляции между
коэффициентами распределения в
системах октанол — вода (K0w)
и
твердое органическое вещество
— вода (Кос)![]()
а также между Kow и фактором биоконцентрирования загрязняющих
веществ К . в
Величина Kow связана с растворимостью вещества в воде S простым
соотношением
![]()
Это соотношение выполняется • для многих классов органических соединений, включая углеводороды, галогенированные углеводороды, ароматические кислоты, хлорорганические пестициды, полихлориро-ванные бифенилы.
В природных сорбентах органическое вещество составляет лишь некоторую долю от массы сорбента, поэтому коэффициент распределения вещества Р в системе сорбент — вода (К ) принято нормировать
на содержание органического углерода (ОС) в сорбенте:
Кр = KoclOCl,
где [ОС] — содержание органического вещества в сорбенте.
При этом доля сорбированного вещества в водной среде (F) описывается уравнением
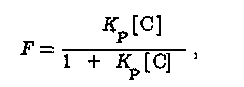
где [С] — концентрация суспензированного в воде сорбента. С ростом [С] величина F стремится к 1, т.е. все вещество Р будет находиться в сорбированном состоянии. В донных отложениях величина [С] велика, так что для многих загрязняющих веществ К [С] > 1. В открытых
водоемах обратная ситуация: сорбция оказывается существенной только для соединений с Кос > 105.
Американские исследователи изучали распределение инсектицида дильдрина — типичного представителя гидрофобных ЗВ в водохранилище Коралвилл (США). Они обнаружили, что 40% поступившего в
230
водохранилище дильдрина осаждается на дно и скапливается в донных отложениях, 50% выносится вниз по течению через шлюзы. Около 10% поступившего дильдрина накапливалось в рыбах. В толще воды дильдрин распределяется следующим образом: 64% накапливается в рыбах, 24% растворяется в воде и 12% сорбируется взвешенными твердыми частицами. Концентрация вещества в рыбах и донных отложениях находилась в равновесии со средней концентрацией растворенного дильдрина, причем количество дильдрина в рыбах было прямо пропорционально содержанию в них жира и концентрации в воде независимо от характера питания, вида, массы, размера рыб или других условий. Данные полевых измерений соответствовали лабораторным измерениям, нормированным на содержание жира, и соответствовали коэффициенту распределения в системе октаиол — вода.
По-видимому, такое равновесное распределение — общее правило концентрирования гидрофобных (липофильных) соединений в неполярных фракциях седиментарных частиц и гидробионтов.
Предположение о равновесности сорбционных процессов может не выполняться, если вещество претерпевает химические превращения. В этом случае скорость процессов сорбции — десорбции может лимитировать скорость химической трансформации ЗВ.
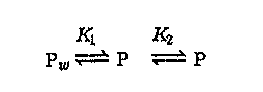
Изучение кинетики процессов сорбции показало наличие двух стадий:
Sl S2
На первой стадии сорбция вещества протекает быстро и обратимо. Это поверхностная сорбция. Дальнейшее проникновение вещества внутрь макромолекулярного клубка твердого органического сорбента — процесс медленный и может протекать в течение нескольких суток. Доля поверхностно-сорбированного вещества обычно составляет 0,35 — 0,6.
Сорбция многих загрязняющих веществ с растворимостью в воде менее 10"3М является одним из основных процессов удаления химического вещества из жидкой фазы. К таким веществам относятся хлорор-ганические пестициды, полихлорбифенилы, полиароматические углеводороды. Эти соединения малорастворимы в воде и имеют большие значения Kow (104 — 107). Для них сорбция является наиболее эффективным процессом самоочищения водной среды.
