
- •Введение в экологическую химию
- •Глава 1
- •§ 1.1. Биосфера и происхождение жизни на земле
- •§ 1.2. Энергетический и материальный баланс биосферы
- •§ 1.3. Антропогенное воздействие на окружающую среду
- •§ 1.4. Ограниченность природных ресурсов
- •§ 1.5. Энергетика и экология
- •1.5.1. Тепловые электростанции
- •1.5.2. Гидроэлектростажцжи
- •1.5.3. Атомные эяею1росташщи
- •1.5.4.1. Утилизация солнечной энергии
- •1.5.4.2. Термоядерная энергетика
- •1.5A3. Энергия ветра
- •1.5.4.4. Энергия прилива
- •1.5.4.5. Геотермальная энергия
- •1.5.4.6. Другие нетрадиционные источники
- •§ 1.6. Экономические и социальные проблемы охраны окружающей среды
- •Глава 2
- •§ 2.1. Мониторинг как система наблюдения и контроля за состоянием окружающей среды
- •§ 2.2. Процессы массопереноса загрязняющих веществ
- •§ 2.3. Методы контроля загрязняющих веществ в объектах окружающей среды
- •2.3.1. Спектральные методы анализа
- •Глава 3 круговорот веществ в биосфере
- •§ 3.1. Круговорот кислорода, фотосинтез
- •§ 3.2. Круговорот азота
- •§ 3.3. Круговорот фосфора и серы
- •Глава 4 экохимические процессы в атмосфере
- •§ 4.1. Физико-химические свойства атмосферы
- •§ 4.2. Химические процессы в верхних слоях атмосферы
- •§ 4.3. Химические процессы в тропосфере с участием свободных радикалов
- •§ 44. Вода в атмосфере
- •§ 4.5. Проблемы локального и глобального загрязнений воздушной среды
- •4.5.4.1. Монооксид углерода
- •4.5.5. Тяжелые металлы
- •§ 4.6. Способы очистки газовых выбросов
- •4.6.1. Очистка газов от твердых частиц
- •4.6.2. Очистка от газовых примесей
- •Глава 5
- •§ 5.1. Почвенные ресурсы
- •§ 5.3. Почва и вода, эрозия почв
- •§ 5.5. Загрязнение почв пестицидами
- •§ 5.6. Утилизация и переработка твердых отходов
- •Глава 6
- •§ 6.1. Краткие сведения о гидрохимии и гидробиологии
- •§ 6.2. Ашропошнное эвтрофиговжниё водоемов
- •§ 6.3. Лигандный состав и формы существования
- •§ 6.4. Внутриводоемный круговорот пероксида
- •§ 6.5. Роль донных отложений в формировании качества водной среды
- •Глава 7
- •§ 7.1. Виды загрязнений и каналы самоочищения водной среды
- •§ 7.2. Физико-химические процессы на границе раздела фаз
- •§ 7.3. Микробиологическое самоочищение
- •§ 7.4. Химическое самоочищение
- •7.4.1. Гидролиз
- •7.4.2. Фотолиз
- •7.4.3. Окисление
- •§ 7.6. Свободные радикалы в природных водах
- •7.6.2. Свойства радикалов Oj, он
- •§ 7.7. Моделирование поведения загрязняющих веществ в природных водах
- •Глава 8
- •§ 8.1. Молекулярный кислород как окислитель. Образование и свойства металл-кислородных комплексов
- •§ 8.2. Механизмы активации пероксида водорода,
- •§ 8.3. Типовые механизмы каталитических процессов окисления с участием 02, н202
- •§ 8.4. Перспективы технологического использования 02 и н202 как экологически чистых окислителей
- •§ 8.5. Внутриклеточные окислительно-восстановительные процессы с участием 02 и н202
- •Глава 9
- •§ 9.1. Общие сведения о структуре и функции
- •§ 9.2. Виды токсического воздействия загрязняющих веществ
- •§ 9.3. Биотесгирование в оценке загрязнения водной среды
- •Глава 10
- •§ 10.1. Характеристики сточных вод и виды их загрязнений
- •§ 10.3. Особенности биохимической очистки сточных вод
- •10.3.1. Аэробные методы очистки
- •10.3.1.1. Биологические пруды
- •10.3.1.3. Биофильтры
- •10.3.3. Биохимические процессы с участием минеральных форм азота
- •Глава 11
- •§ 11.1. Подготовка питьевой воды
- •§ 11.2. Применение хлора, озона и пероксида водорода в обработке воды и очистке сточных вод
- •1L2.2. Озонирование воды
- •§ 11.3. Методы локальной очистки сточных вод
- •11.3.3. Деструктивные методы очистки
§ 4.3. Химические процессы в тропосфере с участием свободных радикалов
Процессы фотодиссоциации кислорода и озона приводят к почти полному поглощению солнечного излучения с длиной волны менее 108
300 нм на высоте тропопаузы. Поскольку основные компоненты атмосферы не взаимодействуют с излучением при А > 300 нм, в тропосферных фотохимических реакциях участвуют лишь наименее распространенные компоненты атмосферы. Несмотря на то что средняя концентрация таких компонентов в атмосфере может быть пренебрежимо мала, в зонах хозяйственной активности локальные концентрации загрязняющих веществ могут значительно повышаться.
В химических превращениях различных загрязняющих веществ в тропосфере ключевое место занимает ОН-радикал, к образованию, которого ведут несколько процессов. Основной вклад дают фотохимические реакции с участием озона (см. § 4.2):
(1)
 (2)
(2)
В образовании озона в тропосфере играют роль фотохимические реакции с участием оксидов азота:
(3)
![]() (4)
(4)
Для атомарного кислорода в основном состоянии (3Р) характерна и реакция, приводящая к разложению озона (см. § 4.2):
![]() (5)
К
снижению концентрации Оз в тропосфере
приводит реакция
(5)
К
снижению концентрации Оз в тропосфере
приводит реакция
![]() (6)
Озон
участвует также в окислении NO2:
(6)
Озон
участвует также в окислении NO2:
![]() (7)
(7)
Образующийся триоксид азота неустойчив на свету и в дневное время суток распадается, в ночное время он взаимодействует с NO2 с образованием хорошо растворимого в воде N2O5:
![]() (8)
(8)
Взаимодействуя с атмосферной влагой, N2O5 превращается в азотную кислоту:
![]()
О большом влиянии фотохимических реакций на содержание озона в средних слоях тропосферы свидетельствует 50%-ное уменьшение его концентрации при солнечном затмении. Вблизи поверхности Земли стационарное содержание Оз в атмосфере в среднем составляет 0,5 мг/м3.
В образовании ОН в тропосфере наряду с Оз могут давать вклад реакции фоторазложения HNO2, HNO3, H2O2:
(Ю)
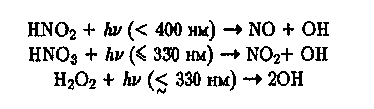 (12)
(12)
Концентрация ОН в тропосфере составляет (0,5—5)* 106 см"3.
Радикалы ОН в тропосфере участвуют преимущественно в реакциях с NO, NO2, СО и углеводородами. При взаимодействии ОН с оксидами азота в тропосфере образуются азотная и азотистая кислоты:
(13)
 (14)
(14)
Окисление СО до СОг — завершающая стадия окисления углеводородов и их производных в тропосфере:
![]() (15)
(15)
Образуюпщйся при этом атомарный водород быстро реагирует с Ог с образованием гидропероксилного радикала Н02
![]() (16)
(16)
который играет важную роль в химии атмосферы. Образуется радикал НОг также при взаимодействии ОН с Оз и НгОг-'
(17)
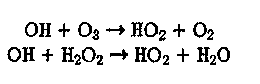 (18)
(18)
Установлено, что радикал НОг способствует возникновению фотохимического "смога", он эффективно взаимодействует с NO с образованием ОН-радикала:
![]() (19)
(19)
Концентрация НОг в тропосфере составляет 107—108 см"3. 110
Рекомбинация
Н02
— основной источник образования
атмосферного пероксида
водорода:![]()
Окисление СЩ под действием ОН протекает сопряженно с окислением NO. Соответствующий радикально-цепной механизм включает обитую для всех тропосферных процессов стадию инициирования ОН [реакции (1, 2)] и цикл экзотермических реакций продолжения цепи, характерных для реяктгай отсттглеиия ппгяничйгких соединений
(21)
(22)
(23)
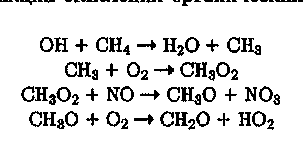 (24)
(24)
с последующим протеканием реакций (3), (4), (19). В результате брут-то-реакция окисления СН4 в присутствии N0 как катализатора и при воздействии солнечного света с длиной волны 300—400 нм запишется в виде
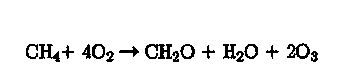 (25)
(25)
т.е. окисление метана (и других органических веществ) приводит к образованию тропосферного озона. Скорость этого процесса тем больше, чем выше концентрация NO.
Расчеты показывают, что антропогенный выброс NO удваивает приземную концентрацию Оз, а рост утечки СЩ, многократно опережающий по темпам роста другие виды загрязнений тропосферы, приводит к еще большему увеличению концентрации Оз по сравнению с переносом Оз из стратосферы.
Рост приземной концентрации озона представляет опасность для зеленой растительности и животного мира.
Образующийся при окислении СН4 формальдегид окисляется далее радикалами ОН с образованием СО. Этот канал вторичного загрязнения атмосферы моноксидом углерода сравним с поступлением СО от неполного сгорания ископаемого топлива:
![]()
Формальдегид может также эффективно распадаться под действием УФ-излучения:
(28) либо
 (29)
(29)
с последующим образованием HOr-радикала [см. реакцию (16)]. Суммарный квантовый выход реакций (28), (29) близок к единице.
Фотохимические процессы в системе Оз — NOx — НгО — RH служат основной причиной образования так называемого фотохимического смога (см. ниже), компоненты которого — пероксиацетилнитраты (ПАН) — токсичны для человека. ПАН — название группы соединений типа
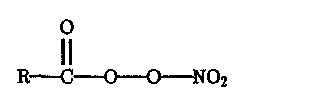
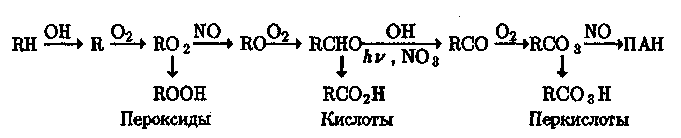
где R—СНз, СеНб и т.д. Эти соединения образуются в результате превращений:
В тропосферных процессах гидроксильный радикал играет ключевую роль в окислении не только углеводородов и промежуточных продуктов их окисления, но и в окислении серосодержащих органических соединений и аминов. В частности, окисление вторичных и третичных аминов зачастую сопровождается образованием канцерогенных нитрозоаминов.
Фотохимическое окисление серосодержащих органических соединений играет ведущую роль в образовании SO2 в районах, не подверженных антропогенному загрязнению.
Под действием ОН в атмосфере происходит окисление простых соединений серы, в частности H2S и (CHg^S. В то же время карбонил-сульфид устойчив к превращениям и просачивается в стратосферу (см. § 4.2). 112
Диоксид серы в тропосфере подвержен фотохимическим превращениям, поскольку при поглощении света в области 340—400 нм образует возбуждение молекулы SO^ (3Bi) с временем жизни 8 мс. Дальнейшее
окисление SO \ кислородом воздуха приводит к образованию SO3:
(30)
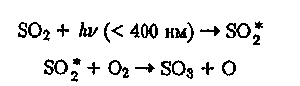 (31)
(31)
К образованию SO3 приводит также окисление 80г под действием НОг-радикалов:
(32)
а
также реакции фотоокислеиия![]() с
участием синглетного кислорода:
с
участием синглетного кислорода:
(33)
![]() (34)
(34)
Мы неоднократно упоминали об образовании "смога" при загрязнении городской атмосферы. "Смог"1 — это сочетание газообразных и твердых примесей с туманом или аэрозольной дымкой. Встречается "смог" Лондонского или Лос-Анджелеского типа. В первом случае причиной возникновения "смога" служит сжигание угля и мазута. При высокой влажности атмосферы образуется густой туман с примесью частиц сажи й SO2. Свое название этот "смог" получил после трагедии зимой 1952 т., когда в Лондоне в результате его образования умерло 3200 человек.
Фотохимический "смог" был впервые отмечен в 1944 г. в Лос-Анджелесе, когда в результате большого скопления автомобилей была парализована жизнь одного из крупнейших городов США. Фотохимический "смог" возникает под действием солнечного света в отсутствие ветра при низкой влажности воздуха. Наблюдается сильное раздражение слизистых оболочек дыхательных путей й глаз. Сохранение "смоговой" ситуации в течение длительного времени приводит к повышению заболеваемости и смертности среди населения. Особенно сильно "смог" влияет на детей и пожилых людей. Он оказывает вредное воздействие и на растительность, вызывая увядание и гибель листьев. Кроме того, фотохимический "смог" усиливает коррозию металлов, разрушение строительных сооружений, резины и других материалов.
От англ. smoke — дым, fog — туман.
113
Как указывалось, окислительный характер фотохимическому "смогу" придают озон и пероксилацетилнитраты. Измерения, проведенные в 50-х годах в Лос-Анджелесе, показывают, что увеличение концентрации озона связано с характерным изменением относительного содержания N02 и N0.
Ухудшение видимости во время "смога" (появление голубоватой дымки) связано с образованием аэрозольных частиц. Возникновение аэрозолей и последующее удаление их в процессах слипания, сухого и мокрого (с атмосферными осадками) осаждения является одним из основных путей самоочищения атмосферы.
Атмосферные органические аэрозоли могут образовываться по гомогенному или гетерогенному механизму. Первый из них включает газообразное окисление органических соединений с образованием твердых или жидких частиц, второй подразумевает сорбцию, каталитическое окисление, полимеризацию на поверхности уже существующих твердых и жидких аэрозолей.
Аэрозольные частицы либо попадают в атмосферу в готовом виде (в результате вулканической деятельности, пожаров, морской соли, пыли и т.д.), либо образуются из газовых выбросов непосредственно в атмосфере в результате химических процессов.
Из многочисленных органических соединений, попадающих в атмосферу, наибольшую склонность к образованию аэрозолей проявляют терпеновые углеводороды. Так, наблюдаемая над хвойными лесами в летнее время голубоватая дымка представляет собой аэрозоль, возникающий в результате фотохимического окисления терпенов.
Образование аэрозольных частиц в воздухе городов часто связывают с SO2, который при окислении дает H2SO4, превращающуюся при наличии в атмосфере аммиака в сульфат аммония.
Число твердых частиц в воздухе сильно варьирует в зависимости от местности. В нижней тропосфере, на высотах менее 2 км, в сельских районах концентрация частиц составляет около 104 см"3, а над городами превышает 105 см"3. В фоновых районах в отсутствие антропогенной деятельности в воздухе содержится всего 200—500 см"3 аэрозольных частиц.
