
- •Введение в экологическую химию
- •Глава 1
- •§ 1.1. Биосфера и происхождение жизни на земле
- •§ 1.2. Энергетический и материальный баланс биосферы
- •§ 1.3. Антропогенное воздействие на окружающую среду
- •§ 1.4. Ограниченность природных ресурсов
- •§ 1.5. Энергетика и экология
- •1.5.1. Тепловые электростанции
- •1.5.2. Гидроэлектростажцжи
- •1.5.3. Атомные эяею1росташщи
- •1.5.4.1. Утилизация солнечной энергии
- •1.5.4.2. Термоядерная энергетика
- •1.5A3. Энергия ветра
- •1.5.4.4. Энергия прилива
- •1.5.4.5. Геотермальная энергия
- •1.5.4.6. Другие нетрадиционные источники
- •§ 1.6. Экономические и социальные проблемы охраны окружающей среды
- •Глава 2
- •§ 2.1. Мониторинг как система наблюдения и контроля за состоянием окружающей среды
- •§ 2.2. Процессы массопереноса загрязняющих веществ
- •§ 2.3. Методы контроля загрязняющих веществ в объектах окружающей среды
- •2.3.1. Спектральные методы анализа
- •Глава 3 круговорот веществ в биосфере
- •§ 3.1. Круговорот кислорода, фотосинтез
- •§ 3.2. Круговорот азота
- •§ 3.3. Круговорот фосфора и серы
- •Глава 4 экохимические процессы в атмосфере
- •§ 4.1. Физико-химические свойства атмосферы
- •§ 4.2. Химические процессы в верхних слоях атмосферы
- •§ 4.3. Химические процессы в тропосфере с участием свободных радикалов
- •§ 44. Вода в атмосфере
- •§ 4.5. Проблемы локального и глобального загрязнений воздушной среды
- •4.5.4.1. Монооксид углерода
- •4.5.5. Тяжелые металлы
- •§ 4.6. Способы очистки газовых выбросов
- •4.6.1. Очистка газов от твердых частиц
- •4.6.2. Очистка от газовых примесей
- •Глава 5
- •§ 5.1. Почвенные ресурсы
- •§ 5.3. Почва и вода, эрозия почв
- •§ 5.5. Загрязнение почв пестицидами
- •§ 5.6. Утилизация и переработка твердых отходов
- •Глава 6
- •§ 6.1. Краткие сведения о гидрохимии и гидробиологии
- •§ 6.2. Ашропошнное эвтрофиговжниё водоемов
- •§ 6.3. Лигандный состав и формы существования
- •§ 6.4. Внутриводоемный круговорот пероксида
- •§ 6.5. Роль донных отложений в формировании качества водной среды
- •Глава 7
- •§ 7.1. Виды загрязнений и каналы самоочищения водной среды
- •§ 7.2. Физико-химические процессы на границе раздела фаз
- •§ 7.3. Микробиологическое самоочищение
- •§ 7.4. Химическое самоочищение
- •7.4.1. Гидролиз
- •7.4.2. Фотолиз
- •7.4.3. Окисление
- •§ 7.6. Свободные радикалы в природных водах
- •7.6.2. Свойства радикалов Oj, он
- •§ 7.7. Моделирование поведения загрязняющих веществ в природных водах
- •Глава 8
- •§ 8.1. Молекулярный кислород как окислитель. Образование и свойства металл-кислородных комплексов
- •§ 8.2. Механизмы активации пероксида водорода,
- •§ 8.3. Типовые механизмы каталитических процессов окисления с участием 02, н202
- •§ 8.4. Перспективы технологического использования 02 и н202 как экологически чистых окислителей
- •§ 8.5. Внутриклеточные окислительно-восстановительные процессы с участием 02 и н202
- •Глава 9
- •§ 9.1. Общие сведения о структуре и функции
- •§ 9.2. Виды токсического воздействия загрязняющих веществ
- •§ 9.3. Биотесгирование в оценке загрязнения водной среды
- •Глава 10
- •§ 10.1. Характеристики сточных вод и виды их загрязнений
- •§ 10.3. Особенности биохимической очистки сточных вод
- •10.3.1. Аэробные методы очистки
- •10.3.1.1. Биологические пруды
- •10.3.1.3. Биофильтры
- •10.3.3. Биохимические процессы с участием минеральных форм азота
- •Глава 11
- •§ 11.1. Подготовка питьевой воды
- •§ 11.2. Применение хлора, озона и пероксида водорода в обработке воды и очистке сточных вод
- •1L2.2. Озонирование воды
- •§ 11.3. Методы локальной очистки сточных вод
- •11.3.3. Деструктивные методы очистки
§ 8.3. Типовые механизмы каталитических процессов окисления с участием 02, н202
Важнейшей стадией в каталитических процессах окисления различных веществ молекулярным кислородом и пероксидом водорода явля-276
ется полное или частичное восстановление иона металла переменной валентности, участвующего в последующем взаимодействии с Ог или НгОг- Такое восстановление возможно либо при внешнем инициировании М+, либо за счет взаимодействия М2+ с донорами электрона. При наличии у донора (DH") лигандных свойств взаимодействие его с ионом металла в окисленной форме сопровождается образованием промежуточного комплекса частичного переноса заряда (ЧПЗ). Этот комплекс может затем либо распадаться на продукты электронного переноса с образованием восстановленной формы металла М+ и радикала редокс-лиганда Вл, либо взаимодействовать с другой окислительной частицей, обладая (частично) свойствами иона М+ и D~, В качестве такой окислительной частицы обычно выступает второй ион металла в окисленной форме. С другой стороны, окислителем может служить пероксид водорода, входящий в координационную сферу металл-донорного комплекса с образованием тройного комплекса ЧПЗ. Общую схему взаимодействия М2+ с DH" можно представить в виде

Примером инициирования ОН-радикалов ионом металла э частично восстановленной форме (без результирующего образования М+!) при комплексообразовании М2+ с лигандом-восстановителем служит взаимодействие Н202 с медно-аскорбатным комплексом:
![]() (1)
(1)
Фактически ион металла может находиться в окисленной форме и не менять своей валентности в процессе инициирования ОН.
Кооперация двух ионов металла при двухэлектронном окислении редокс-лиганда также распространенное явление в металл-комплексном катализе. Например, взаимодействие Си2+ с аскорбиновой кислотой протекает преимущественно с участием двух ионов меди:
(2)
![]() (3)
(3)
В общем случае редокс-каталитические процессы с участием ионов металлов переменной валентности, Ог и НгОг, могут быть разделены на циклические, активационные и радикально-цепные или индуцированные.
277
В циклическом механизме окислительной частицей, непосредственно участвующей в окислении субстрата, является ион металла в окисленном либо сверхокисленном состоянии. Роль Ог (Н2О2) при этом сводится лишь к регенерации окисленной (сверхокис-ленной) формы металла при окислении восстановленной формы, образующейся в процессе окисления субстрата.
Отдельные стадии такого процесса протекают по стехиометричес-ким реакциям типа
(4)
(5) или
(6)
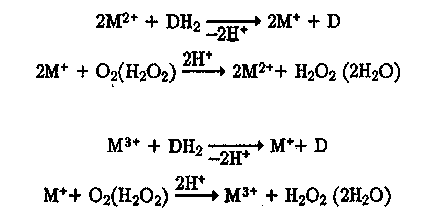 (7)
(7)
Эти брутто-реакции могут протекать как с участием, так и без участия промежуточных свободных радикалов. Цепные процессы в этом случае не реализуются.
При циклическом механизме для каждого окисляемого субстрата существует катализатор с оптимальной величиной редокс-потенциала пары М2+/М+ (М3+/М+)! Чем выше ^0(М2+/М+), у>о(М3+/М+), тем при прочих равных условиях быстрей взаимодействует окисленный металл с субстратом и медленнее происходит регенерация окисленной формы при взаимодействии М+ с Ог (НгОг). В зависимости от величины <р0 и концентрации реагентов могут реализоваться два крайних случая: 1) скорость реакции лимитируется окислением субстрата ионом металла, находящимся в окисленной форме; 2) скорость лимитируется окислением М+, ион металла находится в восстановленной форме. В первом случае скорость реакции не зависит от концентрации Ог (НгОг), во втором — не зависит от концентрации субстрата. При изменении концентрации реагентов в широких пределах наблюдаются меняющиеся (дробные) порядки реакции. С ростом концентрации субстрата скорость реакции растет, достигая предельного значения.
Оптимизация величин р0(М2+/М+), уз0(М3+/М+) может достигаться либо подбором иона металла й условий проведения реакции (температура, солевой состав, рН среды), либо изменением лигандного окружения центрального иона.
Циклические механизмы широко распространены в технологических и биологических процессах. Типичный пример — получение аце-тальдегида из этилена на палладиевом катализаторе 278
![]()
с участием СиСЬ в качестве сокатализатора:
(9) (10)
 (")
(")
В активационном механизме частицами-окислителями являются рассмотренные выше металл-кислородные и металл-перок-сидные комплексы. В зависимости от способа образования иона металла в восстановленной форме активационный механизм может быть молекулярно-цепным и нецепным. Как правило, активационные механизмы реакций осуществляются без промежуточного образования реакционноспособных радикалов. Нецепные активационные механизмы распространены в процессах жизнедеятельности.
Примером ион-молекулярного цепного механизма служит окисление аксорбата (DH") кислородом и пероксидом водорода:
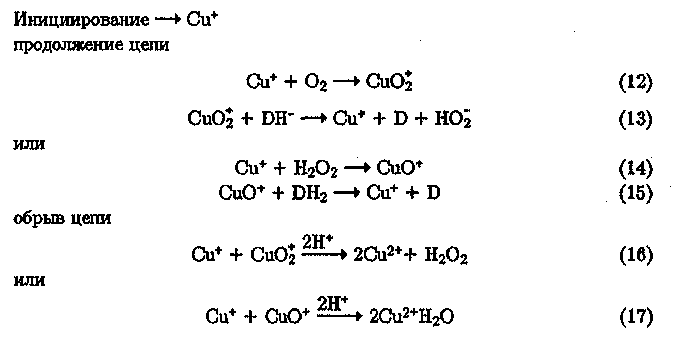
В реакциях (12)—(17) частицы Cu02, CuO+ участвуют в стадиях продолжения в двухэлектронном окислении субстрата-донора Н. Аналогичный механизм реализуется и при окислении других природных восстановителей, обладающих лигандными свойствами, — дигидрокси-фумаровой кислоты, гидрохинона. По-видимому, это распространенный в природе тип активационного катализа.
Редокс-каталитические радикальн о-ц е п н ы е процессы могут протекать при инициировании свободных радикалов с участием как иона металла, так и за счет внешних воздействий.
279
Каталитическое инициирование радикалов в кислой среде наиболее характерно для ионов железа при взаимодействии их с Й2О2. Классический пример радикально-цепного процесса — каталитическое разложение НгОг-'
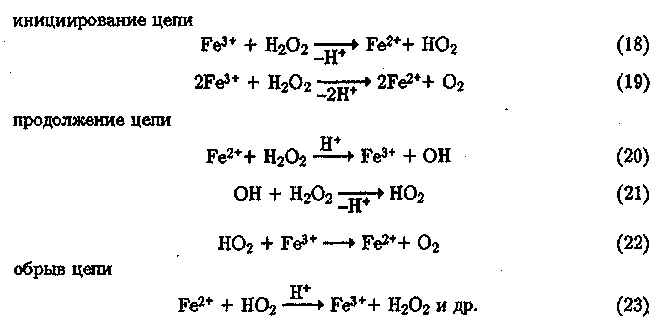
Пероксид водорода здесь выступает в качестве окислителя, источника радикалов ОН, и в качестве субстрата-донора электрона (атома Н), участвующего в восстановлении ионов Fe3+.
В случае ионов меди редокс-потенциал пары Cu2+/Cu+ слишком низкий (0,153 эВ), чтобы йон Си2+ мог окислить Н202 в кислой среде. В то же время при наличии внешних источников инициирования (например, примесь ионов железа, ультрафиолетовое излучение) реализуется эффективной радикально-цепной процесс:
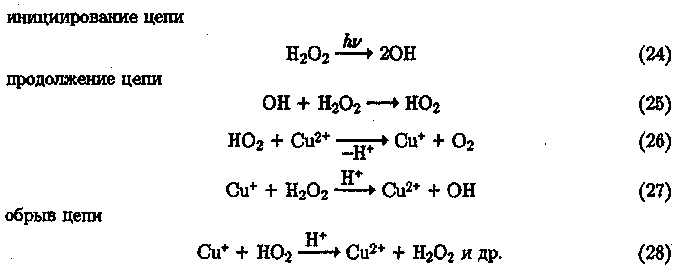
В области нейтральных значений рН среды ионы меди могут участвовать в инициировании свободных радикалов самостоятельно, поскольку усиливаются электронно-донорные свойства пероксида водорода и образуется промежуточный медь-кислородный комплекс ЧПЗ, распадающийся на продукты электронного переноса: 280
![]()
Константа скорости таких реакций может достигать при обычных температурах 107—108 М^-с"1, что обеспечивает эффективное инициирование радикалов ионами меди в слабощелочных средах.
