
- •Модуль № 3. Молекулярна біологія. Біохімія гормонів і фізіологічних функцій. Тематичний план практичних занять з модуля 3
- •Завдання для самостійної роботи студентів (срс)
- •Модуль № 3. Молекулярна біологія. Біохімія гормонів і фізіологічних функцій. Змістовий модуль 12. Основи молекулярної біології.
- •Теоретичні питання
- •Практична робота
- •Дослід 2. Кількісне визначення сечової кислоти в сечі.
- •Контроль виконання лабораторної роботи
- •Приклади тестів “Крок-1”
- •1. У сечі місячної дитини виявлено підвищений вміст оротової кислоти. Дитина погано набирає вагу. Які речовини потрібно використати для нормалізації метаболізму?
- •Індивідуальна самостійна робота студентів
- •Література
- •Змістовий модуль 13. Основи молекулярної генетики.
- •Теоретичні питання
- •Практична робота
- •Контроль виконання лабораторної роботи
- •Індивідуальна самостійна робота студентів
- •Література
- •Змістовий модуль 14. Молекулярні механізми дії гормонів білкової природи на клітини-мішені. Регуляція метаболізму.
- •Тема 3. Дослідження молекулярно-клітинних механізмів дії гормонів білкової природи на клітини-мішені.
- •Теоретичні питання
- •Практична робота і. Якісні реакції на інсулін.
- •Іі. Якісні та кількісні реакції на адреналін.
- •Контроль виконання лабораторної роботи
- •Приклади тестів “Крок-1”
- •Індивідуальна самостійна робота студентів
- •Література
- •Змістовий модуль 15. Молекулярні механізми дії стероїдних і тиреоїдних гормонів, їх участь у регуляції метаболізму.
- •Теоретичні питання
- •Практична робота
- •Контроль виконання лабораторної роботи
- •А. Кортизолу
- •А Тироксин і трийодтиронін
- •Приклади тестів “Крок-1”
- •Глутамату
- •Індивідуальна самостійна робота студентів
- •Література
- •Змістовий модуль 16. Біохімія харчування людини. Вітаміни як компоненти харчування. Тема № 5. Дослідження біохімічного складу та функцій слини.
- •Теоретичні питання
- •Практична робота
- •Питання контролю виконання практичної роботи
- •Приклади тестів “Крок – 1”
- •Індивідуальна самостійна робота студентів
- •Література
- •Теоретичні питання
- •Практична робота
- •Дослід № 3 Бензидинова проба на кров.
- •Контроль виконання лабораторної роботи
- •B. Дегідрогеназа
- •Реакцію Уффельмана
- •Приклади тестів “Крок – 1”
- •Теоретичні питання
- •Практична робота
- •Контроль виконання лабораторної роботи
- •Приклади тестів “Крок-1”
- •Індивідуальна самостійна робота студентів
- •Література Основна:
- •Теоретичні питання
- •Практична робота
- •Контроль виконання лабораторної роботи
- •Приклади тестів “Крок-1”
- •Індивідуальна самостійна робота студентів
- •Література Основна:
- •Змістовий модуль 17. Біохімія та патобіохімія крові.
- •Теоретичні питання
- •Практична робота
- •Контроль виконання лабораторної роботи
- •5. Як за вмістом залишкового азоту крові та загального азоту сечі диференціювати ретенційну і продукційну азотемії? Приклади тестів „Крок-1”
- •Індивідуальна самостійна робота студентів
- •Література
- •Теоретичні питання
- •Практична робота
- •Контроль виконання лабораторної роботи
- •Приклади тестів “Крок – 1”
- •Індивідуальна самостійна робота студентів
- •Література Основна:
- •Змістовий модуль 18. Функціональна та клінічна біохімія органів і тканин.
- •Конкретні завдання.
- •Теоретичні питання
- •Практична робота
- •Контроль виконання лабораторної роботи
- •Приклади тестів “Крок-1”
- •Індивідуальна самостійна робота студентів
- •Література
- •Теоретичні питання
- •Практична робота
- •Контроль виконання лабораторної роботи
- •Приклади тестів “Крок-1”
- •Індивідуальна самостійна робота студентів
- •Література
- •Теоретичні питання
- •Практична робота
- •Дослід 2. Кількісне визначення кальцію комплексонометричним методом.
- •Контроль виконання лабораторної роботи
- •Приклади тестів “Крок – 1”
- •Література Основна:
- •Теоретичні питання
- •Практична робота Дослід 1. Виявлення білка у тканинах зуба.
- •Контроль виконання лабораторної роботи
- •Приклади тестів “Крок-1”
- •C. Тиреокальцитоніну
- •Література:
- •Теоретичні питання
- •Практична робота
- •Контроль виконання лабораторної роботи
- •Приклади тестів “Крок-1”
- •D. Посилений розпад м’язових білків
- •Література
- •Перелік теоретичних питань до підсумкового модульного контролю № 3
- •Перелік практичних навичок до підсумкового модульного контролю № 3
Змістовий модуль 16. Біохімія харчування людини. Вітаміни як компоненти харчування. Тема № 5. Дослідження біохімічного складу та функцій слини.
Мета заняття. Засвоїти функції слини, її хімічний склад за умов норми та при патологічних станах порожнини рота та внутрішніх органів, оволодіти методами визначення активності лужної та кислої фосфатаз. інтерпретувати отримані результати; вивчити механізми патохімічних процесів, що виникають під час патологічних процесів у ротовій порожнині.
Актуальність теми. Слина є одним із перспективних об’єктів дослідження, єдиною біологічною рідиною з унікальним набором дослідницьких можливостей, що включають повну неінвазивність, багаторазовий і необмежений за об’ємом забір матеріалу. Крім того, її склад є індикатором стану ротової порожнини, що важливо знати студентам-стоматологам, адже зміну активності ензимів слини спостерігають при різних патологічних станах порожнини рота та внутрішніх органів.
Конкретні завдання.
Знати фізико-хімічні властивості слини та її порушення.
Давати оцінку біохімічному складу слини, вміти трактувати зміни активності ензимів ротової рідини.
Оволодіти методиками кількісного визначення активності фосфатаз і виявлення роданідів у слині. Давати оцінку проведеним дослідженням.
Теоретичні питання
регуляція слиновиділення. Механізм утворення слини.
функції слини людини (травна, захисна, мінералізуюча, протикарієсна).
кількісні показники секреції слини в нормі та при патології.
густина, в’язкість і рН слини в нормі та при патології.
органічні речовини слини – білки та ензими, їх роль у забезпеченні функцій слини. Зміни при патології органів ротової порожнини та організму в цілому.
небілкові азотисті компоненти слини, вуглеводи та ліпіди.
гормони слини, їх роль у регуляції метаболічних процесів ротової порожнини та організму в цілому.
неорганічні компоненти слини (мікро- та макроелементи), їх зміни при патології органів ротової порожнини.
Захисні механізми слини при палінні.
Практична робота
Дослід №1. Виявлення в слині роданідів.
Принцип методу. роданіди слини виявляють за появою червоного забарвлення при додаванні до слини хлорного заліза. Поява забарвлення викликана утворенням комплексної сполуки, що містить залізо та роданід.
Матеріальне забезпечення: слина, 0,01 % розчин хлорного заліза, 2 % розчин хлоридної кислоти.
Хід роботи. У пробірку вносять 5 крапель слини, 2 краплі 2 % розчину хлоридної кислоти та 2 краплі 0,01% розчину хлорного заліза. Виникає червоне забарвлення, інтенсивність якого залежить від вмісту в слині роданідів.
Зробити висновок.
Клініко-діагностичне значення. У людей, які палять, виділяється велика кількість роданідів, тому що в тютюновому димі крім нікотину, фенолів, чадного газу, канцерогенів типу бензпірену тощо, міститься синильна кислота, яка метаболізується під впливом ензиму роданідази до роданідів, які спричинюють утворення речовин канцерогенної дії – нітрозамінів. Останні, поряд із бензпіреном, нікотином можуть бути причиною розвитку передракового стану органів ротової порожнини – лейкоплакії або злоякісних новоутворень. При хронічній інтоксикації цими речовинами збільшується в’язкість слини, знижується рН, посилюється відкладання зубного каменю, що сприяє розвитку гінгівіту та пародонтиту.
Дослід №2. Визначення активності лужної та кислої фосфатази в змішаній слині.
Принцип методу. метод базується на здатності фосфатаз слини за певних умов гідролізувати ефірний зв’язок у паранітрофенілфосфаті. Вивільнений паранітрофенол у лужному середовищі (для лужної фосфатази) чи кислому середовищі (для кислої фосфатази) обумовлює утворення жовтого забарвлення розчину.
Матеріальне забезпечення: субстратний розчин паранітрофенілфосфату (натрієвої солі), 0,15 М аміачний буфер (рН = 10,0), 0,2 М ацетатний буфер (рН = 4,8), стандартний розчин паранітрофенолу, 1н і 0,02 н розчини NаОН, змішана слина, ФЕК, центрифуга, водяна баня, термометр.
а) Хід роботи визначення активності лужної фосфатази. У дві пробірки (дослідну та контрольну) вносять по 0,8 мл 0,15 М аміачного буферу (рН = 10,0) і 0,5 мл субстрату паранітрофенілфосфату. проби поміщають у водяну баню при температурі 37º С. Потім у дослідну пробірку додають 0,2 мл слини. Друга пробірка служить контролем на реактиви. Проби інкубують впродовж 60 хв при температурі 37º С. Після закінчення інкубації в обидві пробірки додають по 0,5 мл 1,0 н розчину їдкого натру, а в контрольну пробу вносять 0,2 мл слини. Об’єм проб доводять до 5 мл дистильованою водою і фотометрують при довжині хвилі 400 нм проти контролю.
б) Хід роботи визначення активності кислої фосфатази. у дві пробірки (дослідну та контрольну) вносять по 0,8 мл 0,2 М аміачного буферу (рН = 4,8) і 0,5 мл субстрату паранітрофенілфосфату. проби поміщають у водяну баню при температурі 37º С. Потім у дослідну пробірку додають 0,1 мл слини. Друга пробірка служить контролем на реактиви. Проби інкубують впродовж 60 хв при температурі 37º С. Після закінчення інкубації в обидві пробірки додають по 0,5 мл 1,0 н розчину їдкого натру, а в контрольну пробу вносять 0,1 мл слини. Об’єм проб доводять до 5 мл дистильованою водою і фотометрують при довжині хвилі 400 нм проти контролю.
Побудова калібрувальної кривої. 0,5мл, 1,0 мл, 1,5 мл, 2,0 мл, 2,5 мл стандартного розчину, які містять відповідно 0,05 – 0,25 мкмоль паранітрофенолу, з допомогою 0,02 н розчину їдкого натру доводять до об’єму 5,0 мл і виміряють оптичну густину на ФЕКу проти 0,02 н розчину їдкого натру. На основі отриманих результатів будують калібрувальну криву, відкладаючи по осі ординат значення показників оптичної густини при 400 нм, а по осі абсцис – кількість мкмолей паранітрофенолу.
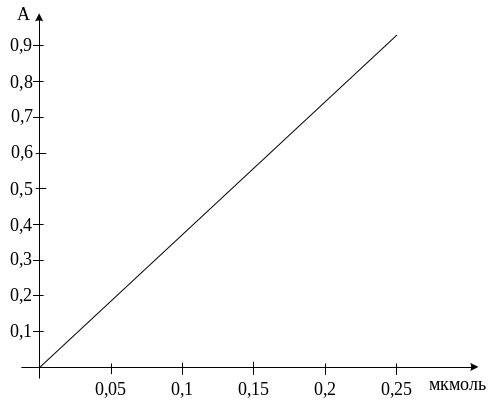
Активність лужної та кислої фосфатаз слини виражають у нмолях паранітрофенолу, вивільненого з паранітрофенолфосфату за 1хв при температурі 37 º С з 1 мл слини. Активність фосфатаз розраховують за формулою:
![]()
де: С – кількість паранітрофенолу (мкмоль), знайдена за калібрувальною кривою;
1 000 – коефіцієнт перерахунку активності ензиму в нмолі паранітрофенолу;
60 – час інкубації в хв;
а – кількість слини, взятої для аналізу.
Зробити висновок.
Клініко-діагностичне значення. У нормі активність лужної фосфатази (ЛФ) 1,8 – 5,8 нмоль паранітрофенолу/мл слини/хв, активність кислої фосфатази (КФ) – 8,6 – 21,0 нмоль паранітрофенолу/мл слини/хв.
Активність фосфатаз у слині зростає при запальних процесах пародонта та корелює з тяжкістю запального процесу в порожнині рота. У людей з високою активністю КФ відзначена стійкість до карієсу. активність ЛФ знижується при закисленні слини, декомпенсованому каріозному процесі. Разом із тим варто пам’ятати, що зміна фосфатазної активності слини може і не бути пов'язана з патологією слинних залоз чи пародонта, оскільки її концентрація змінюється при низці патологічних процесів внутрішніх органів (активність ЛФ зростає при патології кісток, особливо при рахіті, знижується при старечому остеопорозі, гіпотиреозі, гіповітамінозі С; активність КФ зростає при карциномі передміхурової залози).
