
- •Часть II
- •Эдс индукции
- •Взаимная индукция
- •Трансформатор
- •Явление самоиндукции
- •Лекция 2. (2 часа) Уравнения Максвелла
- •Теорема Гаусса для электрического поля
- •Теорема Гаусса для магнитного поля
- •Циркуляция вектора электрического поля
- •Циркуляция вектора магнитного поля
- •Ток смещения
- •Пружинный маятник (рис. 3)
- •Физический маятник (рис. 4)
- •Математический маятник (рис. 5)
- •Гармонический осциллятор при наличии сил сопротивления
- •Лекция 4.( 2часа) Вынужденные механические колебания. Упругие волны
- •Упругие волны
- •Уравнение бегущей волны
- •Принцип суперпозиции. Интерференция волн
- •1) Если колебания происходят в одинаковой фазе, т.Е. ( , (5)
- •Стоячие волны
- •Эффект Доплера
- •Затухающие электрические колебания
- •Лекция 6. (2 часа) Вынужденные электромагнитные колебания. Электромагнитные волны
- •Вынужденные электрические колебания
- •Резонансные явления в колебательном контуре. Резонанс напряжений и резонанс токов.
- •Электромагнитные волны.
- •Характеристики электромагнитной волны
- •Энергия, поток энергии электромагнитной волны
- •Лекция 7. (2 часа) Интерференция света
- •Когерентность и монохроматичность световых волн
- •Некоторые методы наблюдения интерференции света
- •Применение интерференции света
- •Лекция 8. ( 2 часа) Дифракция света
- •Принцип Гюйгенса — Френеля
- •Метод зон Френеля
- •Дифракция Френеля на круглом отверстии
- •Дифракция Френеля на диске
- •Дифракция Фраунгофера на одной щели
- •Дифракция Фраунгофера на дифракционной решетке
- •Дифракция на пространственной решетке
- •Лекция 9. (2 часа)
- •Дисперсия и поглощение света в веществе.
- •Поглощение света
- •Естественный и поляризованный свет
- •Поляризация света при отражении и преломлении на границе двух диэлектриков
- •Двойное лучепреломление. Призма Николя
- •Искусственная оптическая анизотропия
- •Вращение плоскости поляризации
- •Лекция 10. (2 часа) Тепловое излучение
- •Понятие о равновесном тепловом излучении
- •Характеристики теплового излучения
- •Закон Кирхгофа
- •Законы излучения абсолютно черного тела
- •Квантовый характер излучения
- •Лекция 11. (2 часа) Фотоэлектрический эффект
- •Внешний фотоэффект
- •Внутренний фотоэффект
- •Вентильный фотоэффект
- •Корпускулярно-волновой дуализм
- •Лекция 12. (2 часа) Теория атома водорода по Бору
- •Закономерности линейчатых спектров водорода
- •Модель атома Томсона
- •Опыты Резерфорда
- •Планетарная модель атома Резерфорда
- •Постулаты Бора
- •Опыты Франка и Герца
- •Лекция 13. (2 часа) Элементы квантовой механики
- •Гипотеза Луи-де-Бройля
- •Корпускулярно-волновые свойства частиц
- •Соотношение неопределенностей
- •Электрон в электронно-лучевой трубке и в атоме
- •Длина волны де-Бройля покоящихся тел
- •Физический смысл волновой функции
- •Волновая функция заряженной частицы
- •Операторы импульса и энергии
- •Уравнение Шредингера
- •Лекция 14. (2 часа) Оптические квантовые генераторы
- •Спонтанные и вынужденные переходы, их вероятность
- •Инверсная населенность уровней
- •Лекция 15. (2 часа) Элементы зонной теории твердых тел
- •Лекция 16. (2 часа) Радиоактивность
- •Радиоактивность
- •Методы регистрации радиоактивного излучения
- •Правила радиоактивного смещения
- •Изотопы, изобары, изотоны, изомеры
- •Закон радиоактивного распада, активность
- •Атомное ядро
- •Ядерные силы
- •Современные представления о природе электромагнитных и ядерных сил
- •Туннельный эффект
- •Понятие об устойчивости ядра
- •Ядерные реакции и элементарные частицы
- •Ядерные реакции
- •Реакции с медленными частицами
- •Реакции с быстрыми нейтронами
- •Деление тяжелых ядер
- •Ядерное оружие и ядерная энергетика
- •Термоядерные реакции
- •Водородная бомба
- •Управляемые термоядерные реакции
- •Элементарные частицы Виды взаимодействий элементарных частиц
- •Систематика элементарных частиц
- •Частицы и античастицы
- •Законы сохранения
Лекция 12. (2 часа) Теория атома водорода по Бору
(Модели атома Томсона и Резерфорда. Опыт Резерфорда. Постулаты Бора. Энергетический спектр атома водорода. Закономерности атомных спектров. Формула Бальмера.)
Закономерности линейчатых спектров водорода
Как уже отмечалось, линейчатые спектры излучения дают отдельные, изолированные атомы. Поэтому изучение линейчатых спектров явилось ключом к пониманию строения атома ‑ этого неделимого кирпичика материи.
При исследовании спектров, было установлено, что линии спектров испускания расположены не хаотично, а образуют определенную закономерность. Все линии имеют тенденцию группироваться, образуя так называемые серии.
Н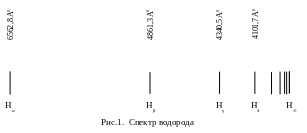 аиболее
простым закономерностям подчиняется
спектр атома водорода. На рис. 1. показаны
спектральные линии в видимой области
спектра для водорода.
аиболее
простым закономерностям подчиняется
спектр атома водорода. На рис. 1. показаны
спектральные линии в видимой области
спектра для водорода.
![]() ‑ видимые
линии серии,
‑ видимые
линии серии,
![]() ‑ граница серии.
‑ граница серии.
Швейцарский физик Бальмер (1885 г.) показал, что длины волн этой серии могут быть представлены в виде формулы:
![]()
Если от длин волн перейти к частотам, то получится следующая формула:
![]()
Обычно эту формулу переписывают в виде:
![]() (1)
(1)
В
таком виде формула (3.1) называется
формулой Бальмера. Постоянная
,
в формуле Бальмера, называется
постоянной Ридберга. Ее численное
значение найдено экспериментально
![]() .
.
Формула Бальмера дает закономерность распределения линий в серии, поэтому иногда ее называют серией Бальмера.
Дальнейшие исследования показали, что в спектре водорода имеются еще серии, которые названы по фамилиям их исследовавших ученых и эти серии описываются аналогичными формулами.
Серия
Лаймана
![]()
Серия
Бальмера
![]()
Серия
Пашена
![]()
Серия
Брекета
![]()
Серия
Пфунда
![]()
Все эти серии можно объединить ой общей формулой:
![]() (2)
(2)
При возрастании частота каждой серии стремится к предельному значению
![]()
которая называется границей серии. По аналогии, начало серии будет определяться как
![]()
Выражение
![]() называется спектральным термом или
просто термом и обозначается
называется спектральным термом или
просто термом и обозначается
![]() .
В этом случае обобщенная формула
Бальмера примет вид:
.
В этом случае обобщенная формула
Бальмера примет вид:
![]()
Для более сложных атомов частоты также можно представить в виде разности термов, но термы имеют более сложное строение и могут быть вообще из разных серий.
Модель атома Томсона
Изучение спектров изолированных атомов показало, что атомы имеют какое-то внутреннее строение, что это не есть неделимые кирпичики материи. Надо было объяснить наблюдаемые спектры, т.е. надо было объяснить строение атома.
К тому времени были уже известны отрицательно заряженные частицы ‑ электроны и положительно заряженные частицы ‑ протоны. Причем, масса протона во много раз больше массы электрона, а заряд равен заряду электрона.
И сходя
из этого, Томсон в 1903 году предложил
следующую модель строения атома. Атом
представляет собой положительно
заряженную сферу, внутри которой
находится электрон (см. рис. 2).
сходя
из этого, Томсон в 1903 году предложил
следующую модель строения атома. Атом
представляет собой положительно
заряженную сферу, внутри которой
находится электрон (см. рис. 2).
Напряженность электрического поля внутри заряженной сферы определяется выражением :
![]()
так как заряд положительной сферы равен заряду протона, т.е. заряду электрона.
Тогда на электрон, находящийся внутри заряженной сферы, со стороны электрического поля действует сила, направленная к центру сферы:
![]()
где
![]() .
Отсюда следует, что на электрон в атоме
действует квазиупругая сила, подобная
силе механической пружины, коэффициент
жесткости которой равен
.
.
Отсюда следует, что на электрон в атоме
действует квазиупругая сила, подобная
силе механической пружины, коэффициент
жесткости которой равен
.
Т.е. если электрон вывести из положения равновесия (центр атома), то он начнет совершать колебания, с частотой, равной
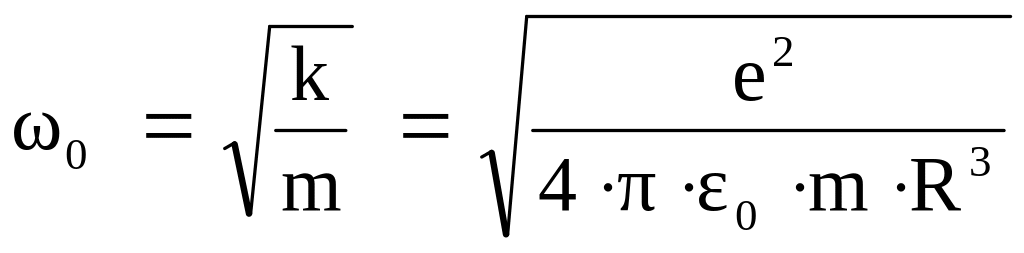
При гармонических колебаниях электрон будет двигаться ускоренно и, следовательно, должен излучать электромагнитные волны. Частота этих электромагнитных волн совпадает с частотой колебаний электрона. Зная частоту, можно определить радиус атома. Действительно, из формулы для собственной частоты колебаний электрона в атоме получим:

Подставим числовые значения:

Произведя вычисления, получим:
![]()
Полученное числовое значение радиуса атома совпадает со значением, полученным из газокинетических представлений.
