
- •1. Методи отримання полімерних матеріалів.
- •4.2. Технологія отримання карбамидоформальдегидных олигомеров.
- •4.3. Поліконденсация карбаміду і формальдегіду в кислій середі.
- •4.3.1.Структура і властивості полиметиленкарбамида.
- •4.3.3. Закономірності утворення твердої фази полиметиленкарбамида.
- •4.3.4.Модифікація полиметиленкарбамида.
- •4. 3.5. Морфологія полиметиленкарбамида.
- •4.3.6. Деякі основні сфери застосування пмм.
- •5.2. Будова карбамидоформальдегидных смол.
- •5. 3. Вплив технологічних чинників на будову кфс.
- •5.4. Вплив технологічних чинників на зміст вільного f.
- •Зниження змісту вільного формальдегіду в кфс шляхом використання акцепторів формальдегіду.
- •5.5.1. Зниження токсичності кфс за рахунок введення в її склад
- •Зниження токсичності кфс за рахунок використання амінів і амидов карбонових кислот як акцептори формальдегіду.
- •Екологічно чистий спосіб отримання карбамидоформальдегидных олигомеров.
- •6.1. Отримання карбамідів олигомеров з диметилолмочевины.
- •6.2. Отримання карбамидоформальдегидных олигомеров з концентрату карбмидо-формальдегидного (форконденсата).
- •7. Модифіковані мочевиноформальдегидные полімери і матеріали на їх основі
- •8. Очищення стічних вод виробництва карбамидоформальдегидных смол.
- •8.1. Біохімічні методи очищення стічних вод від формальдегіду.
- •8. 2. Физико-хімічні методи очищення стічних вод.
- •8.3. Хімічні методи очищення стічних вод, що містять формальдегід.
- •9. Полімери меламино-формальдегидные
- •10. Полімери анилино-формальдегидные
- •11.Техніка безпеки при виробництві амино-альдегидных олигомеров і пластичних мас на їх основі
- •12. Феноло-альдегидные полімери
- •12. 1. Сировина для отримання фенолоальдегидных полімерів
- •12. 2. Особливості процесів синтезу фенолоальдегидных полімерів
- •12. 3. Каталізатори процесів отримання фенолформальдегидных олигомеров.
- •12. 4. Технологія отримання новолачных олигомеров
- •12.4.1 Властивості новолачных олигомеров і полімерів
- •12.5. Виробництво резольних олигомеров
- •12.5.1. Властивості резольних олигомеров і полімерів
- •12.6. Полімери на основі гомологов фенолу і формальдегіду
- •12.6.1. Феноло-фурфурольниє полімери
- •12.6.2. Полімери Феноло-лигниновые
- •12.7. Модифіковані полімери феноло-формальдегидные
- •12.7.1. Маслорастворімиє полімери феноло-формальдегидные
- •12.7.2. Поєднані полімери
- •12.8. Полімери резорцино-формальдегидные
- •12.8.1. Обесфеноліваніє водної фази
12. 3. Каталізатори процесів отримання фенолформальдегидных олигомеров.
Як каталізатори гидроксиметилирования фенолу використовують гидроксиды натрію, кальцію, магнію, барію, карбонату натрію, аміак, а також ГМТА і інші третинні аміни. У всіх промислових процесах виробництва ФС використовують водні розчини формальдегіду, в яких він знаходиться у формі метиленгликоля.
З сильними підставами фенол швидко реагує з освітою стабілізованого за рахунок резонансу феноксидиона:
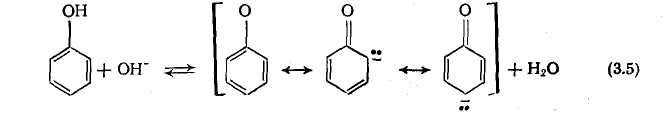
Далі протікає те, що каталізує лугом С-алкилірованіє в орто- і парі-положенні фенолового ядра; заміщення в мета-положение практично не відбувається. Для реакції в розбавлених розчинах запропонований наступний механізм [24], причому передбачається, що хиноидное перехідний стан стабілізований за рахунок зсуву протона [24]:

Що утворилися на першій стадії монометилольные (моногид-роксиметильные) похідні фенолу зберігають здібність до подальшої взаємодії з формальдегідом з освітою два ізомерних диметилольных і одного триметилольного з'єднання.
Кінетика реакції фенолу з формальдегідом при основному каталізі в даний час вивчена достатньо детально, ця реакція задовільно описується рівнянням другого порядку, за винятком реакції, що каталізує аміаком, яку точніше описує рівняння першого порядку. Для всіх типів реакції в лужній середі застосовно наступне основне рівняння:
![]()
Слід зазначити, що будова гидроксиалкилирующего реагенту до теперішнього часу остаточно не з'ясована, і не зовсім зрозуміло, як метиленгликоль реагує з феноксидионом Концентрація негидратированного формальдегіду дуже мала, щоб нею можна було пояснити швидкості реакції гидроксиметилирования.

Декілька інший механізм реакції, запропонований Кляйзеном, Уокером і іншими ученими, заснований на існуванні гемиформалей у водних фенолоформальдегидных системах. Доказом утворення гемиформалей як проміжних з'єднань, що супроводиться міграцією гидроксиметильной групи є припинення взаємодії фенолу з формальдегідом після этерификации фенолової гідроксильної групи:
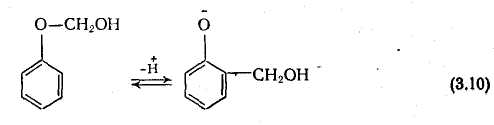
Проте це твердження не зовсім коректно, якщо взяти до уваги, що при гидроксиметилировании фенолу в лужній середі основним параметром, що визначає швидкість процесу, є нуклеофильность феноксидиона.
Безліч експериментальних результатів свідчать про те, що насправді будова перехідного стану значно складніша, ніж це показано вище. Головна відзнака реальності від моделі полягає в існуванні явної залежності швидкостей орто- і пари-заміщення від типа вживаного каталізатора, причому співвідношення орто- і пара-изомеров зменшується від 1,1 (при рН = 8,7) до 0,38 (при рН = 13,0). Так, було встановлено сильне збільшення частки орто-замещения у ряді використовуваних як каталізатори гидроксидов металів I і II груп: До < Na < Li < Ba < Sr < Ca < Mg.
Сильний орто-ориентирующий ефект проявляє також і борна кислота:
Цей ефект ще виразніше виражений для гидроксидов перехідних металів. Мабуть, орто-замещению сприяє підвищена міцність утворюваних з катіонами хелатных з'єднань, оскільки Бенкет [26, 28] пояснює орієнтуючий эффектионов Fe, Сі, Cr, Ni, Co, Mn і Zn саме утворенням хелатов як проміжні з'єднання:
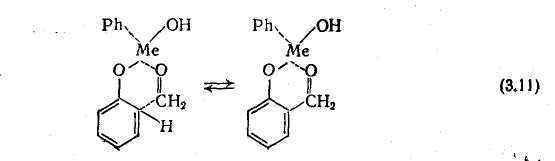

Відмітимо, що свого часу ще Бендер встановив, що при конденсації фенолу з формальдегідом у присутності катализаторов— оксидів магнію і цинку утворюються новолаки з підвищеною часткою орто-заместителей (так звані «ортоноволаки»).
Найбільшою мірою орто-ориентация заступників досягається при використанні як каталізатори ацетату цинку потім слідують оксид магнію і триэтиламин
До пояснення як самого явища орієнтації заступників, так і залежності орієнтуючого ефекту від типа каталізатора слід личити обачно, бо концентрація в реакційній суміші індивідуальних фенолоспиртов залежить не лише від швидкості їх освіти, але також і від швидкості їх зникнення унаслідок протікання подальших реакцій. Швидкість же исчезновения, у свою чергу, залежить від тривалості реакції і молярного співвідношення фенолу і формальдегіду.
Резоли, що отримуються при каталізі аміаком, різко відрізняються від всіх інших резолів не лише вищою среднечисловой молекулярною масою, але і характерним жовтим кольором, який обумовлений присутністю азометиновых груп —CH = N—. Відмітимо, що цей колір типовий також і для новолаков, отвержденных ГМТА. Показано що вказані форполимеры містять ланки дибензиламина і трибензиламина:
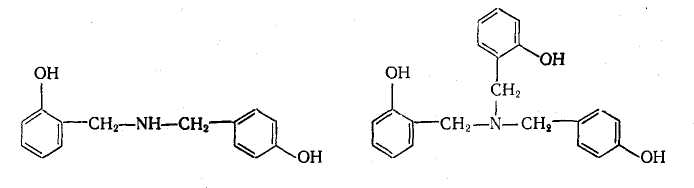
Формально реакція між фенолами, альдегідами і амінами може розглядуватися як аминоалкилирование, зазвичай зване реакцією Манніха

Феноли — з'єднання, що мають кислі ОН- і СН-группы. Проте заміщення, як правило, відбувається в ароматичному ядрі. Якщо одночасно з фенолами в реакційній системі присутні аміни, то карбонільний компонент може взаємодіяти з двома нуклеофилами. Тому необхідно визначити, який з нуклеофилов — фенол або амін — першим прореагує з формальдегідом.
При взаємодії формальдегіду, з аміаком або з аліфатичними амінами утворюються кристалічні гексагидротриазины. Синтез останнього з формальдегіду і аміаку є дуже швидким процесом. Швидкість цього процесу визначається зрештою швидкістю найбільш повільної стадії, а саме утворенням бисгидроксиметиламина. У розбавленій водній системі ця реакція зупиняється на стадії утворення а-аминоспиртов і альдимины утворюються тільки в дуже невеликій кількості; всі стадії реакції обратимы:
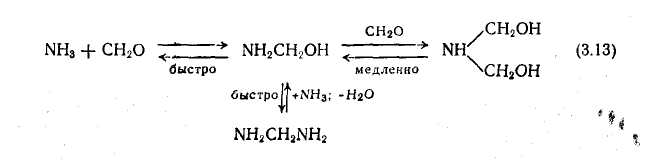
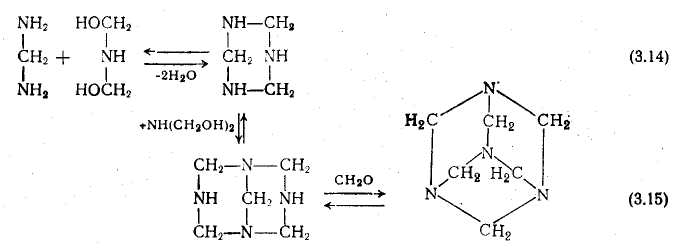
При гідролізі гексаметилентетраамина також утворюються аминометилированные продукти, тому як взаємозамінні каталізатори, що забезпечують однакові кінцеві результати, може бути використаний як гексаметилентетрамина, так і еквівалентна кількість аміаку.
Промислове значення має і реакція утворення 2,4,6-трисдиметиламинометилфенола з фенолу, формальдегіду і диметиламина:

Цікаво, що при аминометилировании феноли часто утрачивают розчинність в розчині гидроксида натрію.
Молекулярний масовий розподіл резолів, отриманих при каталізі великими кількостями аміаку, значно відрізняється від молекулярно масового розподілу інших резолів. В той же час форполимеры, отримані з третинними амінами як каталізатори, мають будову, схожу з будовою резолів, отриманих з гидроксидом натрію.
Властивості резолів, що синтезуються за допомогою аміаку, дозволяють отримувати на їх основі промислові тверді форполимеры з температурою плавлення 40—60 °С, які застосовуються в різних галузях промисловості, наприклад для виробництва пресс-материалов, гальмівних колодок, абразивних матеріалів, покриттів і тому подібне Для отримання стабільних при зберіганні пресс-порошков, що не злежуються, бажано мати смоли з ще вищою температурою плавлення.
Розчини резолів, отриманих при каталізі аміаком, широко застосовуються для отримання покриттів і у виробництві шаруватих пластиків електротехнічного призначення. При використанні таких резолів: для досягнення високих діелектричних показників і стійкості до корозії не вимагається видалення (осадженням або відмиванням) основного каталізатора.
Якнайповніше вивчена реакція фенолу з формальдегідом, що каталізує гидроксидом натрію. Знайдені значення відносних швидкостей реакції представлені в таблиці Константа швидкості утворення о-метилолфенола прийнята за одиницю.
Реакцію проводили при 30 °С і молярному
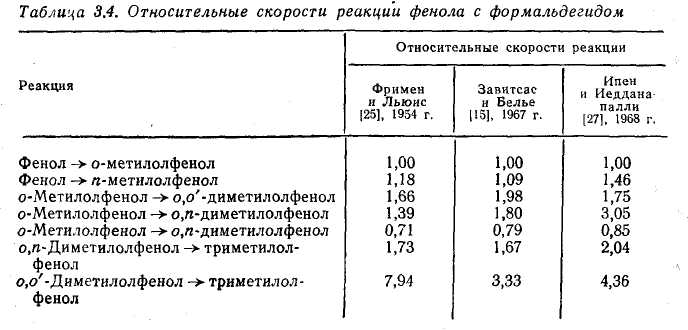
співвідношенні фенол: формальдегід: NAOH, рівному 1:3:1. Схема протекаемых реакцій приведена нижче:
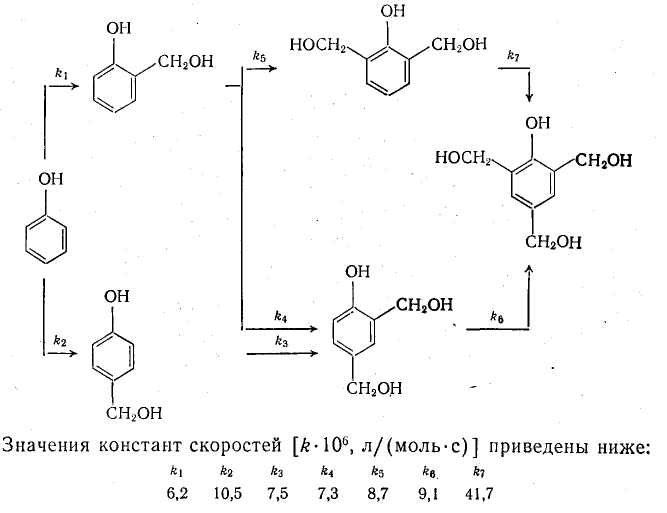
Було знайдено, що по відношенню до формальдегіду пара-положення фенолового ядра має декілька вищу реакційну здатність, ніж opтo-положение. Проте через існування двох доступних орто-положений о-метилолфенол утворюється з вищою швидкістю, ніж n-метилолфенол Прийнято вважати, що метилольная група зволікає електрони, тому передбачалося, що по відношенню до формальдегіду реакційна здатність метилолфенолов буде зниженою в порівнянні з незаміщеним фенолом. Проте при введенні метилольной групи в орто-положение було несподівано виявлено значне підвищення реакційної здатності. Пізніше подібний ефект виявили і для вище гидроксиметилированных фенолів. Природно, що описані ефекти вносять елементи невизначеності в інтерпретацію кінетичних даних.
Підвищення реакційної здатності системи, що викликається метилольным заміщенням, має велике практичне значення, бо через відмічену тенденцію до переважного утворення полиспиртов (зазвичай небажаною) промислові резоли містять значні кількості фенолу, що не прореагував, навіть при високому молярному співвідношенні формальдегіду і фенолу. Це є недоліком не лише з погляду якості смоли, але також і унаслідок виникаючих серйозних проблем захисту навколишнього середовища.
Спранг вивчав реакційну здатність різних фенолових з'єднань — фенолу, резолів і ксиленолов — з л-формальдегідом у присутності триэтаноламина як каталізатор (без додавання води). Нижче представлені результати визначення відносних швидкостей перетворення формальдегіду в реакції з різними феноловими з'єднаннями:

Швидкість приєднання формальдегіду до м-крезолу в три рази вище, ніж до фенолу. Метільная група, введена в орто- або пару-положення зменшує реакційну здатність ароматичного ядра..
