
- •Химический состав и строение молекулы воды.
- •Водородные взаимодействия.
- •Агрегатные состояния воды.
- •Аномалии воды.
- •Химические свойства воды.
- •Свойства растворов
- •6. Физико-химические свойства растворов неэлектролитов и электролитов.
- •7. Свойства растворов слабых электролитов.
- •Ионные равновесия
- •8. Растворимость веществ в воде.
- •10. Диссоциация воды.
- •11. Ионное произведение воды
- •12. Буферные растворы и их свойства
- •13. Гидролиз солей
- •14. Количественные характеристики гидролиза
- •15. Понятие о системах, фазах, компонентах.
- •16. Диаграмма состояния воды
- •17. Окислители и восстановители
- •18. Типы окислительно-восстановительных реакций
- •19. Окислительно-восстановительные потенциалы
- •20. Окислительно-восстановительные свойства воды
- •Классификация дисперсных систем.
- •Методы получения дисперсных систем.
- •Строение коллоидной частицы.
- •Свойства коллоидных систем.
- •Электрокинетические явления.
- •26.Причины устойчивости коллоидных систем
- •27. Разрушение дисперсных систем
- •28. Поверхностное натяжение
- •29. Поверхностно активные вещества
- •Поверхностные явления
- •30. Адсорбция равновесия
- •34 Особенности химического состава природных вод
- •36. Понятие об обобщённых оценочных показателях качества воды.
- •37. Химические показатели качества воды
- •40. Отстаивание.
- •41. Осаждение
- •42. Фильтрование воды
- •43. Флотация и электрофлотация
- •44. Коагуляция
- •45. Зависимость выбора оптимальных условий обработки различными коагулянтами от качества воды
- •46. Электрокоагуляция, эффективность использования
- •47. Флокулянты (анионо- и катионоактивные) их природа, свойства и методы действия, выбор оптимальной дозы.
- •48. Хлорирование: хлорирующие реагенты; механизм обеззараживающего действия, хлороёмкость воды в отсутствии и присутствии солевого аммиака.
- •56. Жесткость воды
- •57. Единицы измерения жесткости
- •58. Методы реагентного умягчения воды, их эффективность, контроль процессов реагентного умягчения.
- •59. Умягчения воды методом ионного обмена
- •60. Иониты (катиониты и аниониты), их природа, строение, свойства.
- •61. Термический метод умягчения воды.
- •62. Импфирование (подкисление)
- •63. Опреснение воды
- •64. Электрохимический метод.
- •66. Методы удаления из воды соединений железа и марганца
- •67.Удаление кремниевой кислоты
- •68.Обесфторирование и фторирование воды.
- •69. Не нашли этот вопрос
- •70. Углекислота и ее формы.
- •71. Вычисление содержания агрессивной углекислоты с помощью таблицы
- •72. Индекс насыщения воды карбонатом кальция
- •73. Особенности химического состава бытовых и производственных сточных вод
- •75Отстаивание, удаление масел и нефти
- •76.Коагулирование сточных вод.77.Выбор и подготовка коагулянтов.
- •78) Флотация сточных вод.
- •79) Сорбция.
- •80) Сорбция – область использования, факторы, влияющие на выбор сорбентов.
- •81) Экстракция, требования, предъявляемые к экстрагентам, экстракция в противотоке.
- •82.Эвапорация и аэрация.
- •83. Области использования аэрации и эвапорации, контроль процессов.
- •85. Нейтрализация сточных вод
- •84. Радиационнаяочистка сточных вод от органических загрязнений.
- •87.Химич очистка сточных вод
- •86.Дезинфекция сточных вод
- •88.Химическое окисление под давлением
- •89.Кристаллизация.
71. Вычисление содержания агрессивной углекислоты с помощью таблицы
Анализом устанавливают количество свободной и связанной углекислоты (если содержание гидрокарбонатного иона дано в мг-экв/л, то его нужно умножить на эквивалентную массу СО2, т. е. на 22). Сумму свободной и связанной углекислоты (в мг/л) находят в графе S, а в графе G — соответствующую ей сумму связанной и агрессивной углекислоты. Вычитая из последней величины найденное количество связанной углекислоты, получают количество агрессивной СО2, содержащейся в 1 л воды.
Пример. На опыте установлено, что вода из артезианской скважины содержит 4,70 мг-экв/л гидрокарбонатного иона и 50 мг/л СО2. Определить количество агрессивной углекислоты.
Решение. 1. Определим содержание в воде связанной углекислоты:
4,70x22= 103,4 мг/л.
Определим сумму свободной и связанной углекислоты (5):
103,4 + 50 = 153,4 мг/л.
Находим в графе 5 цифру 153 и соответствующее ей значение суммы связанной и агрессивной углекислоты в графе G— 114,7.
Вычитая из 114,7 количество связанной углекислоты, получим количество агрессивной:
х = 114,7 — 103,4 = 11,3 мг/л.
Следовательно, в испытуемой воде содержится 11,3 мг/л агрессивной углекислоты.
72. Индекс насыщения воды карбонатом кальция
Характеристику стабильности воды определяют по индексу насыщения I ее карбонатом кальция. Для этого используются номограммы, по которым определяют значение функции от заданных величин.
При заданных концентрациях: иона кальция (Са2+, мг/л), щелочности воды (Щ, мг-экв/л), общего солесодержания (Р, мг/л) и определенной температуре (t) испытуемой воды — находят с помощью номограммы значение функции от этих аргументов и определяют расчетным путем значение pHs, соответствующее равновесному состоянию системы в этих условиях по формуле: рHs= f1(t)- f2 (Са2+) – f3 (Щ) + f4 (Р)
Затем, производя сравнение опытного значения рН0 этой воды с расчетным pHs, находят индекс насыщения: I=рН0—pHs. Вода считается стабильной, если индекс насыщения I равен нулю. При положительном значении I вода склонна к отложению карбоната кальция на стенках аппаратуры. При отрицательном значении индекса насыщения вода агрессивна по отношению к металлу и бетону, поэтому ее подвергают дополнительной обработке — стабилизации.
Пример. Установлено, что в воде при t= 10° С и рН 7 содержится 50 мг/л иона кальция, 300 мг/л солей, а щелочность воды 2 мг-экв/л. Рассчитать индекс стабильности.
Решение. По номограмме находим значение функции заданных величин и рассчитываем pHs = 2,35—1,7—1,3+8,81 =8,16. Тогда I=рН0—pHs=7,0—8,16=- 1,16. Вода агрессивна, в ней количество свободной углекислоты превышает равновесную. Требуется проводить ее стабилизацию.
73. Особенности химического состава бытовых и производственных сточных вод
Бытовые сточные воды образуются при приготовлении пищи, мытья посуды, уборки помещения, из санитарных узлов, прачечных, ванн и бань. Эти воды представляют собой неустойчивую полидисперсную систему, частицы которой по своим размерам колеблются от грубых до высокодисперсных (молекулы и ионы). Минеральные соединения в бытовых сточных водах представлены солями аммония, фосфатами, хлоридами, гидрокарбонатами и другими соединениями, образующимися в результате жизнедеятельности человека и разложения органических веществ. Бытовые сточные воды имеют обычно слабощелочную реакцию среды (рН 7,2—7,8). Минеральные и органические примеси в воде могут в зависимости от степени дисперсности находиться во взвешенном, коллоидном и растворенном состояниях. Органические вещества бытовых сточных вод можно разделить на две группы: 1) безазотистые, содержащие углерод, водород и кислород; 2) азотсодержащие вещества. Основная часть безазотистых органических примесей бытовых сточных вод представлена углеводами и жирами. В бытовых сточных водах могут содержаться в небольших количествах и другие безазотистые органические соединения (кислоты, спирты, альдегиды, кетоны и т. п.). Компонентами являются такие полисахариды, как целлюлоза и крахмал. Азотсодержащие органические соединения представлены в бытовых сточных водах белками и продуктами их гидролиза — пептидами и аминокислотами. активной частью являются поверхностно-активные вещества, они стали постоянным компонентом бытовых сточных вод. Бактериальное население бытовых сточных вод представлено микроорганизмами, живущими в организме человека и животных, бактериями, разлагающими органические вещества.
Концентрация
загрязнений в бытовой воде:
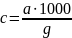
где а — количество загрязнений данного вида, приходящееся на 1 чел. в сутки; g— норма водоотведения на 1 чел. в сутки; 1000—коэффициент перехода от граммов к миллиграммам.
Производственные сточные воды в основном загрязнены отходами и выбросами производства. Количественный и качественный состав таких стоков разнообразен и зависит от отрасли промышленности, ее технологических процессов. По составу сточные воды делят на три основные группы, содержащие:
• неорганические примеси (в том числе токсические); • органические примеси;
• неорганические и органические загрязняющие примеси.
К первой группе относятся сточные воды содовых, сульфатных, азотно-туковых заводов, обогатительных фабрик свинцовых, цинковых, никелевых руд и т. д., в которых содержатся кислоты, щелочи, ионы тяжелых металлов и др. Сточные воды второй группы сбрасывают нефтеперерабатывающие и нефтехимические заводы, предприятия органического синтеза, коксохимические и др. В стоках содержатся различные нефтепродукты, аммиак, альдегиды, смолы, фенолы и другие вредные вещества. Сточные воды третьей группы образуются в процессах гальванохимической обработки поверхностей, производстве печатных плат электронной техники, в коксохимических и других технологических процессах. В составе этих стоков присутствуют неорганические кислоты, ионы тяжелых металлов, ПАВ, масла, красители, смолы и другие вещества. Фенол содержится в сточных водах многих нефтехимических предприятий и коксохимических производств. При этом резко снижаются биологические процессы водоемов, процесс их самоочищения, вода приобретает специфический запах карболки.
74.Санитарно-химический анализ сточных вод
В водах, поступающих на канализационную очистную станцию, определяются: 1) температура; 2) окраска; 3) запах; 4) прозрачность по шрифту; 5) рН; 6) осадок по объему в цилиндрах Лисенко через 5, 10, 15, 30, 60 и 120 мин; 7) относительная стабильность по обесцвечиванию метиленовой сини; 8) взвешенные вещества с делением их на летучую (при t=900—1000° С) и нелетучую части;
9) сухой остаток также с делением на летучую и нелетучую части;10)БПК5, БПКполн;, П) общая кислотность и щелочность воды при титровании с различными индикаторами; 12) частичная окисляемость (по КМп04); 13) химическое потребление кислорода (ХПК).
Относительная стабильность сточных вод. Относительной стабильностью или стойкостью сточных вод называется отношение запаса кислорода в воде к БПКполн этих сточных вод. Относительную стабильность выражают в %. За показатель относительной стабильности принимают время, необходимое для использования содержащегося а воде кислорода в присутствии метиленовой сини как индикатора.
Перед определением стойкости в сточных водах нейтрализуют свободную кислоту или щелочность по бромтимолблау и удаляют другие бактерициды; затем вводят в нее микрофлору сточной жидкости. Подготовленную таким образом пробу переносят в склянку емкостью 150 мл, добавляют 0,4 мл метиленовой сини (концентрация 0,5 г на 1 л жидкости), тщательно перемешивают, заполняют до -краев сточной жидкостью, закрывают стеклянным колпачком с водяным затвором, снова перемешивают и помещают в термостат, отрегулированный на температуру 20° С.
Число суток, прошедшее до момента обесцвечивания жидкости в пробе,является сроком начала загрязнения этой жидкости.Относительную стабильность сточных вод для t=20° С рассчитывают по следующей формуле:s = (1 -0,794 τ) 100,где s — относительная стабильность или стойкость сточной жидкости, %;τ— количество суток, в течение которых израсходован весь кислород (срок начала загнивания).
БПК сточных вод. Различают БПКб и БПКполн— это количество кислорода (мг/л), расходуемое на биохимические процессы в течение 5 суток. БПКполн — это количество кислорода (мг/л), расходуемое на биохимические процессы до наступления реакции нитрификации.
биохимические
процессы связаны с жизнедеятельностью
микроорганизмов, которые расходуют
кислород на получение энергии для
поддерживания жизненных процессов и
роста клеточных веществ. Схематически
эти процессы можно выразить
уравнениями:СxHyOzN+(x+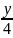 -
-
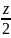 -
- )O2
)O2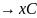 O2+(
O2+(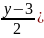 H2O+NH3+Qккал
H2O+NH3+Qккал
Коэффициенты перед кислородом означают; х — на один атом углерода расходуется одна молекула кислорода; у — на один атом водорода расходуется 1/4 молекулы кислорода; содержащийся в соединении кислород не входит в величину БПК, его вычитают; каждый атом составляет половину молекулы кислорода (z/2): азот восстанавливается до аммиака с затратой трех атомов водорода, что соответствует уменьшению количества кислорода еще на 3/4 молекулы.При синтезе клеточных веществ протекает примерно следующий процесс:
СxHyOzN+
NH3
+O2 С5H8O2N+(x-5)CO2+Qккал
С5H8O2N+(x-5)CO2+Qккал
где СxHyOzN — среднее соотношение основных элементов в клеточном веществе бактерий.
Суммарное количество кислорода, израсходованное при этих процессах, и отвечает величине БПКполн
Определение БПК производится несколькими методами.
Стандартный метод разбавления используется для характеристик и БПК сильно загрязненных вод.
Метод определения БПКполн производственных сточных вод, которые трудно поддаются биохимическому окислению.
Определение БПК методом продувания кислорода предназначен для анализа сильно загрязненных природных поверхностных вод с низкой концентрацией кислорода.
Определение константы Скорости БПКполн Процесс биохимического потребления кислорода (БПК) бытовых сточных вод подчиняется закону реакции 1-го порядкаv=kc, где v— скорость реакции; с — концентрация реагирующего вещества; к— коэффициент пропорциональности или константа скорости химической реакции. Кинетическое уравнение реакции 1-го порядка имеет следующий вид:
k=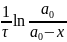
где
к
—
константа скорости химической
реакции; -начальная
концентрация
вещества, моль/л; х
—
концентрация вещества, прореагировавшая
к моменту времени τ,
моль/л; (
—х)—концентрация
оставшегося вещества к моменту времени
τ,
моль/л; τ
— время, сут.
-начальная
концентрация
вещества, моль/л; х
—
концентрация вещества, прореагировавшая
к моменту времени τ,
моль/л; (
—х)—концентрация
оставшегося вещества к моменту времени
τ,
моль/л; τ
— время, сут.
k=(1/τ)∙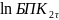 /(
/( )
)
Затем, переходя от натурального логарифма к десятичному, определяют БПКполн:БПКполн=БПК τ / 1-10-k'τ
Химическая потребность в кислороде (ХПК). Химической потребностью в кислороде называется его количество, необходимое для полного окисления всех восстановителей (органического и неорганического происхождения), находящихся в воде. Количественное определение ХПК данной сточной воды производят сжиганием примесей сильными окислителями (двухромовокислым калием или иодатом калия) в кислой среде. В этих условиях все элементы окисляются: углерод до С02, сера до 503, фосфор до Р205) водород до Н20, только не учитывается кислород, расходуемый на окисление
Если в сточной воде содержатся только органические вещества и состав и количество загрязнений известно, то ХПК можно рассчитать по стехиометрйче-ским уравнениям. По величине ХПК характеризуют главным образом производственные сточные воды, содержащие органические вещества. ХПК всегда больше БПКполн
Удаление взвешенных веществ.
