
- •Химический состав и строение молекулы воды.
- •Водородные взаимодействия.
- •Агрегатные состояния воды.
- •Аномалии воды.
- •Химические свойства воды.
- •Свойства растворов
- •6. Физико-химические свойства растворов неэлектролитов и электролитов.
- •7. Свойства растворов слабых электролитов.
- •Ионные равновесия
- •8. Растворимость веществ в воде.
- •10. Диссоциация воды.
- •11. Ионное произведение воды
- •12. Буферные растворы и их свойства
- •13. Гидролиз солей
- •14. Количественные характеристики гидролиза
- •15. Понятие о системах, фазах, компонентах.
- •16. Диаграмма состояния воды
- •17. Окислители и восстановители
- •18. Типы окислительно-восстановительных реакций
- •19. Окислительно-восстановительные потенциалы
- •20. Окислительно-восстановительные свойства воды
- •Классификация дисперсных систем.
- •Методы получения дисперсных систем.
- •Строение коллоидной частицы.
- •Свойства коллоидных систем.
- •Электрокинетические явления.
- •26.Причины устойчивости коллоидных систем
- •27. Разрушение дисперсных систем
- •28. Поверхностное натяжение
- •29. Поверхностно активные вещества
- •Поверхностные явления
- •30. Адсорбция равновесия
- •34 Особенности химического состава природных вод
- •36. Понятие об обобщённых оценочных показателях качества воды.
- •37. Химические показатели качества воды
- •40. Отстаивание.
- •41. Осаждение
- •42. Фильтрование воды
- •43. Флотация и электрофлотация
- •44. Коагуляция
- •45. Зависимость выбора оптимальных условий обработки различными коагулянтами от качества воды
- •46. Электрокоагуляция, эффективность использования
- •47. Флокулянты (анионо- и катионоактивные) их природа, свойства и методы действия, выбор оптимальной дозы.
- •48. Хлорирование: хлорирующие реагенты; механизм обеззараживающего действия, хлороёмкость воды в отсутствии и присутствии солевого аммиака.
- •56. Жесткость воды
- •57. Единицы измерения жесткости
- •58. Методы реагентного умягчения воды, их эффективность, контроль процессов реагентного умягчения.
- •59. Умягчения воды методом ионного обмена
- •60. Иониты (катиониты и аниониты), их природа, строение, свойства.
- •61. Термический метод умягчения воды.
- •62. Импфирование (подкисление)
- •63. Опреснение воды
- •64. Электрохимический метод.
- •66. Методы удаления из воды соединений железа и марганца
- •67.Удаление кремниевой кислоты
- •68.Обесфторирование и фторирование воды.
- •69. Не нашли этот вопрос
- •70. Углекислота и ее формы.
- •71. Вычисление содержания агрессивной углекислоты с помощью таблицы
- •72. Индекс насыщения воды карбонатом кальция
- •73. Особенности химического состава бытовых и производственных сточных вод
- •75Отстаивание, удаление масел и нефти
- •76.Коагулирование сточных вод.77.Выбор и подготовка коагулянтов.
- •78) Флотация сточных вод.
- •79) Сорбция.
- •80) Сорбция – область использования, факторы, влияющие на выбор сорбентов.
- •81) Экстракция, требования, предъявляемые к экстрагентам, экстракция в противотоке.
- •82.Эвапорация и аэрация.
- •83. Области использования аэрации и эвапорации, контроль процессов.
- •85. Нейтрализация сточных вод
- •84. Радиационнаяочистка сточных вод от органических загрязнений.
- •87.Химич очистка сточных вод
- •86.Дезинфекция сточных вод
- •88.Химическое окисление под давлением
- •89.Кристаллизация.
48. Хлорирование: хлорирующие реагенты; механизм обеззараживающего действия, хлороёмкость воды в отсутствии и присутствии солевого аммиака.
Обеззараживание – это процесс обработки воды для полного удаления патогенных и снижение общего количества микроорганизмов. Осуществляется как физическими, так и химическими методами. Оно считается эффективным, если в течение 30 дней превышения обнаружены менее чем в 85 % проб.
Хлорирующие реагенты.
Хлор и хлорсодержащие вещества применяются для обеззараживания сточных вод, удаления запахов, уничтожения водорослей в охлаждающих установках. Хлор также предупреждает вспенивание жира и масла в ловушках, уничтожает личинки мух на биофильтрах, участвует в обезвреживании ядовитых веществ.
Механизм бактерицидного действия хлора заключается в его взаимодействии с составными частями клетки микроорганизма (в 1-ю очередь с ферментами).
При выборе дезинфицирующего средства необходимо учитывать содержание в нём «активного» хлора. «Активным» называется количество молекул хлора, отвечающего за окислительные способности данного соединения относительно йодида калия в кислой среде:

где
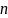 - количество гипохлорит анионов (
- количество гипохлорит анионов ( );
);
 - молекулярная масса хлорсодержащего
вещества;
- молекулярная масса хлорсодержащего
вещества;
 - молекулярная масса хлора.
- молекулярная масса хлора.
Наиболее распространённым методом обеззараживания является обработка сточных вод газообразным хлором или его кислородными соединениями (гипохлоритами кальция или натрия, хлорной известью или оксидом хлора).
Хлор можно непосредственно добавлять к воде или использовать хлорную воду (раствор хлора в воде):

где
 - хлорноватистая кислота
- хлорноватистая кислота

Из-за высокого потенциала полуреакции:

Окислительными
свойствами являются хлорноватистая
кислота, содержание которой уменьшается
при увеличении рН, т.к. увеличивается
содержание ионов
 .
.
Для небольших количеств сточных вод используется хлорная известь с содержанием активного хлора 25-35%. Хлорная известь – белый гигроскопичный порошок с характерным запахом. Под действием углекислого газа и влаги воздуха она разлагается:

Кроме
обеззараживающего действия хлорная
известь коагулирует взвешенные вещества
сточных вод из-за образовавшегося
гидроксида
 .
Во избежание потерь активности хлорную
известь хранят и транспортируют в
закрытые тары.
.
Во избежание потерь активности хлорную
известь хранят и транспортируют в
закрытые тары.
В
последние годы вместо хлорной извести
стали использовать гипохлорит кальция
 ,
с содержанием активного хлора 50-60 %.
,
с содержанием активного хлора 50-60 %.
При вдыхании частиц наблюдается раздражение дыхательных путей. При контакте – раздражение глаз и кожи.
Т.к. вещество взрывоопасно, недопустимо его загрязнение органическими веществами и маслами.
Диоксид
хлора
 - газ зеленовато-жёлтого цвета с резким
запахом. более эффективен, чем хлор, но
дорого стоит.
- газ зеленовато-жёлтого цвета с резким
запахом. более эффективен, чем хлор, но
дорого стоит.
Для обеззараживания воды в пылевых условиях и в локальных установках принимаются органические хлорамины. Гидролиз хлораминов происходит медленнее, чем неорганических веществ, поэтому обеззараживающее действие сохраняется дольше.
Хлороёмкость воды.
Хлороёмкость (хлорпоглощаемость) воды – общее количество хлора, которое расходуется на взаимодействие с окисляющимися примесями.
Обеззараживающее действие реагента определяет окислительным потенциалом и способностью взаимодействовать с клетками микроорганизмов. Также зависит от рН и температуры воды.
Хлороёмкость зависит от наличия органических и неорганических примесей, температуры, рН, наличия взвешенных и коллоидных примесей.
Хлор активно взаимодействует с азотсодержащими примесями, аммиаком, соединениями железа 2-ухвалентного, активно сорбируется со взвешенными веществами.
Количество хлора, добавляемого к воде, должно быть таким, чтобы после 30-минутного контакта с водой количество остаточного активного хлора было равно 9,5 мг/л.
при концентрации активного хлора до 1 мг/л хлороёмкость пропорциональна времени контакта. При большей концентрации наблюдается логарифмическая зависимость.
Хлороёмкость сильно повышается, если имеется солевой аммиак.
Во избежание образования хлорофинольных запахов и привкусов, при хлорировании речной воды хлорирование сочетают с аммонизацией (введение аммиака либо солей аммония):




Количество хлора, необходимое для разрушения образовавшихся хлораминов, должно в 10-20 раз превышать концентрацию аммиака.
В зависимости от времени введения хлора, различают:
предварительное хлорирование (предхлорирование)
постхлорирование, завершающее процесс обеззараживания
В 1-ом случае дозы хлора повышенные, во 2-ом дозы хлора строго регламентируются.
В зависимости от количества добавляемого хлора:
нормальное хлорирование
перехлорирование
Иногда осуществляют дехлорирование (убирают избыточный хлор) физическим или химическим способами.
В качестве химических реагентов используются:



Физико-химический метод основан на сорбции соединений хлора с активированным углём. Десорбцию осуществляют горячим раствором NaOH.
Недостатки:
развитие хлоррезистентной микрофлоры
образование токсичных хлорорганических соединений
на крупных и средних очистных сооружениях необходимо обеспечивать высокую степень безопасности хлорного хозяйства
даже небольшие количества остаточного хлора токсичны для микрофауны водоёмов, что приводит к практически полному прекращению самоочищения водоёмов.
49-50. Озонирование
Местом основания технологии является Франция. В 1997 г. был отмечен 100-летний юбилей эффективного использования озона. Активно расширяется использование озона в США (для обработки сточных вод), Японии и др. странах.
Озон представляет собой аллотропическое видоизменение кислорода, при обычных условиях газообразное вещество голубоватого цвета, в жидком – тёмно синее, в твёрдом – почти чёрное.
Озон – один из наиболее сильных окислителей. Он уничтожает бактерии, споры и вирусы.
Преимущества озона:
одновременно с обеззараживающим действием происходит обесцвечивание воды;
устраняются привкусы и запахи; улучшается вкус воды;
воды насыщается кислородом.
Озон получают при действии на кислород «тихого» электрического тока в аппаратах озонаторах, при напряжении более 10 кВт.
Озон получают непосредственно на очистных сооружениях, после чего озоновоздушную смесь растворяют в воде и порциями добавляют в обрабатываемую воду.
Бактерицидное действие связано с реакциями окисления. В реакции участвуют свободные радикалы, образовавшиеся при разложении озона.
Бактерицидное действие озона проявляется при концентрации больше 0,1 мг/л. При остаточной дозе 0,4 мг/л через 4 мин инактивируется 99,99% вирусов. Палочки гибнут при концентрации 2 мг/л, споры бактерий – больше 10 мг/л. Необходимое время контакта - 3÷10 мин. Доза подбирается экспериментально. Контроль ведётся по остаточному озону. Концентрация озона 0,05 – 0,1 мг/л обеспечивает бактерицидную активность озона в очищенной воде. При концентрации озона больше 3 мг/л в воде появляется ароматический запах.
При использовании озона на загрязнённой воде дозы значительно больше.
При озонировании необходимо снижение взвешенных веществ до 3-5 мг/л и БПК (биохимическое потребление кислорода) до 10 мг/л
Недостатки:
высокая стоимость;
образование токсичных побочных продуктов;
низкая растворимость и высокая взрывоопасность озона;
высокая коррозионная активность;
возможна новая волна микроорганизмов при неполном окислении органических веществ.
№51Перспективы использования йода, хлорида брома в качестве обеззараживающих реагентов.
В качестве галогеносодержащих реагентов применяются соединения брома и йода, обладающие более сильным, по сравнению с хлором, эффектом. Но получать их сложнее и дороже. Обычно соединения йода применяют в небольших системах водоснабжения и зонах распространения заболеваний щитовидной железы. Соединения брома широко используются для обеззараживания воды в бассейнах. Основной недостаток галогеносодержащих соединений - образование в воде при взаимодействии с примесями вредных продуктов, которые следует удалять.
Кроме соединений хлора, в практике обезвреживания сточных вод могут быть использованы соединения брома и йода, обладающие окислительной активностью. Несмотря на обилие литературы, имеются противоречивые сведения о бактерицидной активности данных галогенов. Высокими окислительными свойствами обладают межгалоидные соединения. Химическое поведение хлорида брома в воде сходно с поведением хлора. ВгСl в течение миллисекунд реагирует с водой, образуя гипобромовую кислоту, которая быстро соединяется с аммиаком, образуя при этом бромамины. Они далеко превосходят хлорамины в бактерицидной и противовирусной активности. В настоящее время препараты брома применяются для обеззараживания воды плавательных бассейнов, йод в качестве самостоятельного средства используется для обеззараживания воды в замкнутых системах, в частности, в системе жизнеобеспечения космических станций. Несмотря на перспективность использования соединений брома и йода для дезинфекции сточных вод, они не нашли широкого применения, с одной стороны, из-за высокой стоимости, с другой стороны - возможности образования йод- и бромпроизводных, обладающих токсичным действием и отдаленными эффектами.
№52 Олигодиномия, области применения
Олигодинамия (обеззараживание воды ионами серебра)
Обеззараживание воды серебром. Оно связано с процессом соединения ионов серебра с ферментными системами и оболочкой бактерий. Это достаточно нераспространенный способ обеззараживания воды бассейнов. Суть его состоит в том, что ионы тяжелых металлов (чаще всего серебра), введенные в обрабатываемую воду, взаимодействуют с протоплазмой клеток бактерий, приводя их к гибели вследствие нарушения метаболизма (обмена веществ). Этот способ вряд ли получит широкое распространение; кроме того, доказана токсичность ионов тяжелых металлов для человека.Однако в большинстве случаев такой способ дезинфекции обеспечивает более длительную защиту воды от образования бактерий,спор и грибков, а также не требует применения дополнительных средств, например от водорослей. Серебро – тяжелый металл, имеющий высокую степень опасности для здоровья (в одном ряду со свинцом, кобальтом, мышьяком и другими веществами). Для бактерицидного действия серебра требуются достаточно большие концентрации (около 0,015 мг/л, а при малых концентрациях (10-4…10-6 мг/л) оно оказывает только бактериостатическое действие, т.е. останавливает рост бактерий, не убивая их. Однако спорообразующие разновидности микроорганизмов к серебру практически нечувствительны. Если подобрать грамотно фильтр серебрения воды, то остаточное содержание растворённого в воде серебра не превысит 10-4…10-5 мг/л (при этом в контактном слое серебрения воды концентрации могут достигать значения 0,015 мг/л), что позволяет осуществлять одновременно бактерицидную и бактериостатическую обработку воды.
№53 Электрохимическое и безреагентное обеззараживание, достоинства и недостатки, области использования.
Безреагентное обеззараживание сточных вод.Безреагентное обеззараживание сточных вод предполагает обработку воды при помощи бактерицидного излучения, высоких температур, а также ультразвука. Безреагентное обеззараживание сточных вод редко применяется в качестве основной меры обеззараживания, так как ни одна технология безреагентного обеззараживания сточных вод не дает эффекта последействия, что приводит к повторному заражению воды.
Бактерицидные установки обеззараживания сточных вод.
Бактерицидные установки обеззараживания воды, представляют собой металлические корпусы с расположенными в них лампами ультрафиолетового излучения. Процесс обеззараживания сточных вод производится при пропускании воду через корпус, где вода подвергается непрерывному УФ облучению. Скорость подобного метода обеззараживание сточных вод крайне высока и поэтому подача очищенной воды из УФ фильтров осуществляется в бесперебойном режиме.
Обеззараживание сточных вод путем облучения воды ультрафиолетовыми лучами происходит с использованием способности ультрафиолетовых лучей проникать сквозь стенки клетки. Волны определенной длины воздействуют на нуклеиновые кислоты клетки, из которых состоит ДНК и РНК микроорганизма, «сшивая» их и лишая возможности разделиться, тем самым достигается эффект инактивации потенциально опасного микроорганизма.
Безреагентное обеззараживание обладает высокой эффективностью и низкой стоимостью эксплуатации.
Электрохимические методы очистки воды относятся к физико-химическим процессам очистки водных систем. Они отличаются многостадийностью и относительной сложностью происходящих в аппаратах водоочистки физико-химических явлений. Механизм и скорость протекания отдельных стадий зависят от многих факторов, выявление влияния и правильный учет которых необходимы для оптимального конструирования электролизеров и рационального ведения процессов очистки воды.
Электрохимические методы очистки промышленных сточных вод можно разделить на три основные группы: методы превращения, методы разделения и комбинированные методы.
1) Методы превращения обеспечивают изменение физико-химических и фазово-дисперсных характеристик загрязнений сточных вод с целью их обезвреживания и быстрого извлечения из стоков.
2) Методы разделения предназначены для концентрирования примесей в локальном объеме раствора без существенного изменения фазово-дисперсных или физико-химических свойств извлекаемых из сточных вод веществ.
3) К комбинированным методам электрохимической очистки сточных вод относятся методы, которые предполагают совмещение одного или нескольких методов превращения и разделения загрязнений стоков в одном аппарате.
Очистка сточных вод методом электрокоагуляции основан на их электролизе с использованием стальных или алюминиевых анодов, подвергающихся электролитическому растворению. В результате осуществляется процесс коагуляции, аналогичный обработке сточной воды солями железа и алюминия. Однако, по сравнению с реагентнымкоагулированием при электрохимическом растворении металлов не происходит обогащения воды сульфатами и хлоридами, содержание которых в воде лимитируется как при сбросе очищенных сточных вод в водоемы, так и при повторном использовании в системах промышленного водоснабжения.
Электрокоагуляционную очистку сточных вод можно использовать для очистки от эмульсий нефтепродуктов, масел, жиров (электрокоагулятор представляет собой ванну с электродами).
Метод работы электрокоагулятора заключается в образовании под действием проходящего электрического тока высокоактивных гидроксидов алюминия и железа, немедленно вступающих в реакцию с вредными примесями техногенного происхождения и не затрагивающих при этом естественный солевой состав обрабатываемой воды с последующим быстрым переходом связанных примесей и непрореагировавших реагентов в нерастворимый, химически-инертный, легкоотделяемый шлам.
Наряду с этим, прохождение электрического тока большой плотности через обрабатываемую воду, обусловливает высокую бактерицидную эффективность процесса. Это происходит потому что из за разрыва связей высвобождаются химические элементы (их соединения) и ионы кислорода. Высвободившийся кислород в свою очередь (в дополнение к кислороду, образующемуся на аноде) не только насыщает воду ионами кислорода, но и является одной из мощных составляющих по обеззараживанию воды.
Достоинства .метода электрокоагуляции заключаются в компактность установок и простота управления, отсутствие потребности в реагентах, малая чувствительность к изменениям условий проведения процесса очистки (температура, рН среды, присутствие токсичных веществ), получение шлама с хорошими структурно-механическими свойствами.
Недостатком электрокоагуляции является повышенный расход металла и электроэнергии, малая производительность, образование большого объема вторичных отходов (шламов), а в некоторых случаях токсичных реагентов. Поэтому я не рекомендую использовать этот метод для бытовой очистки воды.
№54 Химические и физико-химические методы удаления газов
Дегазация - процесс удаления из воды растворенных в ней газов (углекислый газ, кислород, сероводород, хлор, реже метан) обуславливающих или усиливающих коррозионные свойства воды, придающие ей неприятный запах. Выбор метода дегазации определяется в основном видом и содержанием удаляемого газа в исходной воде.
Существуют физические(изменение температуры воды или парциального давления удаляемого газа; отдувка или аэрация) и химические(связывание растворенных газов путем добавления реагентов) методы удаления газов из воды.
Физические методы удаления из воды растворенных газов могут осуществляться двумя способами: 1) вода, содержащая удаляемый газ, приводится в соприкосновение с воздухом, если парциальное давление удаляемого газа в воздухе близко к нулю; 2) создаются условия, прл которых растворимость газа в воде становится близкой к нулю.При помощи первого способа, т. е. при помощи аэрации воды, обычно удаляются свободная углекислота и сероводород, поскольку парциальное давление этих газов в атмосферном воздухе близко к нулю.
Ко второму способу обычно приходится прибегать при удалении кислорода из воды, так как при значительном парциальном давлении кислорода в атмосферном воздухе аэрацией воды кислород из нее удалить нельзя. Для удаления из воды кислорода ее доводят до кипения, при котором растворимость всех газов в воде падает до нуля
Удаление газов из воды химическими методами осуществляется путем связывания газов различными материалами. Например, при фильтровании воды через слой стальных стружек кислород связывается металлом
ЗFе+2O2=Fе3O4
Для удаления остаточного кислорода после деаэрации питательной воды применяют сильные восстановители; Na2О3 (сульфит натрия) и N2Н4 • Н2О (гидразин гидрат).
химический способ обескислороживания воды является наиболее совершенным, но и наиболее дорогим. Поэтому этот способ применения в основном для окончательного удаления кислорода из воды после физических методов ее обескислороживания.
Примером химического метода удаления из воды сероводорода может служить обработка воды хлором:
а) с окислением до серы:
HJS + C12-»-S + 2HC1;
б) с окислением до сульфатов:
H2S + 4С12 + 4Н2О -> H2SO4 + 8HC1
Химическим методам удаления газов из воды свойственны следующие недостатки:
а) необходимость применения реагентов, усложняющих и удорожающих процесс обработки воды;
б) возможность ухудшения качества воды при нарушении дозировки реагентов.
Вследствие этого химические методы удаления газов из воды применяются значительно реже физических.
№55Устранение привкусов и запахов воды методами прехлорирования и преаммонизации.
Содержащиеся в воде природных источников различные вещества, а также микроорганизмы могут придавать ей неприятные запахи и привкусы, ухудшающие качество воды и препятствующие использованию ее для питьевых целей.
Весьма часто наличие запахов и привкусов в природной воде обусловливается выделением в результате жизнедеятельности и отмирания находящихся в воде микроорганизмов и водорослей пахнущих веществ. Для борьбы с этими запахами и привкусами можно применять хлорирование. Малые дозы хлора, вызывая отмирание микроорганизмов, могут увеличить запах; лишь увеличенные дозы хлора, достаточные для окисления органических веществ и микроорганизмов, приводят в некоторых случаях к уничтожению запахов и привкусов.
Если хлорирование воды проводится для целей обеззараживания, то уничтожение запахов и привкусов, имеющихся в природной воде, может быть проведено попутно. Однако при назначении дозы хлора должно быть учтено и количество его, необходимое для окисления микроорганизмов.
Для борьбы с запахами и привкусами, которые вызываются наличием в воде микроорганизмов, применяют также метод сорбционного фильтрования. Воду фильтруют через слой активированного угля, который сорбирует вещества, дающие запахи и привкусы. Объем загрузки фильтра из активированного угля в этом случае составляет 0,06—0,12 м3 на 1 м3/ч фильтруемой воды.
Для тех же целей применяют порошкообразный активированный уголь, который вводят в воду в количестве от 1 до 5 мг/л или непосредственно перед фильтрами, или частично в смеситель и частично перед фильтрами. Опыты показали, что введение всего угля перед фильтрами значительно сокращает его расход. При периодическом появлении в природной воде запахов и привкусов применение угольного порошка имеет экономические преимущества по сравнению с фильтрованием воды на угольных фильтрах.
Наконец, уничтожению привкусов и запахов природной воды может способствовать введение в нее перманганата калия (0,1—2 мг/л).
Запахи и привкусы в воде могут быть вызваны наличием в ней не только микроорганизмов или органических веществ, но и некоторых неорганических веществ, например сероводорода и железа. Уничтожение этих запахов и привкусов производят одновременно с очисткой воды от этих веществ при ее обезжелезивании и удалении сероводорода
