
- •Химический состав и строение молекулы воды.
- •Водородные взаимодействия.
- •Агрегатные состояния воды.
- •Аномалии воды.
- •Химические свойства воды.
- •Свойства растворов
- •6. Физико-химические свойства растворов неэлектролитов и электролитов.
- •7. Свойства растворов слабых электролитов.
- •Ионные равновесия
- •8. Растворимость веществ в воде.
- •10. Диссоциация воды.
- •11. Ионное произведение воды
- •12. Буферные растворы и их свойства
- •13. Гидролиз солей
- •14. Количественные характеристики гидролиза
- •15. Понятие о системах, фазах, компонентах.
- •16. Диаграмма состояния воды
- •17. Окислители и восстановители
- •18. Типы окислительно-восстановительных реакций
- •19. Окислительно-восстановительные потенциалы
- •20. Окислительно-восстановительные свойства воды
- •Классификация дисперсных систем.
- •Методы получения дисперсных систем.
- •Строение коллоидной частицы.
- •Свойства коллоидных систем.
- •Электрокинетические явления.
- •26.Причины устойчивости коллоидных систем
- •27. Разрушение дисперсных систем
- •28. Поверхностное натяжение
- •29. Поверхностно активные вещества
- •Поверхностные явления
- •30. Адсорбция равновесия
- •34 Особенности химического состава природных вод
- •36. Понятие об обобщённых оценочных показателях качества воды.
- •37. Химические показатели качества воды
- •40. Отстаивание.
- •41. Осаждение
- •42. Фильтрование воды
- •43. Флотация и электрофлотация
- •44. Коагуляция
- •45. Зависимость выбора оптимальных условий обработки различными коагулянтами от качества воды
- •46. Электрокоагуляция, эффективность использования
- •47. Флокулянты (анионо- и катионоактивные) их природа, свойства и методы действия, выбор оптимальной дозы.
- •48. Хлорирование: хлорирующие реагенты; механизм обеззараживающего действия, хлороёмкость воды в отсутствии и присутствии солевого аммиака.
- •56. Жесткость воды
- •57. Единицы измерения жесткости
- •58. Методы реагентного умягчения воды, их эффективность, контроль процессов реагентного умягчения.
- •59. Умягчения воды методом ионного обмена
- •60. Иониты (катиониты и аниониты), их природа, строение, свойства.
- •61. Термический метод умягчения воды.
- •62. Импфирование (подкисление)
- •63. Опреснение воды
- •64. Электрохимический метод.
- •66. Методы удаления из воды соединений железа и марганца
- •67.Удаление кремниевой кислоты
- •68.Обесфторирование и фторирование воды.
- •69. Не нашли этот вопрос
- •70. Углекислота и ее формы.
- •71. Вычисление содержания агрессивной углекислоты с помощью таблицы
- •72. Индекс насыщения воды карбонатом кальция
- •73. Особенности химического состава бытовых и производственных сточных вод
- •75Отстаивание, удаление масел и нефти
- •76.Коагулирование сточных вод.77.Выбор и подготовка коагулянтов.
- •78) Флотация сточных вод.
- •79) Сорбция.
- •80) Сорбция – область использования, факторы, влияющие на выбор сорбентов.
- •81) Экстракция, требования, предъявляемые к экстрагентам, экстракция в противотоке.
- •82.Эвапорация и аэрация.
- •83. Области использования аэрации и эвапорации, контроль процессов.
- •85. Нейтрализация сточных вод
- •84. Радиационнаяочистка сточных вод от органических загрязнений.
- •87.Химич очистка сточных вод
- •86.Дезинфекция сточных вод
- •88.Химическое окисление под давлением
- •89.Кристаллизация.
Ионные равновесия
8. Растворимость веществ в воде.
Мера растворимости – способность вещества растворяться в воде при данных условиях с образованием насыщенного раствора.
Насыщенный раствор – раствор, находящийся в равновесии с растворенным веществом при данных условиях, содержащий максимальное количество растворенного вещества.
Концентрированный раствор – раствор, в котором находится более 20% растворенного вещества.
Раствор может быть концентрированным, но не насыщенным.
Растворимость зависит от:
Природы растворяемого вещества и растворителя
Правила: подобное растворяется в подобном; полярные вещества растворяются в полярных растворителях, а неполярные – в неполярных растворителях.
Если молекула газа способна образовывать химические связи с водой, то растворимость этого газа высока:
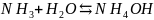
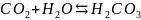
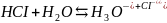
Агрегатное состояние и наличие посторонних веществ
Посторонние вещества уменьшают растворимость веществ в воде - высаливание.
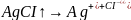
Температура
Растворимость газа при высоких температурах уменьшается. Растворимость твердых веществ зависит от теплового эффекта растворителя: если теплота выделяется при повышении температуры, то растворимость уменьшается; если поглощается при повышении температуры, растворимость увеличивается.
Влияние давления
С увеличением давления растворимость увеличивается. Если над раствором содержится смесь газов, то их растворимость прямопропорциональна парциальному давлению каждого газа.
Закон Генри-Дальтона:
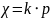
где
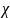 – молярная доза вещества в насыщенном
растворе, k
–
постоянная Генри, p
– порциальное давление газов.
– молярная доза вещества в насыщенном
растворе, k
–
постоянная Генри, p
– порциальное давление газов.
9. Произведение растворимости
Произведение растворимости – количественный показатель степени нерастворимости солей и гидроксидов.
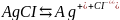
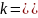
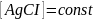
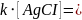
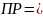 – постоянная
при данной температуре
– постоянная
при данной температуре
Если произведение концентрации ионов (ПК) будет меньше ПР, то раствор ненасыщенный и осадка нет. Если ПК больше ПР, то выпадает осадок и раствор перенасыщен. Если то раствор насыщен.
10. Диссоциация воды.
Вода является слабым электролитом.
Диссоциация воды - разложение воды на составляющие химические элементы, иногда происходящая с созданием новых элементов, изначально в разлагаемом растворе не содержащихся, или содержащихся до начала разложения в меньшем количестве, чем после завершения процесса диссоциации.
Диссоциация воды является эндотермической реакцией, т.е. идущей с поглощением теплоты из окружающей среды.
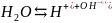
При

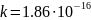
11. Ионное произведение воды
Кw [Н2О] = [Н+] [ОН-] = 10-14 при 25°С – ионное произведение воды
рН= -lg [H+]
рОН= -lg [ОH-]
рОН= 14 – рН
[H+] = [ОH-], то рН=7 – среда нейтральная
[H+] > [ОH-], то рН<7 – кислая среда
12. Буферные растворы и их свойства
Присутствие в растворе смеси слабой кислоты с ее солью как бы регулирует концентрацию ионов Н+ и ОН- в нем, уменьшая влияние факторов, изменяющих рН раствора. Подобные смеси получили название регуляторов или буферных смесей.
Свойства буферных растворов.
1. Концентрация водородных ионов в буферных растворах не зависит от разбавления. Этим свойством буферных растворов пользуются в тех случаях, когда желают получить смесь с постоянным значением рН.
2. Концентрация водородных ионов буферных растворов мала изменяется от прибавления кислот и оснований.
Но при добавлении кислоты и основания следует помнить, что количество их не должно превышать половины концентрации соли или кислоты, образующих буфер. В противном случае емкость буфера будет превышена и рН может измениться.
Чаще всего буферные смеси готовятся:
а) из слабых кислот и их солей (СНзСООН и СНзСООNа);
б) из слабых оснований и их солей (NH4OH и NH4CI);
в) из кислых солей многоосновных кислот (NаН2РО4 и Na2HP04).
Буферные смеси играют большую роль в процессах, протекающих в живых организмах и в неживой природе. Примером природного буферного раствора является кровь млекопитающих, так как з ней всегда содержится свободная угольная кислота и углекислый натрий. Благодаря этому буферу рН крови у млекопитающих имеет постоянное значение в пределах 7,4—7,7. Буферность почв имеет большое значение для сельского хозяйства, так как растения, потребляя внесенные в почву искусственные удобрения, изменяют концентрацию водородных ионов питающего их почвенного раствора в невыгодную для себя сторону. Нарушение буферности почвы зызывает гибель полезных микроорганизмов в почве.
Буферные растворы имеют громадное значение при работе очистных сооружений бытовых стоков, так как комплекс микроорганизмов, минерализующих органическое вещество, лучше развивается при нейтральной реакции среды. Всякое отклонение в кислую или щелочную сторону тормозит процесс жизнедеятельности микрофлоры, а следствием этого является ухудшение работы очистных сооружений.
Буферные смеси имеют большое значение при химической очистке воды от взвесей методом коагулирования. Чем выше буферная емкость коагулируемой воды, тем успешнее протекает ее очистка гидролизующимся коагулянтом. Буферная емкость природных вод водоемов обусловливает их нейтрализующие свойства.
Буферные смеси широко используются в объемном анализе, например, с помощью аммиачного буфера (NH4OH + NH4CI) определяют содержание в воде иоров кальция и магния (трилономет- рический метод). С помощью буферных смесей определяют также рН раствора — колориметрически (по окраске) и лотенциометри- Wckh (измерением ЭДС).
