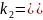- •Химический состав и строение молекулы воды.
- •Водородные взаимодействия.
- •Агрегатные состояния воды.
- •Аномалии воды.
- •Химические свойства воды.
- •Свойства растворов
- •6. Физико-химические свойства растворов неэлектролитов и электролитов.
- •7. Свойства растворов слабых электролитов.
- •Ионные равновесия
- •8. Растворимость веществ в воде.
- •10. Диссоциация воды.
- •11. Ионное произведение воды
- •12. Буферные растворы и их свойства
- •13. Гидролиз солей
- •14. Количественные характеристики гидролиза
- •15. Понятие о системах, фазах, компонентах.
- •16. Диаграмма состояния воды
- •17. Окислители и восстановители
- •18. Типы окислительно-восстановительных реакций
- •19. Окислительно-восстановительные потенциалы
- •20. Окислительно-восстановительные свойства воды
- •Классификация дисперсных систем.
- •Методы получения дисперсных систем.
- •Строение коллоидной частицы.
- •Свойства коллоидных систем.
- •Электрокинетические явления.
- •26.Причины устойчивости коллоидных систем
- •27. Разрушение дисперсных систем
- •28. Поверхностное натяжение
- •29. Поверхностно активные вещества
- •Поверхностные явления
- •30. Адсорбция равновесия
- •34 Особенности химического состава природных вод
- •36. Понятие об обобщённых оценочных показателях качества воды.
- •37. Химические показатели качества воды
- •40. Отстаивание.
- •41. Осаждение
- •42. Фильтрование воды
- •43. Флотация и электрофлотация
- •44. Коагуляция
- •45. Зависимость выбора оптимальных условий обработки различными коагулянтами от качества воды
- •46. Электрокоагуляция, эффективность использования
- •47. Флокулянты (анионо- и катионоактивные) их природа, свойства и методы действия, выбор оптимальной дозы.
- •48. Хлорирование: хлорирующие реагенты; механизм обеззараживающего действия, хлороёмкость воды в отсутствии и присутствии солевого аммиака.
- •56. Жесткость воды
- •57. Единицы измерения жесткости
- •58. Методы реагентного умягчения воды, их эффективность, контроль процессов реагентного умягчения.
- •59. Умягчения воды методом ионного обмена
- •60. Иониты (катиониты и аниониты), их природа, строение, свойства.
- •61. Термический метод умягчения воды.
- •62. Импфирование (подкисление)
- •63. Опреснение воды
- •64. Электрохимический метод.
- •66. Методы удаления из воды соединений железа и марганца
- •67.Удаление кремниевой кислоты
- •68.Обесфторирование и фторирование воды.
- •69. Не нашли этот вопрос
- •70. Углекислота и ее формы.
- •71. Вычисление содержания агрессивной углекислоты с помощью таблицы
- •72. Индекс насыщения воды карбонатом кальция
- •73. Особенности химического состава бытовых и производственных сточных вод
- •75Отстаивание, удаление масел и нефти
- •76.Коагулирование сточных вод.77.Выбор и подготовка коагулянтов.
- •78) Флотация сточных вод.
- •79) Сорбция.
- •80) Сорбция – область использования, факторы, влияющие на выбор сорбентов.
- •81) Экстракция, требования, предъявляемые к экстрагентам, экстракция в противотоке.
- •82.Эвапорация и аэрация.
- •83. Области использования аэрации и эвапорации, контроль процессов.
- •85. Нейтрализация сточных вод
- •84. Радиационнаяочистка сточных вод от органических загрязнений.
- •87.Химич очистка сточных вод
- •86.Дезинфекция сточных вод
- •88.Химическое окисление под давлением
- •89.Кристаллизация.
Аномалии воды.
Известно 66 аномалий воды.
Некоторые из них:
– Аномально высокая температура плавления и кипения по сравнению с веществами аналогичного строения.
– Увеличение объема и уменьшение плотности при замерзании.
–Огромное поверхностное натяжение воды.
– Аномально высокие теплота испарения и плавления.
– Легче всего вода нагревается и быстрее всего охлаждается в так называемой «температурной яме» (370С).
–Ни одна жидкость не поглощает газы с такой жадностью как вода, также она легко отдает газы.
–После магнитной обработки воды увеличивается растворимость солей в воде, увеличивается скорость протекания реакций. При кипячении воды, обработанной магнитом, не образуется накипь, а также срывается со стенок уже имеющаяся накипь.
–Память воды.
Химические свойства воды.
1.
Разложение:
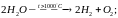
2. Универсальный растворитель – за счет полярного соединения;
3. Катализатор во многих процессах(сухой бензин не горит);
Существуют 4 типа важнейших химических реакций, в которых участвует вода.
1 тип: Кислотно-основная реакция.

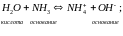
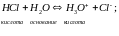
2 тип: Окислительно-восстановительные реакции.
С водой реагируют все металлы до алюминия включительно.
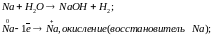
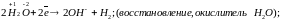
При
коррозии:
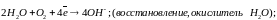
Вода как восстановитель ведет себя в биохимических процессах(фотосинтез):
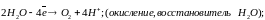
3 тип: Гидратация – способность воды сольватировать как катионы, так и анионы.
Кристаллизационная
вода – гидратированная вода, содержащаяся
в кристаллах солей.(
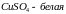 ).
).

4 тип: Гидролиз(реакция обмена веществ с водой).

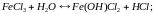
Вода способна образовывать клотраты.
 –
неустойчивы,при
повышении температуры разлагаются.
–
неустойчивы,при
повышении температуры разлагаются.
Свойства растворов
6. Физико-химические свойства растворов неэлектролитов и электролитов.
Первый закон Рауля: в разбавленных растворах неэлектролитов при постоянной температуре относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворённого вещества в растворе:

где Р0 – давление над чистым растворителем, Р – давление растворителя над раствором, n – химическое количество растворённого вещества, N – химическое количество растворителя
Второй закон Рауля: увеличение температуры кипения (Тк) и уменьшение температуры замерзания (Тз) тем больше, чем больше концентрация растворённого вещества:
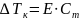
где Е – эбуллиоскопическая постоянная, Ст – молярная концентрация
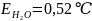
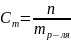
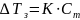
где К – криоскопическая постоянная
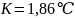
Уравнение Вант-Гоффа:
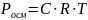
где Росм – осмотическое давление (кПа), С – молярная концентрация раствора (моль/л), R – универсальная газовая постоянная (8,31), Т – температура (К)
Уравнение, характеризующее общие свойства растворов неэлектролитов, можно использовать для растворов электролитов, если ввести в них поправочный коэффициент.

где i – изотонический коэффициент
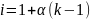
где
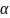 – степень диссоциации, k
– количество ионов, образовавшихся при
диссоциации
– степень диссоциации, k
– количество ионов, образовавшихся при
диссоциации
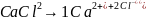

7. Свойства растворов слабых электролитов.
Закон разбавления Оствальда:
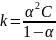 – для
слабых электролитов
– для
слабых электролитов
Если
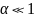 ,
то
,
то
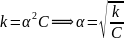 – для разбавленных растворов.
– для разбавленных растворов.
Коэффициент
диссоциации
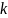 зависит от природы растворителя и
вещества, а также от температуры (чем
больше температура, тем больше коэффициент
диссоциации).
зависит от природы растворителя и
вещества, а также от температуры (чем
больше температура, тем больше коэффициент
диссоциации).
Для
сильных электролитов
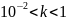
Диссоциация слабых кислот:
 -
I стадия
-
I стадия
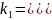
 -
II
стадия
-
II
стадия
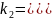
Всегда
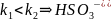 прочнее чем
прочнее чем
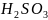
Диссоциация слабых оснований:
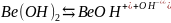 -
I
стадия
-
I
стадия
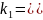
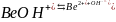 -
II
стадия
-
II
стадия