
- •29.1.2. Закон Кірхгофа
- •29.1.3. Закони випромінювання ачт
- •29.2. Зовнішній фотоефект
- •29.3. Енергія та імпульс світлових квантів
- •29.4. Ефект Комптона
- •29.5. Модель атома Бора - Резерфорда. Досліди Франка і Герца
- •29.6. Спектр атома водню за Бором
- •30. Елементи квантової механіки
- •30.1. Корпускулярно-хвильовий дуалізм
- •30.2. Співвідношення невизначеностей Гейзенберга
- •30.3. Хвильова функція і її статистичний зміст
- •30.4. Рівняння Шредінгера
- •30.5. Розв’язування рівняння Шредінгера для мікрочастинки, що міститься в нескінченно глибокій потенціальній ямі
- •30.6. Квантовий гармонічний осцилятор
- •30.7. Тунельний ефект
- •31. Фізика атомів і молекул
- •31.1. Квантово-механічна модель атома водню
- •31.2. Дослід Штерна і Герлаха. Спін електрона
- •31.3. Принцип Паулі. Періодична система елементів Менделєєва
- •31.4. Рентгенівські спектри
- •31.5. Типи міжатомних зв'язків і утворення молекул
- •31.6. Молекулярні спектри
- •31.7. Комбінаційне розсіювання світла
- •31.8. Люмінесценція
- •32. Елементи квантової статистики
- •32.1. Класична і квантова статистики
- •32.2. Розподіли Фермі-Дірака та Бозе-Ейнштейна
- •33. Фізика твердого тіла
- •33.1. Елементи зонної теорії кристалів
- •33.2. Діелектрики
- •33.3. Метали
- •33.4. Напівпровідники
- •33.5. Домішкова провідність напівпровідників
- •33.7. Напівпровідникові прилади
- •33.8. Фотопровідність
- •34. Макроскопічні квантові ефекти
- •34.1 Явище надпровідності
- •34.2. Ефект Джозефсона
- •34.3. Надтекучість
- •35. Основи квантової електроніки
- •35.1. Взаємодія випромінювання з речовиною
- •35.2. Інверсна заселеність
- •35.3. Лазери
- •36. Фізика атомного ядра
- •36.1. Будова та основні характеристики атомних ядер
- •36.2. Енергія зв'язку ядра. Дефект маси
- •36.3. Властивості ядерних сил
- •36.4. Феноменологічні моделі ядра
- •36.5. Радіоактивні перетворення атомних ядер
- •36.6. Закономірності -розпаду
- •36.7. Закономірності -розпаду
- •36.9. Ядерні реакції
- •36.40. Спонтанний поділ ядер
- •36.11. Вимушений поділ ядер. Ланцюгова реакція поділу
- •36.12. Ядерний реактор
- •36.13. Термоядерні реакції
- •36.14. Дозиметричні одиниці
- •37. Елементарні частинки
- •37.1. Фундаментальні взаємодії
- •37.2. Класи елементарних частинок
- •37.3. Характеристики елементарних частинок
- •37.4. Частинки й античастинки
- •37.5. Лептони
- •37.6. Адрони
- •37.7. Кварки
- •37.8. Переносники фундаментальних взаємодій
- •37.9. Велике об'єднання
- •Висновок
29.6. Спектр атома водню за Бором
Знайдемо спочатку радіус n-ої стаціонарної орбіти електрона.
При русі електрона по колу радіуса r на нього діє доцентрова сила mv2/r, роль якої відіграє сила кулонівської взаємодії ядра та електрона
-

(29.26)
де e — заряд електрона.
Виключаючи з рівнянь (29.24) і (29.26) швидкість v, дістанемо радіус n-ої електронної орбіти
-

(29.27)
Знайдемо тепер повну енергію атома водню:
-

(29.28)
де Wk, Wp — відповідно кінетична та потенціальна енергія електрона.
Скориставшись співвідношенням (29.26), запишемо
-

(29.29)
Потенціальну енергію електрона знайдемо як добуток заряду електрона на потенціал електростатичного поля, створюваного ядром:
-
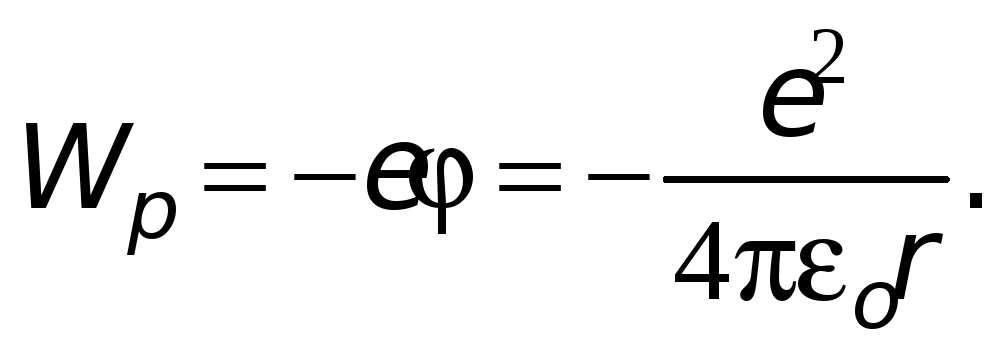
(29.30)
Тут знак «-» ураховує, що потенціальна енергія взаємодії електрона і ядра є енергією притягання.
Підставляючи (29.29) і (29.30) в (29.26), одержуємо повну енергію атома водню
-

(29.31)
І нарешті, підставимо в (29.31) значення радіуса орбіти з (29.27):
-
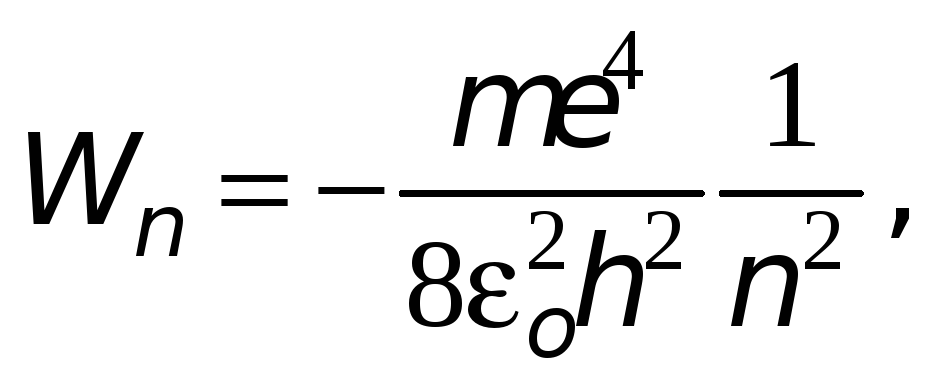
(29.32)
де n=1, 2, … ...
Видно, що енергія атома може приймати лише дискретні значення. Скориставшись другим постулатом Бора, знайдемо частоту фотона, який випускається при переході атома водню зі стаціонарного стану n з більшою енергією в стан m з меншою енергією:
-

(29.33)
де R — стала Рідберга;
Формула (29.33) збігається з узагальненою формулою Бальмера (29.23), установленої експериментально на підставі аналізу спектра випромінювання водню. У цьому спектрі різними авторами були виділені серії, у яких положення спектральних ліній у шкалі частот підлягає певним закономірностям. Як випливає з теорії Бору, кожна із серій виходить із формули (29.33) при певному фіксованому значенні числа т і значеннях n, рівних m+1, m+2, … :
серія Лаймана
серія Бальмера
серія Пашена
серія Брекета
серія Пфунда
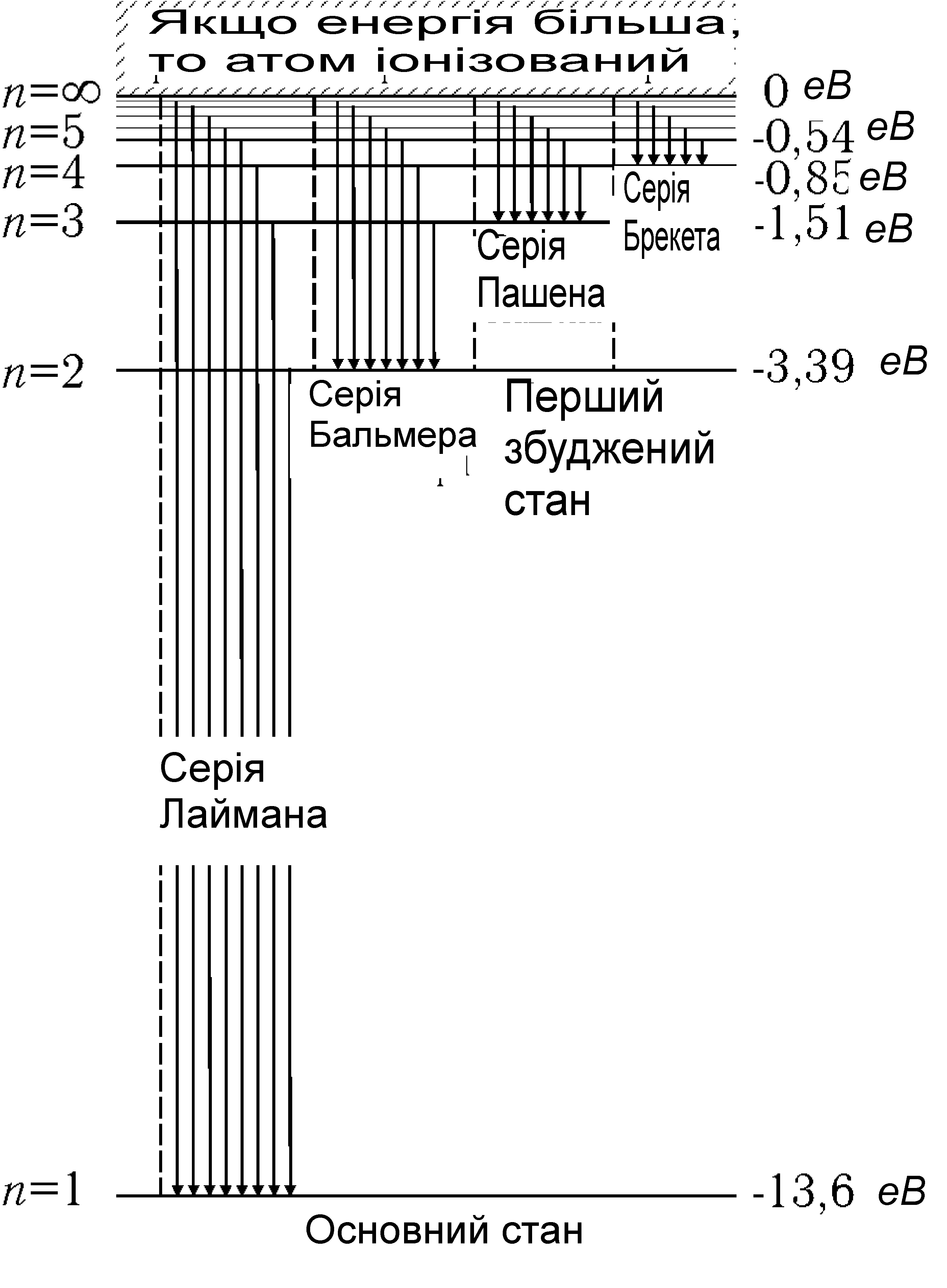
Рис. 29.8
Схема переходів, що приводять до виникнення серій у спектрі випромінювання атома водню, показана на рис, 29.8. Зауважимо, що лінії серії Лаймана розташовані в ультрафіолетовій, серії Бальмера – у видимій, а лінії інших серій – в інфрачервоній частині спектра,
Пояснення лінійчатого спектра випромінювання й поглинання атома водню й інших воднеподібних атомів Не+, Li++ тощо була блискучим успіхом теорії Бору. Однак згодом було виявлені принципові труднощі, які неможливо було подолати в рамках цієї теорії: теорія Бора внутрішньо суперечлива – вона не була ні послідовно класичною, ні послідовно квантовою теорією; вона залишала відкритим питання про інтенсивність спектральних ліній; спроби застосувати цю теорію до багатоелектронних атомів не увінчалися успіхом.
Проте, в історичному плані теорія Бору зіграла свою позитивну роль як проміжний етап на шляху до послідовної квантової теорії атомних явищ.

