

Инъекционная форма лекарственного препарата фосфоглив разрешена к применению Минздравом РФ в 2002 г. (регистрационный номер Р¹ 002528/02).
Сравнительное исследование с помощью атомно силовой микроскопии показало, что диаметр фосфолипидных наночастиц, составляющих фосфоглив и эссенциале, приблизительно одинаковый (10-45 нм и 25-60 нм соответственно) (рис. 8.3.5)
Рис. 8.3.5. Сравнение диаметра фосфолипидных наночастиц фосфоглива и эссенциале (водная эмульсия)
Данные атомно-силовой микроскопии Для определения размера фосфолипидных наночастиц образцы препаратов (эссенциале и фосфоглив) наносили на подложку из высокоориентированного пиролитического графита. Измерения проводили на сканирующем зондовом микроскопе Solver-P47H [53.]
Получаемый по данной схеме лекарственный препарат фосфоглив использовали в дальнейшем для экспериментов на культурах клеток, а также in vivo на животных с моделями
261
гепатитов. Препарат прошел доклинические, а затем и клинические испытания в соответствии с требованиями Государственного Фармакологического Комитета МЗ РФ.
СПИСОК ЛИТЕРАТУРЫ К ГЛАВЕ 8.
1.Gundermann K.-J. The "essential" phospholipids as a membrane therapeutic. Szczecin., 1993.
2.Учайкин В.Ф., Нисевич Н.И., Чередниченко Т.В. Вирусные гепатиты у детей. М., 1994, 304-318.
3.Guan R, Ho K.Y., Kang J.Y., Yap I., Gwee K.A., Tan C.C. The effect of polyunsaturated phosphatidylcholine in the treatment of acute viral hepatitis. Aliment Pharmakol Ther. 1995, 9, 699-703.
4.Kuntz E. "Essentielle" Phospholipide in der hepatologie - 50 Jahre Åxperimentale und Klinische Erfahrung. Z Gastroenterol. 1991, 29, 7-13.
5.Oette K. On the administration of phosphatidylcholine - metabolic and pharmacokinetic aspects in human. In: 50th Anniversary of Phospholipid Research (EPL). Ed. Gundermann K.-J., Schumacher R., wbn-Verlag, Bingen/Rhein. 1990, 35-48.
6.Минушкин О.Н. Некоторые гепатопротекторы в лечение заболеваний печени. Лечащий врач. 2002, 6, 55-58.
7.Bachmanova G.I., Abdugafurova M.A., Li V.S., Dobrynina O.V., Shatinina S.Z., Archakov A.I. Reparation of damaged rat liver cells, microsomal membranes and cytochrome P450-dependent monooxygenase sys-
tem by phospholipids. In: Phosphatidylcholine (Polyenephosphatidylcholine/PPC): Effects on cell membranes and transport of cholesterol, 1988, PPC Workshop, Cologne, wbn-Verlag.
Bingen/Rhein, (Archakov A.I., Gundermann K.-J., eds), 1989, 137-145.
8.Van Rossum T.G., Vulto A.G., de Man R.A., Brouwer J.T., Schalm S.W. Review article: glycyrrhizin as a potential treatment of chronic hepatitis C. Aliment Pharmacol Ther. 1998, 12, 199-205.
9.Сторожаков Г.И., Байкова И.Е. Глицирризин в лечении хронических вирусных гепатитов. Клин фармакол и терапия. 2000, 9, 39-41.
10.Iino S., Tango T., Matsushima T., Toda G., Miyake K., Hino K., Kumada H., Yasuda K., Kuroki T., Hirayama C., Suzuki H. Therapeutic effects of stronger neo-minophagen C at different doses on chronic hepatitis and liver cirrhosis. Hepatol Res. 2001, 19, 31-40.
11.Гиперлипопротеинемия как фактор риска и терапия "эссенциальными" фосфолипидами (EPL) (ред. Э.А.Бабаян, Ю.М.Лопухин, и др.). Материалы симпозиума. Управление по внедрению новых лекарственных средств и медицинской техники МЗ СССР, НИИ физико-химической медицины МЗ РФ, Москва, 1984.
12.Ploeger B., Mensinga T., Sips A., Seinen W., Meulenbelt J.,
262
DeJongh J. The pharmacokinetics of glycyrrhizic acid evaluated by physiologically based pharmacokinetic modeling. Drug Metabolism Review. 2001, 33, 125-147.
13.Абдугафурова М.А., Ли В.С., Шерстнев М.П., Бачманова Г.И., Арчаков А.И. Исследование антиокислительных свойств солей глицирризиновой кислоты и их влияние на микросомальную монооксигеназную систему печени. Вопр мед химии. 1990, 36, 29-31.
14.Абдугафурова М.А. Сравнительное исследование эффективности репарирующего действия фосфолипидных препаратов на поврежденные мембраны клеток печени. Дисс. канд., 1989.
15.Kiso Y., Tohkin M., Hikino H., Hattori M., Sakamoto T., Namba T. Mechanism of antihepatotoxic activity of glycyrrhizin. I: Effect on free radical generation and lipid peroxidation. Planta Med. 1984, 50, 298-302.
16.Karuzina I.I., Zgoda V.G., Archakov A.I. Mechanisms of P4502B4 self-inactivation, heme and apoenzyme oxidative modification during catalytic turnover. Abstr. XI Intern. symposium on microsomes and drug oxidations, Los Angeles. 1996, 199.
17.Карузина И.И., Бачманова Г.И., Арчаков А.И. Самоинактивация цитохрома Р450 в каталитическом цикле. Вестник РАМН. 1995, 2, 17-29
18.Archakov A.I., Bachmanova G.I., Cytochrome P450 and active oxygen, Taylor & Francis, London, New York, Philadelphia. 1990.
19.Арчаков А.И., Карузина И.И. Микросомальное окисление. В энциклопедии: Современное естествознание. Молекулярные основы биологических процессов. 2000, 8, 261-267.
20.Mokhosoev I.M. Karuzina I.I., Oxidative degradation of dithionitereduced cytochromes P450 LM2 and LM4. In: Cytochrome P450: biochemistry and biophysics. Proceeding of the 7th Intern. Conference. Archakov A.I., Bachmanova G.I. eds. 1992, 142-144
21.Forte T.M., Cross C.E., Gunther R.A., Kramer G.C. Characterization of sheep lung lymph lipoproteins: chemical and physical properties. J Lipid Res. 1983, 24, 1358-1367.
22.Арчаков А.И., Бачманова Г.И., Погодина О.К., Добрынина О.В., Мигушина В.Л., Савин И.Г. Способ определения деструкции эндоплазматического ретикулума клеток печени. Авторское свидетельство ¹1142802 (1.11.1984).
23.Карузина И.И., Арчаков А.И. Цитохром Р450. В сб. Белки и пептиды (под ред. В.Т.Иванова, В.М.Липкина), Наука. 1995, 17-29.
24.Karuzina I.I., Archakov A.I. CCI4-induced damage to endoplasmatic reticulum membranes. Biochem Pharmacol. 1973, 22, 2095-2104.
25.Савин И.Г., Бачманова Г.И., Карузина И.И., Скоцеляс Е.Д., Антонова Г.Н., Жирнов Г.Ф., Карякин А.В., Арипов А.Н., Арчаков
263
А.И. Влияние гелиотрина на систему микросомального окисления печени крыс. Вопр мед химии. 1983, 29, 1, 49.
26.Болданова Н. Б., Добрынина О.В., Мигушина В. Л., Арчаков А.И. Защитные действия фосфатидилхолиновых липосом при экспериментальном токсическом гепатите. Вопр мед химии. 1986, 2, 65-67.
27.Story D.L., Meierhenry E.F., Tyson C.A., Milman H.A. Differences in rat liver enzyme-altered foci produced by chlorinated aliphatics and phenobarbital. Toxicol Ind Health. 1986, 2, 351-362.
28.Waxman D.J., Azaroff L. Phenobarbital induction of cytochrome P450 gene expression. Biochem J. 1992, 281, 577-592.
29.Jansen P.L., Sturm E. Genetic cholestasis, causes and consequences for hepatobiliary transport. Liver Int. 2003, 23, 315-322.
30.Okajasu T., Curtis M.T., Farber J.L. Structural alterations of mitochondrial membranes in ishemic liver cell. Arch Biochem Biophys. 1985, 236, 638-645.
31.Алматов К.Т., Мирталипов Д.Т., Касымова Г.М. Изменения фосфолипидного состава и окислительного фосфорилирования в митохондриях печени при гепатите. Вопр мед химии. 1986, 32, 27-30.
32.Plaa G.L. Chlorinated methanes and liver injury: highlights of the past 50 years. Annu Rev Pharmacol Toxicol. 2000, 40, 42-65.
33.Домбровская Н.В. Состояние митохондриальной системы печени при гепатите и способы коррекции фосфолипидными препаратами. Дисс. канд., 1991.
34.Кабаева НВ, Перов НА, Петрова ЛЕ, Антонов А.С. Повреждение эндотелиальных клеток холестан-3β,5α,6β-триолом и
защитное действие препаратов, повышающих уровень внутриклеточного АМФ. Цитология. 1992, 34, 23-29.
35.Torkhovskaya T, Khalilov E., Medvedeva N., Morozkin A., Misharin A., Ipatova O., Antonov A., Kabayeva N., Archakov A. Antiatherogenic action of micelles with glycyrrhizin on plasma lipoproteins and endothelial culture cells. XIII Lipid Meeting Leipzig, Germany. 2002, 82-83.
36.Martin GP, el-Hariri LM, Marriott C. Bile saltand lysophos- phatidylcholine-induced membrane damage in human erythrocytes. J Pharm Pharmacol. 1992, 44, 646-50.
37.Арчаков А.И., Иванов А.С., Бачманова Г.И., Маркин С.С., Ковалева Г.Г. Композиция, обладающая свойствами репарировать мембраны гепатоцитов. Патент ¹ 2043110 от 10.09.1995г.
38.Арчаков А.И., Бачманова Г.И., Гусева М.К., Ипатова О.М., Княжев В.А., Лисов В.И., Скворцов И.А., Учайкин В.Ф., Тихонова Е.Г., Якубовский К.В., Цыганов Д.И. Композиция, обладающая свойствами репарировать биологичесие мембраны. Патент на изобретение ¹
264
2133122 îò 14.10.98.
39.Moghimi S.M., Hunter A.C., Murray J.C. Long-circulating and tar- get-specific nanoparticles: theory to practice. Pharmacol Reviews. 2001, 53, 283-318.
40.Марголис Л.Б., Бергельсон Л.Д. Липосомы и их взаимодействие с клетками. М., Наука, 1986.
41.Allen T.M., Chonn A. Large unilamellar liposomes with low uptake into reticulo-endothelial system. FEBS Lett. 1987, 223, 42-46.
42.Drummond D., Meyer O., Hong K., Kirpotin D., Papahadjopoulos D. Optimizing liposomes for delivery of chemotherapeutic agents to solid tumors. Pharmacol Rev. 1999, 51, 691-743.
43.Senior J.H. Fate and behaviour of liposomes in vivo: a review of controlling factors. Crit Rev Ther Drug Carrier Syst. 1987, 3, 123-93.
44.Hwang K.J. Liposome pharmacokinetics. In: Liposomes: From Biophysics to Therapeutics (Ostro M.J. ed). Marcel Dekker, Inc, New York. 1987, 109-156.
45.Gabizon A.A. Liposome circulation time and tumor targeting: implications for cancer chemotherapy. Adv Drug Del Rev. 1995, 16, 285294
46.Барсуков Л.И. Липосомы. Соросовский обозревательный журнал. 1998, 10, 2- 9.
47.Дудниченко А.С., Краснопольский Ю.М, Швец В.И. Липосомальные лекарственные препараты в эксперименте и клинике. Харьков, 2001.
48.Senior J., Crawley J.C., Gregoriadis G. Tissue distribution of liposomes exhibiting long half-lives in the circulation after intravenous injection. Biochim Biophys Acta. 1985, 839, 1-8.
49.Xia W.J., Onyuksel H. Mechanistic studies on surfactant-induced membrane permeability enhancement. Pharm Res. 2000, 7, 612-618.
50.Erhorning G., Pulsating bubble technique for evaluating surface tension. J Apl Physiol. 1977, 43, 198-203.
51.Birnie G.D., D.Rickwood (eds). Centrifugal Separations in Molecular and Cell Biology. Butterworths, London, 1978.
52.Aso Y, Yoshioka S. Effect of freezing rate on physical stability of lyophilized cationic liposomes. Chem Pharm Bull. 2005, 53, 301-304.
53.Kuznetsov V.Y., Ivanov Y.D., Bykov V.A., Saunin S.A., Fedorov I.A., Lemeshko S.V., Hoa H.B., Archakov A.I. Atomic force microscopy detection of molecular complexes in multiprotein P450cam-containing monooxygenase system. Proteomics. 2002, 2, 161-165.
265
ГЛАВА 9. ДОКЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ ФОСФОГЛИВА
9.1. Сравнительное изучение фармакологической активности препаратов фосфоглив и эссенциале в экспериментах in situ.
Фармакологическую активность фосфоглива оценивали в экспериментах in vitro на паспортизированной линии клеток L929 (фибробластоподобные клетки фибросаркомы мышей), фибробластах кожи человека (здоровых доноров) и на перитонеальных макрофагах мышей. Различные концентрации фосфоглива и эссенциале, рассчитанные по СФХ (0,5 - 5 мг/мл) добавляли в культуральную среду через 2 часа после пассирования клеток и анализировали влияние этих фосфолипидных препаратов на рост клеток, синтез ДНК, РНК и белка, а также на продукцию TNF перитонеальными макрофагами.
При кратковременном (5 часов) культивировании клеток L929 в присутствии исследуемых препаратов количество живых клеток в среде с фосфогливом было выше, чем в среде с эссенциале (Рис. 9.1.1 А). Из представленного графика видно, что при низких концентрациях (до 1 мг/мл) фосфоглив практически не снижал число живых клеток в среде; при концентрации 5 мг/мл число живых клеток уменьшалось не более чем на 15-20%. Однако эссенциале уже в концентрации 0,1 мг/мл обладал выраженной цитотоксичностью, резко возрастающей с увеличением концентрации препарата. При его содержании 5 мг/мл снижение количества живых клеток в среде составляло 85-90%.
Результаты культивирования клеток L929 в течение 24 часов в присутствии фосфоглива и эссенциале представлены на рис. 9.1.1Б. Отчетливо видно, что при культивировании в присутствии 0,1 мг/мл эссенциале выживает только 50% клеток, а доза 0,2 мг/мл в этих условиях вызывает гибель всех клеток. В аналогичных условиях культивирования фосфоглив в концентрациях 0,5-5 мг/мл цитотоксического действия практически не проявлял.
Через 72-96 часов культивирования (рис. 9.1.1 В), фосфоглив замедлял рост клеток только при концентрации 1,0 мг/мл. В этих же условиях гораздо меньшая концентрация эссенциале (0,1 мг/мл) оказалась токсичной для клеток. Компоненты фосфоглива (СФХ и ГК) при культивировании до 6 суток существенного цитотоксического действия на клетки не оказывали.
При добавлении фосфоглива в культуральную среду фибробластов кожи человека на 6-й день инкубации была выявлена стимуляция роста клеток при концентрации фосфоглива по СФХ 0,5 и 1 мг/мл.
266
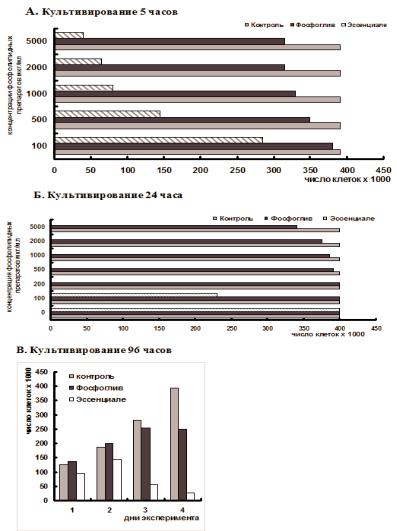
Рис. 9.1.1. Влияние Фосфоглива и Эссенциале на рост клеток L 929
Цитотоксичность фосфоглива и эссенциале определяли в опытах in vitro на паспортизированной линии клеток L929 (фибробластоподобные клетки фибросаркомы мышей) при их культивировании в среде 199 с 10% или 20% бычьей сыворотки. Клетки культивировали в 24- и 48-ми луночных планшетах. Различные концентрации препаратов (от 0,5 до 5 мг/мл) добавляли в культуральную среду через 2 часа после пассирования клеток (рис. А и Б). При культивировании 96 часов к культуре клеток добавляли фосфоглив в концентрации 1 мг/мл, а эссенциале - 0,1 мг/мл. Через 5, 24, 48, 72 и 96 часов инкубации определяли число клеток в лунке спектрофотометрически при 590 нм после окраски клеток
267

Рис. 9.1.2. Влияние фосфоглива и эссенциале на синтез РНК, ДНК и белка в клетках L 929 при 4-х часовой инкубации
Различные концентрации фосфоглива и эссенциале по СФХ (от 0,05 до 5,0 мг/мл) добавляли к культуре паспортизированной линии клеток L929 и преинкубировали в течение 4-х часов. Синтез белка, РНК и ДНК в клетках оценивали по включению меченных предшественников С14-валина, С14-уридина и Н3-тимидина соответственно, которые вносили в культуральную среду перед пассированием клеток [4].
268
Таким образом, исследования влияния препаратов на рост клеток показали отсутствие цитотоксических свойств у фосфоглива и его компонентов, но выявили цитотоксичность препарата эссенциале, связанную, вероятно, с присутствием солей желчных кислот, способных лизировать клетки (см. главу 5) [1, 2].
Помимо роста клеток, исследовали также влияние фосфоглива и эссенциале на синтез в них белка, РНК и ДНК (Рис. 9.1.2, А, Б и В).
Как видно из графиков, преинкубация клеток L929 с фосфогливом в дозе 0,5 мг/мл (по СФХ), в течение 4-х часов не влияет на синтез белка в клетках (А), на 15-30% снижает синтез РНК (Б) и на 20% увеличивает синтез ДНК (В). Эссенциале же и при меньших дозах ингибирует все исследованные препараты: уже в концентрации 0,1 мг/мл (по СФХ) он ~ на 75% ингибирует синтез белка (А); при концентрации 0,5 мг/мл наблюдалось почти полное (на 85-90%) ингибирование синтеза РНК и ДНК в клетках (Б, В).
Таким образом, фосфоглив не повреждает клеточные системы синтеза белка, РНК и ДНК, что подтверждает отсутствие токсичности как у самого препарата, так и его компонентов. Резкое ингибирование синтеза белка, РНК и ДНК в клетках даже сравнительно низкими концентрациями препарата эссенциале указывает на его цитотоксичность.
Представлялось также целесообразным исследовать влияние фосфоглива и эссенциале, на продукцию макрофагами TNF. Этот цитокин участвует во многих биологических процессах, включая процессы воспаления, инфекции, шока и повреждения тканей, развития кахексии и играет существенную роль в патогенезе ряда
заболеваний [4]. Основным источником TNF в организме являются клетки макрофагальной системы [4, 5]. Влияние фосфолипидных препаратов на генерацию TNF оценивали по индексу цитотоксичности (ИЦ) кондиционированной среды макрофагов, выделенных из интактных мышей при добавлении ее к культуре клеток L929 (рис. 9.1.3) [6]. Как видно из рисунка, величина ИЦ до 10% характеризует нормальный уровень синтеза и секреции TNF макрофагами в контроле без добавления препаратов. В присутствии эссенциале перитонеальные макрофаги интактных мышей секретируют в среду большое количество TNF: ИЦ культуральной среды при добавлении к макрофагам 2 мг/мл по СФХ эссенциале равен ~70%. В тех же условиях ИЦ макрофагальной среды при добавлении фосфоглива или глицирризиновой кислоты составлял всего 8 и 25% соответственно. Существенная активация перитонеальных макрофагов под действием эссенциале может на уровне организма приводить к повышенным выбросам TNF и других цитокинов, способных оказывать нежелательные эффекты.
269

Рис. 9.1.3. Сравнительное действие фосфоглива и его компонентов на образование фактора некроза опухолей (TNF).
Таким образом, и в этих экспериментах установлено, что в отличие от эссенциале, фосфоглив не только не обладает цитотоксичностью, но и не активирует образование макрофагами TNF.
9.2. Исследование фармакологической активности препарата фосфоглив в экспериментах на животных на модели острого гепатита, вызванного ССl4.
Учитывая важность восстановления белоксинтезирующей функции клеток печени в процессе регенерации органа после введения ССl4 [7], было исследовано влияние фосфолипидных препаратов на синтез РНК, ДНК, альбумина, а также на относительное содержание новообразованной мРНК в полирибосомах клеток печени крыс отравленных ССl4 [8]. Поскольку при токсическом поражении печени ССl4 резко увеличивается количество купферовских клеток, способных вырабатывать биологически активные вещества, в том числе, и TNF, оценивалось действие препаратов
èна секрецию последнего макрофагами [9].
Âопытах использовали крыс самцов линии Вистар, массой 160 - 180 г, содержавшихся на стандартной диете. Для развития острого токсического
гепатита животным внутрибрюшинно вводили ССl4 в дозе 0,1 мл/100г. Для исследования синтеза ДНК, РНК и альбумина использовали включение в них меченных [Н3]-тимидина (Россия, 4,3 Ku/мМ), [С14]-оротовой кислоты (Венгрия, 40 мкKu/мМ) и [С14]-лейцина (Чехословакия, 80 мкKu/мМ) соответственно. Результаты приведены в табл. 9.2.1.
270
