
Впервые композиция, состоящая из глицирризиновой кислоты и соевого фосфатидилхолина и обладающая способностью восстанавливать мембраны клеток печени, активность их монооксигеназной системы, была предложена нами в 1988 г. [7]. Этому предшествовало изучение влияния СФХ (см. главу 6) и ГК на процессы репарации мембран.
8.1. Исследование антиокислительных свойств и эффективности защитного действия ГК на микросомальную систему печени.
Несмотря на многочисленные исследования, посвященные фармакологическим свойствам ГК и ее производных [8, 12], мало что известно о ее антиоксидантной активности и влиянии на микросомальную систему печени.
В связи с этим были проведены эксперименты по оценке антиокислительной активности солей ГК (Na1ÃÊ, Na3ÃÊ è K3ГК), в которых показано, что их добавление к гепаринизированной крови вызвало тушение инициированной ионами Fe2+ хемилюминесценции (ХЛ) плазмы крови на 76 ± 4,2 %; 78 ± 5,5 % и 81 ± 6,0 % [13]. Эффективность тушения была приблизительно одинаковой при добавлении солей ГК в начале или на максимуме ХЛ Антиокислительная активность солей ГК была сопоставима с активностью жирорастворимого антиоксиданта ионола (70 ± 5,0 %) и более, чем в 3 раза превышала активность водорастворимого антиоксиданта маннитола (24 ± 3,5%) в этих же условиях [13, 14]. Эти результаты позволили предположить, что отмеченное в ряде работ
защитное действие ГК на клетки гепатоцитов, поврежденных СС14 в экспериментах in vitro, связано с ее антиокислительной активностью, поскольку начальным этапом в механизме цитотоксического действия СС14 является его цитохром Р450-зависимая метаболическая активация в печени с образованием·СС1•3-радикала, инициирующего ПОЛ (см. главу 6) [15].
При анализе связывания Na3ГК с цитохромом Р450 микросом печени крыс было обнаружено, что глицирризинат образует с окисленным гемопротеином комплекс, характеризующийся дифференциальным спектром поглощения 1 типа с max = 374 нм и min = 418 нм. Спектральная константа связывания цитохрома Р450
ñNa3ГК составляла 0,32 ± 0,05 мМ [13]. Эти результаты согласуются
ñполученными ранее данными о том, что субстраты 1 типа способны замедлять инактивацию цитохрома Р450 [16, 18, 19].
Влияния ГК на монооксигеназную систему было исследовано как in vitro, òàê è in vivo. При исследовании действия ГК на инактивацию изолированного гемопротеина, цитохром Р450 2В4
241
выделяли из микросом печени крыс и разводили до концентрации 1 нмоль/мл 100 мМ фосфатного буфера, рН 7,4. Добавляли раствор Na3ГК в том же буфере до концентрации 20 мкМ, и преинкубировали 5 мин при 30°С, после чего в течение 20 мин регистрировали дифференциальные спектры поглощения карбоксикомплекса цитохрома Р450, оценивая время его инактивации по накоплению неактивной формы (разница оптических плотностей при 420 и 450 нм) [7, 17]. Как известно, количественной характеристикой инактивации гемопротеина служит время его полуинактивации (t1/2). В отсутствие ГК t1/2 гемопротеина составляло 4 мин, а при добавлении Na3ГК - 9 мин, т.е. скорость инактивации гемопротеина в присутствии ГК снижалась более, чем в 2 раза. Это свидетельствует о стабилизирующем влиянии ГК на цитохром Р450 и согласуется с ранее полученными данными о защитном действии некоторых антиоксидантов на цитохром Р450 [18-20].
Влияние Na3ГК на микросомальную монооксигеназную систему печени крыс изучали после короткого курсового внутрибрюшинного введения в дозе 2 мг/100 г в течение трех дней. В микросомах, выделенных из печени этих животных, отмечено некоторое увеличение скорости реакций гидроксилирования анилина и N-деметилирования аминопирина по сравнению с микросомами из печени интактных крыс. Оно было обусловлено небольшой индукции цитохрома Р450 под действием Na3ГК (приблизительно на 35%), благодаря которой в микросомах из печени крыс опытной группы возрастало удельное содержание
цитохрома Р450. Удельное содержание цитохрома b5 и активность НАДН-феррицианидредуктазы оставались без изменений [13].
Представленные результаты свидетельствуют о том, что натриевая соль глицирризиновой кислоты обладает антиокислительной активностью, связывается с цитохромом Р450, образуя комплексы 1 типа, оказывает стабилизирующее действие на восстановленный гемопротеин и функциональную активность мембран эндоплазматического ретикулума и повышает содержание цитохрома Р450 в клетках печени.
Таким образом, имеющиеся литературные данные и результаты собственных исследований обосновывают включение натриевой соли глицирризиновой кислоты в состав фосфолипидных препаратов, предназначенных для лечения токсических и вирусных повреждений печени, что должно способствовать увеличению эффективности их действия на поврежденные мембраны ЭР печени. Можно предположить, что сочетание репарирующего действия СФХ на мембраны гепатоцитов и монооксигеназную систему эндоплазматического ретикулума и
242
Na3ГК, активирующей иммунную и интерфероновую системы, а также стабилизирующей функциональную активность мебран ЭР, окажется эффективным для создания принципиально нового лекарственного препарата, сочетающего в себе механизмы действия этих биологически активных природных соединений.
8.2.Исследование эффективности действия смеси СФХ и ГК.
8.2.1.Сравнительная характеристика фосфолипидных препаратов.
При исследовании эффективности репарирующего действия смеси соевого фосфатидилхолина и натриевой соли глицирризиновой кислоты (ФХГК) на поврежденные мембраны микросом печени крыс в качестве препаратов сравнения были использованы: (1) СФХ - соевый фосфатидилхолин, (2) ФХМ - соевый фосфатидилхолин с добавлением мальтозы фирмы Nattermann, Германия (согласно договору о научном сотрудничестве) и (3) эссенциале, широко применяемый в клинической практике для лечения заболеваний печени.
Морфология фосфолипидных препаратов. Ультраструктуру фосфолипидных наночастиц исследуемой смеси, полученных с помощью ультразвукового дезинтегратора, а также препаратов сравнения (СФХ, ФХМ и эссенциале), исследовали методом электронной микроскопии [21]. Смесь ФХГК состояла в основном из фосфолипидных наночастиц диаметром от 10 до 100 нм, основную часть которых (90 %) составляли частицы диаметром 3545 нм. Липосомы из СФХ имели средний диаметр 200-250 íì, à
препарат ФХМ был представлен наночастицами диаметром от 25 до 100 нм, основная часть которых (95 %) имела диаметр 75-100 нм. Эссенциале представлял собой также тонкую эмульсию фосфолипидных наночастиц диаметром от 4 до 50 нм.
Состав и физико-õимические свойства фосфолипидных препаратов. В связи с существующими определенными требованиями Фармакологического комитета к препаратам на фосфолипидной основе (рН, осмолярность, размер частиц и др.) была разработана технология получения в лабораторных условиях смеси ФХГК, отвечающей этим требованиям. Состав и физикохимические характеристики исследуемых фосфолипидных препаратов представлены в табл. 8.2.1.
Как видно из данных, представленных в таблице 8.2.1, индекс окисленности препаратов, измеряемый как отношение поглощения при 233 нм (максимум поглощения диеновых конъюгатов) к поглощению при 215 нм, не превышал 0,32 для ФХГК и эссенциале, но оказался в 2 раза выше у ФХМ и СФХ, что свидетельствует о присутствии продуктов окисления
243

Таблица 8.2.1.
Состав и физико-химические характеристики фосфолипидных препаратов*
Препарат |
Состав |
|
Индекс |
ðÍ |
Средний |
Осмоляр - |
|
|
|
окисленности |
|
диаметр |
ность |
|
|
|
|
наночастиц |
|
|
|
|
|
|
|
|
|
ÔÕÃÊ |
ÑÔÕ – 50 ìã/ìë; |
0,32 ± 0,09 |
7,3±0,25 |
35 – 45 íì |
230 ± 9,5 |
|
|
Na3ÃÊ – 5 ìã/ìë |
|
|
|
ìîñì/ë |
|
|
|
|
|
|
|
|
ÑÔÕ |
ÑÔÕ – 50 ìã/ìë; |
0,65 ± 0,12 |
6,7±0,2 |
200 – 250 íì |
- |
|
|
|
|
|
|
|
|
ÔÕÌ |
ÑÔÕ – 50 ìã/ìë; |
0,68 ± 0,11 |
6,6±0,3 |
75 – 100 íì |
- |
|
(«Nattermann», |
мальтоза – |
200 |
|
|
|
|
Германия) |
ìã/ìë |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Эссенциале |
ÑÔÕ – 50 ìã/ìë; |
0,31 ± 0,08 |
7,2±0,28 |
10 – 45 íì |
210 ±11,4 |
|
|
Содержание |
|
|
|
|
ìîñì/ë |
|
холевой кислоты в |
|
|
|
|
|
|
препарате |
íå |
|
|
|
|
|
указано |
|
|
|
|
|
|
|
|
|
|
|
|
* - здесь и далее (за исключением особо оговоренных случаев) ошибка средней не превышала 5- 10%.
фосфолипидов. Значение рН эмульсии ФХГК и эссенциале не превышало 7,2-7,3, но было ниже у ФХМ и СФХ (6,4-6,6).
Осмолярность, или молярное количество осмотически активных частиц на литр раствора (мосм/л), контролировали методом, основанным на определении точки замерзания на полумикроавтоматическом осмометре Knauer. Для препаратов ФХГК и эссенциале она составила 210230 мосм/литр.
Таким образом, исследования показали, что фосфолипидная наноэмульсия ФХГК, приготовленная методом ультразвуковой обработки из СФХ с добавлением Na3ГК, по основным физико-химическим параметрамнеуступаетэссенциале,апонекоторымсвойствампревосходит препарат ФХМ фирмы "Nattermann" (Германия).
8.2.2. Влияние смеси СФХ и глицирризиновой кислоты на инактивацию цитохрома Р450 .
С помощью описанного выше метода оценки стабильности цитохрома Р450 - как показателя состояния мембран ЭР печени (см. главу 6) [7, 18, 22], была исследована способность фосфолипидной наноэмульсии ФХГК, оказывать стабилизирующее действие на мембраны как в условиях in vitro, òàê è in vivo, при введении животным с поврежденными в результате отравления гепатотропными ядами мембранами клеток печени.
Так, было проведено сравнение влияния фосфолипидных препаратов на скорость инактивации изолированного цитохрома Р450, т. е. оценка их стабилизирующего действия на этот гемопротеин (таблица 8.2.2).
244

|
|
|
|
|
Таблица 8.2.2. |
|
Âремя полуинактивации (t1/2) изолированного цитохрома Р450 |
||||||
|
в присутствии фосфолипидных препаратов. |
|
|
|||
|
|
|
|
|
|
|
Условия |
Изолированный |
Инкубация с фосфолипидными препаратами |
|
|||
опыта |
цитохром |
|
|
|
|
|
|
Ð450 2Â4 |
ÔÕÃÊ |
ÑÔÕ |
ÔÕÌ |
Эссенциале |
|
|
|
|
|
|
|
|
T1/2 , ìèí |
8,0 + 0,5 |
20,0 + 1,0** |
7,0 + 1,2 |
7,0 + 0,8 |
3,0 + 0,5** |
|
|
|
|
|
|
|
|
Инкубационная смесь содержала 0,3 нмоль цитохрома Р450 в 1 мл 100 мМ трис-HC1 буфера рН 7,4. Микросомы предварительно инкубировали с фосфолипидными препаратами: 5 мг/нмоль цитохрома Р450 60 мин при 40°С. Инактивацию цитохрома Р450 оценивали по дифференциальным спектрам поглощения на спектрофотометре Hitachi 557 (Япония) при регистрации оптической плотности при 450 и 420 нм в процессе инкубации. Разница между величинами оптической плотности инактивированной и активной карбоксикомплексной формами фермента (при 420 и 450 нм соответственно) - А (420 - 450) - рассматривалась как показатель инактивации [7, 22].
** статистически достоверно по отношению к контролю, р<0,05.
Как видно из таблицы 8.2.2, время полуинактивации изолированного очищенного цитохрома Р450 (контроль) составляло 8 мин. После инкубации с эмульсией ФХГК оно увеличилось до 20 мин. Препараты ФХМ и СФХ не оказывали стабилизирующего действия; время полуинактивации цитохрома Р450 при инкубации с ними составляло 7 мин., что может быть связано с высоким индексом окисленности фосфолипида. Эссенциале в аналогичных условиях вызывал резкую дестабилизацию цитохрома Р450, сокращая время полуинактивации фермента до 3 минут, что обусловлено, повидимому, присутствием в нем производных желчных кислот,
добавляемых в качестве детергента. Таким образом, из исследуемых фосфолипидных препаратов только смесь ФХГК замедляла скорость инактивации изолированнного цитохрома Р450, что свидетельствует о ее стабилизирующем действии на этот гемопротеин.
Ранее было показано, что под действием гепатотоксинов в ЭР (в микросомах) происходит снижение как абсолютного содержания цитохрома Р450, так и ослабление его стабильности благодаря повреждению мембраны вследствии инициации процессов ПОЛ реакционноспособными метаболитами этих ядов [18, 19, 23] (см. главу 6).
В связи с этим нами было исследовано влияние смеси ФХГК и препаратов сравнения как на абсолютное содержание цитохрома Р450, так и на его активность в поврежденных мембранах микросом печени крыс. Для этой цели были выбраны три экспериментальные модели повреждения мембран: 2 из них - модели острого токсического гепатита, вызванного введением гепатотоксинов CCl4 и гелиотрина, и модель лекарственного
245
отравления, вызванного введением фенобарбитала [7, 23 - 26]. Через 24 часа после последнего введения животных забивали и из печени выделяли фракцию микросом. Удельное содержание цитохрома Р450 в микросомах печени крыс составляло 0,52±0,07; 0,56±0,08 и 2,3±0,21 нмоль/мг белка после введения CCl4, гелиотрина и фенобарбитала соответственно, по сравнению с 0,97±0,18 нмоль/мг белка в контроле. Таким образом, введение животным гепатотропных ядов (CCl4 и гелиотрина) сопровождалось снижением удельного содержания цитохрома Р450 на 47 и 41 %, соответственно, что свидетельствует о повреждении мембран ЭР. Введение типичного индуктора цитохрома Р450 подсемейства 2В фенобарбитала, напротив, вызывало увеличение удельного содержания гемопротеина в 2,4 раза, что также хорошо известно из литературы [28]. Несмотря на это, скорость инактивации восстановленного цитохрома Р450 в препаратах микросом печени, индуцированных фенобарбиталом крыс, была гораздо выше, чем в микросомах интактных животных, что свидетельствует о нарушениях белок-липидных взаимодействий (t1/2 составило 6±0,3 и 20±1,1 мин соответственно). Инактивация цитохрома Р450 при введении CCl4 и гелиотрина была также повышена (t1/2 составило 5±0,4 и 8±0,6 мин соответственно) (табл. 8.2.3). Полученные данные свидетельствуют о нарушении липидного матрикса и фосфолипидного окружения цитохрома Р450 этих мембран при всех трех воздействиях и демонстрирует также гепатотоксичность фенобарбитала.
В дальнейшем эффект репарирующего действия сравниваемых
фосфолипидных препаратов оценивали по замедлению инактивации цитохрома Р450 в поврежденных микросомах после инкубации их с этими препаратами. Предварительно были подобраны оптимальные условия эксперимента: соотношение фосфолипида к цитохрому Р450 (5 мг на 1 нмоль) и время инкубации микросом с фосфолипидными препаратами (60 мин. при температуре 4°С) (табл. 8.2.3).
Результаты показывают, что при инкубации поврежденных микросом с наноэмульсией ФХГК замедление скорости инактивации цитохрома Р450 было наиболее выраженным и составляло 12, 15 и 16 минут для микросом, поврежденных CCl4, гелиотрином, фенобарбиталом соответственно, в контроле - 20 мин., а в микросомах без инкубации с фосфолипидными препаратами - 5, 8 и 6 мин. соответственно. Препараты СФХ и ФХМ оказывали меньший эффект, время полуинактивации гемопротеина составляло 10-11 мин. В то же время добавление 1 нмоля эссенциале не только не восстанавливало мембрану, но,
246

Таблица 8.2.3. Время полуинактивации цитохрома Р450 в микросомах,
поврежденных CCl4, гелиотрином, фенобарбиталом до и после инкубации с фосфолипидными препаратами (t1/2, ìèí.).
Группы |
Время полу - |
Время полуинактивации цитохрома Р450 при |
||||
инактивации |
инкубации микросом с фосфолипидными |
|||||
животных |
||||||
цитохрома |
|
препаратами |
|
|||
|
|
|
||||
|
Ð450 |
ÔÕÃÊ |
ÔÕÌ |
Эссенциале |
ÑÔÕ |
|
|
|
|
|
|
|
|
Контроль |
20,0±1,1 |
- |
- |
- |
- |
|
|
|
|
|
|
|
|
CCl4 |
5,0 + 0,5 |
12,0 + 1,0 |
10,0 + 1,0 |
3,0 + 0,1 |
10,0 + 1,0 |
|
|
|
|
|
|
|
|
Гелиотрин |
8,0 + 0,4 |
15,0 + 1,2 |
10,0 + 0,5 |
2,0 + 0,1 |
10,0 + 1,0 |
|
|
|
|
|
|
|
|
Фенобарбитал |
6,0 + 0,5 |
16,0 + 1,1 |
11,0 + 1,0 |
2,0 + 0,1 |
11,0 + 1,0 |
|
|
|
|
|
|
|
|
Для эксперимента использовали крыс-самцов массой 100-120г, содержащихся в стандартных условиях; n=6 для каждой группы животных. Фенобарбитал вводили внутрибрюшинно в дозе 0,8 мг на 100г массы крысам в течение 3 дней. Модели острого токсического гепатита получали одноразовым введением внутрибрюшинно CCl4 (0,2 мл/100г массы) или гелиотрина (30 мг/100г массы). Фракцию микросом печени получали стандартным методом [12]. Инактивация цитохрома Р450 микросом печени крыс, получавших CCl4, гелиотрин, фенобарбитал, проводилась в стандартных условиях. Инкубационная смесь содержала 0,3 нмоль Р450 в 1 мл 100 мМ, трис-HC1 буфера рН-7.4. Дифференциальные спектры поглощения карбоксикомплекса цитохрома Р450 регистрировали при 37°С в течение 20 мин [7, 21]. В дальнейшем микросомы инкубировали с фосфолипидными препаратами из расчета 5 мг на 1 нмоль гемопротеина в течение 60 мин при 40°С и вновь регистрировали дифференциальные спектры поглощения карбоксикомплекса цитохрома Р450 [7, 13, 21].
напротив, усугубляло повреждающее действие всех трех гепатотоксинов, еще больше усиливая инактивацию цитохрома
Р450 и соответственно снижая t1/2 в 2 - 3 раза, возможно, в результате действия солей желчных кислот, повреждающих мембраны [29].
Таким образом, результаты исследований стабилизирующего действия фосфолипидных препаратов на цитохром Р450 поврежденных мембран микросом, показали, что из исследуемых препаратов максимальным репарирующим эффектом на гемопротеин (цитохром Р450) обладала смесь ФХГК. СФХ и препарат ФХМ уступали по эффективности действия смеси ФХГК. Эссенциале не только не оказывал стабилизирующего действия, но и усугублял повреждение мембран.
Более эффективное действие ФХГК в сравнение с другими исследуемыми фосфолипидными препаратами было также подтверждено в экспериментах in vivo после их трехкратного внутрибрюшинного введения отравленным животным (рис. 8.2.1). Как видно из рисунка, резкая инактивация гемопротеина в микросомах печени крыс, отравленных CCl4 (ðèñ. 8.2.1, À) èëè
247
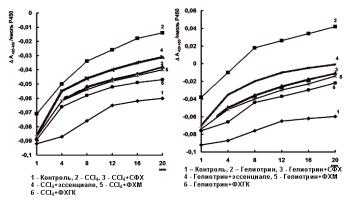
Рис. 8.2.1. Изменение скорости инактивации цитохрома Р450 в микросомах печени крыс, отравленных СС14 (А) и гелиотрином (Б) после внутрибрюшинного введения ФХГК и препаратов сравнения
Крысам-самцам вводили внутрибрюшинно CCl4 по 0,2 мл/100 г массы (А), или гелиотрин по 30 мг/100 г (Б). Через 24 часа животным вводили внутрибрюшинно фосфолипидные препараты - ФХГК, или СФХ или ФХМ или эссенциале, в дозе 20 мг ФЛ/100 г, в течение трех дней. Через 24 часа после последнего введения животных забивали и получали фракцию микросом печени. Дифференциальные спектры поглощения карбоксикомплекса цитохрома Р450 в области 400500 нм регистрировали в течение 20 минут при 37î в среде, содержащей 0,33 нмоль цитохрома Р450/мл, и рассчитывали разницу между оптической плотностью неактивной и активной форм цитохрома (А420 и А450 соответственно) - как показатель инактивации цитохрома Р450 [7, 14].
гелиотрином (рис 8.2.1, Б) (кривые 2), замедлялась при введении животным всех фосфолипидных препаратов, однако наиболее выраженным эффект был у крыс, получавших ФХГК. Аналогичные
результаты были получены и при отравлении животных фенобарбиталом [14].
Таким образом, результаты исследований стабилизирующего действия фосфолипидных препаратов на цитохром Р450 поврежденных мембран микросом, показали, что из исследуемых препаратов максимальным репарирующим эффектом на цитохром Р450 обладала смесь ФХГК. СФХ и препарат ФХМ по эффективности действия уступали смеси ФХГК. Эссенциале не только не оказывал стабилизирующего действия, но и усугублял повреждение мембран.
8.2.3. Влияние смеси ФХГК на активность микросомальных
ферментов печени крыс с экспериментальным токсическим гепатитом.
Функциональное состояние мембран микросом оценивали также по удельному содержанию цитохрома Р450 и скорости НАДФНзависимого окисления субстратов монооксигеназной системы -
248

анилина и аминопирина. Кроме того, для оценки репарирующего действия наноэмульсии ФХГК и препаратов сравнения на микросомальные мембраны печени крыс в выделенных микросомах определяли активность НАДФН-цитохром ñ редуктазы и НАДНферрицианидредуктазы (табл. 8.2.4).
Таблица 8.2.4.
Влияние препаратов на показатели функционального состояния монооксигеназной системы микросом печени крыс с экспериментальным
токсическим гепатитом*.
|
|
Микросомы печени крыс с токсическим гепатитом |
||||
Показатели |
Интактные |
|
|
|
|
|
Без введения |
|
|
|
|||
микросомы |
ÔÕÃÊ |
ÔÕÌ |
Эссенциале |
|||
|
фосфо - |
|||||
|
|
|
|
|
||
|
|
липидов |
|
|
|
|
Содержание цитохрома |
0,97 ± 0,06 |
0,43 ± 0,05 |
0,77 ± 0,06* |
0,78 ± 0,04* |
0,61 ± 0,03* |
|
Р450, (нмоль/мг белка) |
||||||
|
|
|
|
|
||
|
|
|
|
|
|
|
НАДФН-öитохром ñ ðå- |
0,49 ±0,003 |
0,25 ± 0,017 |
0,41± 0,02* |
0,37± 0,04* |
0,33± 0,019** |
|
дуктаза, (нмоль восст. |
||||||
цитохрома ñ • ìã-1 •ìèí-1) |
|
|
|
|
|
|
ÍÀÄÍ-ôеррицианид ре - |
7,3 ± 0,06 |
3,63 ± 0,29 |
6,28 ±0,54* |
5,69± 0,50* |
4,95± 0,35** |
|
дуктаза (нмоль восст. |
||||||
феррицианида • мг -1•ìèí-1) |
|
|
|
|
|
|
N-äеметилирование ами - |
9,7 ± 0,3 |
3,89 ± 0,3 |
7,69 ± 0,35* |
7,73 ± 0,22* |
7,80 ± 0,19** |
|
нопирина, (нмоль фор - |
||||||
мальдегида • мг -1•ìèí-1) |
|
|
|
|
|
|
n-ãидроксилирование |
|
|
|
|
|
|
анилина, (нмоль п - |
0,99 ± 0,07 |
0,41 ± 0,06 |
0,78 ± 0,08* |
0,75 ± 0,04* |
0,62 ± 0,03** |
|
аминофенола• мг - |
|
|
|
|
|
|
1•ìèí-1) |
|
|
|
|
|
|
*- Условия введения СС14 и фосфолипидных препаратов - как в подписях к рис 8.2.1. Через сутки после последнего введения фосфолипидов животных забивали, выделяли микросомы печени и определяли активность ферментов стандартными методами;
* - p < 0,01, ** p<0,05 по сравнению с нелеченными животными (без введения ФЛ) [7, 18].
Из данных, представленных в табл. 8.2.4, видно, что острый токсический гепатит, вызванный введением животным СС14, сопровождался снижением удельного содержания цитохрома Р450 в среднем на 55%, снижением N-деметилазной и n-гидроксилазной его активностей (на 55-60%), а также снижением активностей НАДФНцитохром с редуктазы и НАДН-феррицианидредуктазы на 45-50%. После введения ФХГК, ФХМ и эссенциале наблюдали повышение удельного содержания цитохрома Р450 (на 35%), активностей редуктаз в среднем на 25-30%. Причем, эффективность всех трех препаратов при такой схеме эксперимента оказалась примерно одинаковой.
8.2.4. Влияние смеси ФХГК на активность митохондриальных
ферментов клеток печени крыс с экспериментальным гепатитом.
Известно, что при повреждении клеток, вызванном действием различных агентов, одним из универсальных этапов является
249
Таблица 8.2.5.
Активность ферментов митохондрий печени крысы при введении СС14 и их восстановление фосфолипидными препаратами
|
|
Сукцинатдегидрогеназа |
Цитохромоксидаза |
|
|
|
(нмоль Ч мин-1 × ìã-1) |
(нмоль Ч мин-1 × ìã-1) |
|
|
|
|
||
Здоровые животные |
12,3 ± 0,92 |
54,8 ± 3,36 |
||
|
|
|
||
Крысы, получавшие: |
4,6 ± 0,53 |
19,9 ± 1.17 |
||
ÑÑl4 |
|
|
|
|
ÑÑl4 |
+ ÔÕÃÊ |
7,0 ± 0,68* |
35,7 |
± 1.25* |
|
|
|
|
|
ÑÑl4 |
+ эссенциале |
5,8 ± 0,2 |
30,4 |
± 1.96* |
|
|
|
|
|
Условия введения СС14 и фосфолипидных препаратов - как в подписи к таблице 8.2.3. Через сутки после последнего введения животных забивали, выделяли митохондрии печени и определяли активность ферментов стандартными методами [33].
* - р< 0.05 по сравнению с величинами для животных, отравленных СС14.
нарушение энергетических функций митохондрий [30] (см. главу 4). Так, в препаратах митохондрий печени крыс с экспериментальным гепатитом, индуцированным введением СС14, наблюдалось резкое, более, чем в 2 раза, снижение активности ферментов дыхательной цепи, локализованных во внутренних митохондриальных мембранах, - сукцинатдегирогеназы и цитохромоксидазы, что свидетельствует о глубоком повреждении внутриклеточных мембранных систем [31, 32]. В связи с этим нами исследовано влияние наноэмульсии ФХГК на активность ферментов митохондрий печени крыс с экспериментальным гепатитом (индуцированным введением СС14) (òàáë. 8.2.5.).
Установлено, что при введении как ФХГК, так и эссенциале возрастала активность цитохромоксидазы, а сукцинатдегидрогеназы - только при действии ФХГК.
Таким образом, фосфолипидная смесь ФХГК способна восстанавливать также и активность ферментов митохондрий, хотя и не столь эффективно, как ферментов микросомальных мембран. Необходимо отметить, что in vitroдлямикросомальногоцитохромаР450введениеэссенциалеоказывало даже повреждающее действие, усугубляя вызванное гепатотоксином повреждениемембраны,втовремякакinvivoэффектыФХГКиэссенциале были сопоставимы.
8.2.5. Влияние смеси ФХГК на гемолиз эритроцитов.
Полученные нами данные о стабилизирующем и репарирующем действии смеси ФХГК на мембраны ЭР позволили предположить возможность аналогичного действия на другие биомембраны,
250
