
9.4. Распределение компонентов фосфоглива - ГК и СФХ - в организме.
Как было отмечено (см. главы 6, 7), компоненты фосфоглива, СФХ и ГК, каждый в отдельности представляют собой давно используемые в медицине соединения, с изученной фармакокинетикой и фармакодинамикой [2, 19, 21 - 23, 28]. Но фосфоглив является единственной композицией, где эти компоненты присутствуют вместе. Поэтому было интересно исследовать фармакокинетику этих соединений в составе препарата. Вполне возможно, что технология получения фосфоглива окажет влияние на фармакокинетику его компонентов. Изучение распределения в организме СФХ представляет собой достаточно трудную задачу из-за его сходства с эндогенным ФХ, высокой распространенностью в организме и т.д. (см. главу 1). Определение ГК и ее метаболитов в биологических образцах методом ВЭЖХ не представляет особых сложностей. Ее метаболизм в организме крысы происходит в среднем за 70 часов [24]. Поэтому о распределении фосфоглива судили, исследуя содержание ГК и ее метаболита глицирретовой кислоты (ГТ) в сыворотке крови и тканях. Фосфоглив вводили в хвостовую вену в дозе, соответствующей 50 мг/кг веса ГК и 125мг/кг СФХ. Определение ГК и ГТ в образцах проводили методом ВЭЖХ (рис. 9.4.1).
По данным рисунка 9.4.1 концентрация ГК в крови и тканях резко снижается в течение первых 2-х часов после введения, что согласуется с данными Tsai с соавт. [25], полученными при внутривенном введении крысам аналогичного количества свободной ГК. Однако, если при введении свободной ГК через 1,5 часа определить ее содержание в плазме уже невозможно из-за предельно низкой концентрации [23], то при
введении фосфоглива мы наблюдали постепенное снижение концентрации ГК в крови, а в концентрации 3 мкг/мл она определялась даже через 72 часа после введения. Следовательно, включение ГК в фосфолипидные наночастицы пролонгирует ее циркуляцию в крови.
Неожиданным оказалось быстрое появление в сыворотке в достаточно высокой концентрации ее метаболита - ГТ, дальнейшая элиминация которой происходит параллельно с ГК. В литературе этот феномен не был описан. Исследователи отмечают появление глицирретовой кислоты в крови только в случае перорального введения ГК, как результат гидролиза последней ферментами исключительно кишечной микрофлоры [26]. Появление ГТ в крови рассматривают как результат ее вторичного всасывания после секреции ГК в желчь и связывают с ее высокой биологической активностью.
Необходимо отметить, что в работе Takeda с соавт. [27], изучавшими распределение ГК в организме, при сравнении перорального и внутривенного его введения, также наблюдали
281
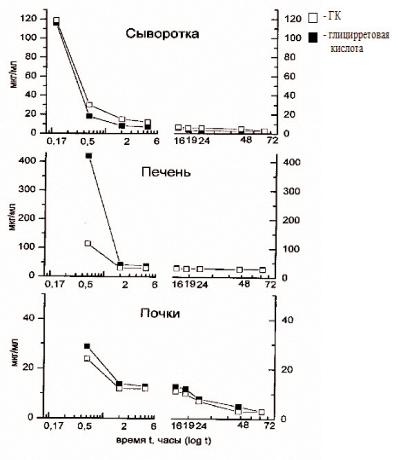
Рис. 9.4.1. Динамика изменения содержания ГК и глицирретовой кислоты в сыворотке крови, печени и почках крыс после в/венного введения фосфоглива
Фосфоглив вводили крысам в хвостовую вену в количестве соответствующем 50 мг/кг веса ГК или 125мг/кг СФХ. Через указанные на рисунке промежутки времени животных декапитировали. В сыворотке крови и образцах тканей печени и почек определяли содержание глицирризиновой кислоты (ГК) и глицирретовой кислоты (ГТ) методом ВЭЖХ (колонка С-18, регистрация при 258 нм); даны средние результаты по трем измерениям.
появление глицирретовой кислоты в сыворотке крови практически сразу же после внутривенного введения ГК. Этот факт авторы объяснили "биотрансформацией ГК в организме", обусловленной гидролизом в печени крысы с помощью β-глюкуронидазы до ГТ
282
через моноглюкуронид. Последний затем медленно гидролизуется до ГТ.
В проведенных нами экспериментах, через 30 минут после введения 50 мг/кг ГК в составе фосфоглива существенная ее часть (420 мкг/г) и часть глицирретовой кислоты (115 мкг/г) были обнаружены в печени. Можно предположить, что СФХ, присутствующий в фосфогливе, влияет на метаболизм этих соединений, увеличивая поступление ГК в печень.
Низкий уровень ГК и ГТ в течение всего эксперимента сохранялся в почках, что согласуется с данными о низком выведении этих соединений с мочой при в/в введении ГК крысам [24].
9.5. Токсикологические исследования фосфоглива.
Фосфоглив исследовали в экспериментах на острую и хроническую токсичность, мутагенность, канцерогенность и эмбриотоксичность. Эксперименты проводились согласно современным требованиям к фармацевтическим препаратам [29] в Российском кардиологическом научно-производственном комплексе МЗ СР РФ, в лаборатории лекарственной токсикологии под руководством профессора Е. В. Арзамасцева.
При токсикологическом изучении фосфоглива было отмечено, что препарат в диапазоне испытанных доз 1400-35000 мг/кг при однократном внутрижелудочном введении мышам BALB/C и крысам Wistar не вызывал видимых признаков интоксикации и гибели животных. При этом испытанные дозы препарата в 14-350
раз превышали среднесуточную лечебную дозу, рекомендованную для человека. Поэтому при данном способе однократного введения фосфоглива лабораторным животным средне-смертельные дозы (LD50) не удалось установить.
Отмечено отсутствие хронической токсичности при внутривенном введении собакам препарата в дозе 1000 мг/кг. При этом наблюдались положительные метаболические эффекты - повышение экскреторной функции печени, снижение содержания холестерина и триглицеридов плазмы крови. Отсутствие влияния длительного введения фосфоглива на функциональное состояние важнейших органов и систем собак подтверждено результатами патоморфологических исследований, показавших отсутствие токсических повреждений внутренних органов, общих и местных токсико-аллергических реакций.
Отсутствие мутагенности и канцерогенности показано при внутриперитонеальном введении мышам:
- не отмечено хромосомных аберраций в клетках костного мозга
283
ïðè äîçå 1325 ìã/êã;
-не обнаружены мутации в штаммах сальмонеллы в пределах 25 мг на чашку Петри (тест Эймса);
-не обнаружено повреждений ДНК при "SOS-хромотесте";
-в пределах концентраций до 450 мг/кг не отмечено влияния на доминантные летальные мутации в зародышевых клетках.
Тератогенность и эмбриотоксичность отсутствовали при внутрибрюшинном введении фосфоглива крысам в дозе 80 мг/кг.
Исследования аллергических и иммунотоксических свойств препарата показали, что аллергические реакции отсутствовали, не установлена дегрануляция жировых клеток. Препарат в дозах, не превышающих 125 мг/кг, не влиял на первичные иммунные реакции, не вызывал гиперчувствительность замедленного типа.
Полученные результаты по выраженному специфическому гепатопротекторному действию фосфоглива при экспериментальных гепатитах, а также по отсутствию токсичности
èнегативных воздействий на клетки, послужили основанием для получения разрешения Фармакологического Государственного комитета РФ на его клинические испытания (протокол ¹11 от 4.07.96).
СПИСОК ЛИТЕРАТУРЫ К ГЛАВЕ 9.
1.Martin G.P., el-Hariri L.M., Marriott C. Bile saltand lysophos- phatidylcholine-induced membrane damage in human erythrocytes. J Pharm Pharmacol. 1992, 44, 646-650.
2.Oette K. On the administration of phosphatidylcholine - metabolic and pharmacokinetic aspects in human. In: 50th Anniversary of Phospholipid Research (EPL). Ed. Gundermann K.-J., Schumacher R., wbn-Verlag, Bingen/Rhein, 1990, 35-48.
3.Gross KJ., Pogo AO. Control of ribonucleic acid synthesis in eukaryotes. 2. The effect of protein synthesis on the activities of nuclear and total DNA-dependent RNA polymerase in yeast. Biochemistry. 1976, 15, 2070-2081.
4.Carpentier I., Coornaert B., Beyaert R. Function and regulation of tumor necrosis factor type 2. Curr Med Chem. 2004, 11, 2205-2212.
5.Trinchieri G. Regulation of tumor necrosis factor production by monocyte-macrophages and lymphocytes. Immunol Res. 1991, 10, 89103.
6.Medvedev A.T., Fuchs B.B., Rachmilevich A.L. A study of the action of immunosuppressive factors from tumour cells on lymphocytes and macrophages in vitro and on the graft-versus-host reaction in mice. Biomed Sci. 1990, 1, 261-266.
7.Weber L.W., Boll M., Stampfl A. Hepatotoxicity and mechanism
284
of action of haloalkanes: carbon tetrachloride as a toxicological model. Crit Rev Toxicol. 2003, 33, 105-136.
8.Ипатова О. М., Торховская Т. И., Княжев В. А., Карузина И. И., Бачманова Г. И., Гусева М. К., Арчаков А. И. Сравнительное исследование действия эссенциале и нового отечественного гепатопротектора "Фосфолив" на модели острого гепатита у крыс. Вопр мед химии. 1998, 44, 544-550.
9.Подобед О.В., Федорова Л.М., Якушева И.В., Абакумова О.Ю., Цветкова Т.А., Ковалева Г.Г. Гаврильчак А.В. Шехтер А.Б. Влияние фосфатидилхолина на репарационные процессы в клетках печени при ее остром поражении СС14. Вопр мед химии, 1995, 41, 13-16.
10.Weignand K., Muller M., Urban J., Schreiber G. Intact endoplasmic reticulum and albumin synthesis in rat liver cell suspensions. Exp Cell Res. 1971, 67, 27-32.
11.Tomasi A., Albano E., Banni S., Botti B., Corongiu F., Dessi M.A., Iannone A., Vannini V., Dianzani M.U. Free-radical metabolism of carbon tetrachloride in rat liver mitochondria. A study of the mechanism of activation. Biochem J. 1987, 246, 313-317.
12.Levy G.H., Brabek M.J. Binding of carbon tetrachloride metabolites to rat hepatic mitochondrial DNA. Toxicol Lett. 1984, 22, 229-234.
13.Sawyer D.E., van Houten B. Repair of DNA damage in mitochondria. Mutat Res. 1999, 434, 161-176.
14.Газиев А.И., Подлутский А.Я. Низкая эффективность системы репарации ДНК в митохондриях. Цитология. 2003, 45, 403-417.
15.Подымова С.Д. Болезни печени. - М., Медицина. Изд. 2-å,
1993.
16.Шерлок Ш., Дули Дж. Заболевания печени и желчных путей. Москва, ГЭОТАР Медицина, 1999.
17.Ипатова О.М., Торховская Т.И., Княжев В.А., Карузина И.И., Бачманова Г.И., Гусева М.К., Арчаков А.И. Торможение с помощью нового гепатопротекторного препарата "Фосфоглив" развития хронического гепатита у крыс. Вопр мед хим. 1998, 44, 537-543.
18.Подобед О.В., Федорова Л.М., Абакумова О.Ю., Якушева И.В., Цветкова Т.А., Гаврильчак А.В. Шехтер А.Б., Карякин А.В. Исследование гепатозащитных свойств препарата фосфолив, содержащего фосфатидилхолин из семян подсолнечника и глицирризиновую кислоту, на модели цирроза печени крыс. Бюлл эксп биол мед. 1997, 124, 311-314.
19.Gundermann K.-J. The "essential" phospholipids as a membrane therapeutic. Szczecin, 1999.
20.Kuntz E. "Essentielle" Phospholipide in der hepatologie - 50 Jahre Åxperimentale und Klinische Erfahrung. Z Gastroenterol. 1991,
285
29, 7-13.
21.Zierenberg O. Intestinal absorption of polyenephosphatidylcholine in man. J Lipid Res. 1982, 23, 1136-1142.
22.van Rossum T.G., Vulto A.G., de Man R.A. et al. Review article: Glycyrrhizin as a Potential Treatment of Chronic Hepatitis C. Aliment Pharmacol Ther. 1998, 12, 199-205.
23.Ploeger B., Mensinga T., Sips A., Seinen W., Meulenbelt J., DeJongh J. The pharmacokinetics of glycyrrhizic acid evaluated by physiologically based pharmacokinetic modeling. Drug Metabolism Review. 2001, 33, 125-147.
24.Ichikawa T., Ishida S., Sakiya Y., Akada Y. High performance liquid chromatographic determination of Glycyrrhizin and Glycyrrhetinic acid in biological materials. Chem Pharm Bull. 1984, 32, 3734-3738.
25.Tsai T.H., Liao J.F., Shum A.Y., Chen C.F. Pharmacokinetics of Glycyrrhizin after intravenous administration to rats. J Pharm Sci. 1992, 81, 961-963.
26.Akao T. Localization of enzymes involved in metabolism of glycyrrhizin in contents of rat gastrointestinal tract. Biol Pharm Bull. 1997, 20, 122-126.
27.Takeda S., Ishthara K., Wakui Y., Amagaya S., Maruno M., Akao T., Kobashi. Bioavailability study of glycyrrhetic acid after oral administration of glycyrrhizin in rats; relevance to the intestinal bacterial hydrolysis. J Pharm Pharmacol. 1996, 48, 902-905.
28.Hîlzl J. Pharmacokinetic studies on phosphatidylcholine and phosphatidylinositol. In: Phosphatidylcholine - biochemical and clinical aspects of essential phospholipids. H.Peeters ed., Springer Press, Berlin - Heidelberg - New York, 1976, 66-79
29.Белоусов Ю.Б., Моисеев В.С., Лепахин В.К. Клиническая фармакология и фармакотерапия. Руководство для врачей., M., 1997.
286
ГЛАВА 10. КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ ПРЕПАРАТА ФОСФОГЛИВ.
10.1. Обоснование клинического использования препарата фосфоглив
Клинические испытания фосфоглива проводились, в первую очередь, на больных с заболеваниями печени, в основном с различными формами гепатитов, для лечения которых и разрабатывался данный препарат.
Известно, что наиболее распространенным способом лечения вирусных гепатитов является терапия интерфероном (ИФН). Однако она оказывается эффективной только у 40-60% больных, а в случае развития цирроза эта цифра оказывается менее 20% [1, 2]. Ряд исследователей отмечают, что несмотря на улучшение состояния, все же у более 50% [3] или 60% [4] больных гепатитом С стандартная терапия интерфероном или не дает результатов, или невозможна из-за высокого риска развития побочных эффектов. В других исследованиях [5, 6] указывается, что на ИФН-терапию вообще отвечает около 20% больных [5, 6]. При резком повышении дозы интерферона их количество увеличивается до 30% [7], при комбинации с рибавирином - до 35-37% [8-10] и почти до 55% при использовании, так называемого, пэгилированного (ПЭГ) интерферона [6]. В других исследованиях [11, 12] приводится более высокий процент больных, отвечающих на комбинированную терапию ПЭГ-интерфероном в комбинации с рибавирином. Однако все авторы обращают особое внимание на необходимость при этом очень тщательного исследования риска возникновения и
развития побочных эффектов [3, 6, 12]. При лечении гепатита В положительный эффект терапии интерфероном обнаружен у 33% больных, из которых у 13% наблюдалась повторная реактивация вируса после окончания лечения [13].
Таким образом, устойчивость значительного числа больных к такому виду лечения, наряду с риском побочных эффектов его новых комбинированных форм, обуславливает необходимость поиска других, более эффективных средств для лечения гепатитов [14].
Препараты на основе ГК приобретают в последние годы все большую популярность при лечении гепатитов, и среди них - неоминофаген С, разработанный в Японии и применяемый в клинике уже более 30 лет [15, 16]. Особую эффективность этого препарата отмечают при лечении хронических гепатитов [14-23]. Считают, что терапевтическую эффективность его применения обуславливают противовирусные и иммуномодулирующие свойства ГК, а также способность к индукции γ-интерферона [24-26]. Определенный вклад в эффективность ГК вносят ее
287
антиоксидантные свойства, а также способность повышать детоксицирующую активность печени [27-29]. Обладая противовоспалительным действием, ГК подавляет репродукцию вируса в печени и других органах за счет стимуляции синтеза интерферона, повышения фагоцитоза, увеличения активности естественных киллеров и др. (см. главу 7).
Как было показано выше, СФХ обладает способностью восстанавливать целостность клеточных мембран (см. главу 6). Испытания эффективности СФХ, в том числе и в составе эссенциале, были проведены в общей сложности в более чем 170 исследованиях, включая 18 двойных "слепых", на нескольких тысячах пациентов с различными заболеваниями печени, такими, как острый и хронический вирусные гепатиты, ожирение печени, алкогольные, токсические и лекарственные поражения печени, цирроз и др. [30 - 35]. Результаты этих исследований свидетельствуют о том, что СФХ способствует:
-нормализации субъективных симптомов заболеваний, клинических проявлений и биохимических показателей;
-уменьшению воспалительных реакций, некроза печеночных клеток, снижению жировых инфильтраций, клеточной дистрофии
èфиброгенеза;
-ускорению сероконверсии HBsAg при острых вирусных гепатитах;
-сокращению сроков госпитализации.
Показано эффективное действие СФХ на больных гепатитом С [36]. Недавно установлено, что в поврежденной алкоголем печени СФХ
препятствует повышению экспрессии цитохрома CYP2E1, вызывающего генерацию ацетальдегида и свободных радикалов, и подавляет фиброз [37].
Являясь основным структурным компонентом биологических мембран, СФХ встраивается в них, восстанавливая структуру и функции поврежденных мембран гепатоцитов, целостность клеток и уберегает их от необратимых некротических повреждений. СФХ способствует нормализации белкового, липидного и жирового обменов, восстанавливает детоксикационную функцию печени, ингибирует формирование соединительной ткани в печени, снижает риск возникновения фиброза и цирроза [32, 35].
Результаты доклинических исследований и анализ данных литературы о механизмах действия ГК и СФХ позволили предположить, что разработанный новый отечественный препарат фосфоглив, должен сочетать в себе эффекты неоминофагена С, эссенциале и интерферонотерапии при лечении гепатитов, а также ряда других заболеваний печени, связанных с нарушением нормального функционирования этого органа.
288

Фосфоглив выпускается в двух лекарственных формах - капсулы и лиофилизированный порошок для внутривенных инъекций.
Проведенные доклинические исследования, показавшие гепатопротекторную активность фосфоглива на моделях острого и хронического гепатита с элементами цирроза, проявляющуюся в стимуляции процессов восстановления синтеза белка и мРНК в поврежденных клетках печени и нормализации морфологии печени (см. главу 9), послужили основанием для исследования клинической эффективности препарата.
Отчеты о ходе клинических испытаний капсульной и инъекционной форм препарата фосфоглив представлены академиком РАМН Покровским В.И., академиком РАМН Учайкиным В.Ф., академиком РАМН Хаитовым Р.М., академиком РАМН Ивашкиным В.Т., академиком РАМН Сторожаковым Г.И., членкорр. РАМН О.А. Дунаевским, профессорами Лучшевым В.И., Чешиком С.Г., Альтшулером В.Б., Гальпериным Э.И., Бутовым Ю.С., Маяковой С.А. и др. Все исследования выполнены в соответствии с протоколом клинических испытаний, разработанным академиком РАМН Учайкиным В.Ф.
Лечение капсульной и инъекционной формами фосфоглива были проведены на более чем 400 больных с различными видами и с различной степенью выраженности печеночной недостаточности (табл.10.1.1).
Таблица 10.1.1.
Группы больных, получавших лечение фосфогливом
Заболевания |
Число больных, |
Число больных в |
|
получавших |
|||
контроле |
|||
|
фосфоглив |
||
|
|
||
Острый гепатит В (ВГВ) или ВГ(В+С) |
87 |
75 |
|
|
|
|
|
Хронический гепатит (ХГ) С, В, ХГ(С + B) |
126 |
73 |
|
|
|
|
|
Диффузные заболевания печени (жировой, |
|
|
|
лекарственный, алкогольный и |
82 |
32 |
|
диабетический гепатозы, гиперлипидемия и |
|||
|
|
||
äð.) |
|
|
|
Заболевания кожи, ассоциированные с |
35 |
40 |
|
вторичными дислипидемиями (псориаз, |
|||
|
|
||
экзема, нейродермит и др.) |
|
|
|
|
|
|
|
Онкологические больные с вирусным |
31 |
10 |
|
гепатитом В и токсическим поражением |
|||
|
|
||
печени |
|
|
|
Калькулезный холецистит |
32 |
6 |
|
|
|
|
|
Острый гепатит А у детей |
12 |
14 |
|
|
|
|
|
Острый гепатит В у детей |
15 |
13 |
|
|
|
|
|
Всего |
410 |
249 |
|
|
|
|
289

10.2. Применение капсульной формы препарата фосфоглив.
Исследования клинической эффективности лекарственного препарата фосфоглив при лечении заболеваний печени различной этиологии были начаты в 1998 году с испытания капсульной формы [38-44].
В частности, 19 больных с острым вирусным гепатитом В (ВГ В) со средне-тяжелыми формами заболевания на фоне базисной терапии получали капсулы фосфоглив (по 2 капс. 3 раза в день) в течение 30 дней. Контрольная группа, состоящая из 10 больных, получала только базисную терапию (глюконат кальция, аскорутин, мезим форте и т.д.). Исследования показали, что включение капсул фосфоглива в терапию больных с острым вирусным гепатитом в целом ускоряло исчезновения клинических симптомов интоксикации (тошнота, анорексия и т.д.) и приводило к сокращению общего количества "койко-дней". Фосфоглив улучшал и биохимические показатели сыворотки крови, являющиеся обычно индикаторами состояния печени (таблица 10.2.1).
Таблица 10.2.1. Динамика изменений биохимических показателей, маркеров
состояния печени, в сыворотке крови больных ОГВ при лечении фосфогливом [38]
Показатель |
Лечение фосфогливом |
Базисная терапия |
|||
|
|
|
|
|
|
|
До лечения |
|
Äî |
После лечения |
|
|
После лечения |
лечения |
|||
|
|
|
|||
|
|
|
|
||
|
|
|
|
|
|
ÀëÀÒ, åä/ë |
1600 + 162 |
530 + 38* |
1450 + 170 |
710 + 64 |
|
|
|
|
|
|
|
ÀñÀÒ, åä/ë |
995 + 13 |
280 + 94 |
1522 + 163 |
296 + 40 |
|
|
|
|
|
|
|
Билирубин (общий) |
118 + 3,9 |
44+ 2,1* |
122 + 4,1 |
80 + 3,4 |
|
мкмоль/л |
|||||
|
|
|
|
||
Отличия между показателями в группах больных, получавших комплексную терапию с фосфогливом и базисную терапию (* р < 0,05); активность ферментов (АлАТ, АсАТ) измерялась в нмоль/сек-1ë-1 .
Как видно из таблицы 10.2.1, активность АлАТ, исходно повышенная почтинапорядокпосравнениюснормой,снизиласьпослелечениявобеих группах больных. Однако снижение было выражено в большей степени у больных, получавших фосфоглив. Активность АсАТ снизилась в обеих группах одинаково. Наиболее выраженным оказалось действие фосфоглива на уровень билирубина. Для больных контрольной группы исходный его уровень, превышавший в несколько раз нормальные величины, снизившись в 1,5 раза, далее не менялся, а у больных, получавших фосфоглив, продолжал снижаться; к концу лечения уровень билирубина у этих больных был вдвое ниже, чем при использовании базисной терапии [38].
290
