
Анализ результатов исследований влияния ССl4 на компоненты электрон-транспортных систем показывает, что наиболее чувствительным к действию данного яда является цитохром Р450. Другие компоненты монооксигеназной системы, НАДФНзависимые редуктазы, изменяются в гораздо меньшей степени. Снижение содержания цитохрома Р450 у животных, отравленных ССl4, наступает очень быстро и хорошо коррелирует с падением его деметилазной активности. Такое повреждающее действие на цитохром Р450 зависит от прооксидантного эффекта ССl4, о чем свидетельствует параллельное нарастание содержания продуктов перекисного окисления липидов [30 - 33].
Однако, кроме этого механизма, доказана возможность инактивации цитохрома Р450 вследствие прямого воздействия на него продуктов метаболизма этого яда. Так, было показано, что антиоксиданты, препятствуя развитию в печени некроза и жировой дистрофии, не предотвращают уменьшение содержания цитохрома Р450 и глюкозо-6-фосфатазы - ферментов, которые первыми подвергаются действию данного яда. В то же время SKF 525A - наиболее типичный ингибитор микросомального гидроксилирования и метаболизма ССl4 - оказывает выраженное защитное действие на цитохром Р450, но гораздо меньшее - на некроз и жировую инфильтрацию. Эти данные можно объяснить тем, что действие тетрахлорметана связано не только с образованием высокореакционных липидных перекисей, но и с прямым влиянием метаболитов ССl4, и, в первую очередь, ССl•3 радикала на мембранные ферменты [38, 40, 46].
Таким образом, повреждение мембран ЭР печени и их ферментных систем при отравлении ССl4 является примером патологии, при которой образующиеся в микросомальной монооксигеназной системе свободнорадикальные продукты вызывают нарушения липидного и белкового компонента мембран, вследствие чего нарушается и активность всей монооксигеназной системы. Нарушение активности монооксигеназной системы в свою очередь приводит к дисфункции мембранных внутриклеточных структур гепатоцитов, включая митохондрии, что усиливает повреждение клетки в целом [47] (см. главу 4).
Возможность повреждающего действия метаболитов, образующихся на цитохроме Р450, показана и для другого гепатотропного яда - гелиотрина, который, попадая с зерном хлебных злаков в пищу человека и животных, может вызывать тяжелые генерализованные отравления и поражения отдельных органов и систем, особенно печени. В экспериментах на животных было установлено, что введение гелиотрина сопровождается
201
развитием токсического гепатита, а при хроническом отравлении - цирроза печени, что связано, как и в случае с ССl4, с повреждением цитохрома Р450 [48]. Под действием гелиотрина наблюдалось снижение НАДФН-зависимой скорости окисления различных субстратов этого фермента [39, 48]. Результаты свидетельствуют о том, что при отравлении гелиотрином, так же как и ССl4, происходит повреждение мембран эндоплазматического ретикулума, что сопровождается потерей ими функциональной активности. Гелиотрин связывается с цитохромом Р450, с высокой спектральной константой сродства (Кs = 35 мкМ). При этом происходит увеличение активности ПОЛ в мембранах микросом печени отравленных животных [39]. Следовательно, стимуляция гелиотрином процессов ПОЛ мембран может быть одним из механизмов повреждения мембран ЭР и его ферментных систем. Аналогичные результаты были получены и при изучении действия фенобарбитала - индуктора цитохрома Р450 [49].
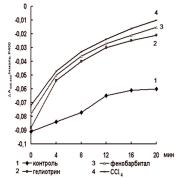
Данные о влиянии ССl4, гелиотрина и фенобарбитала, введенных крысам, на скорость инактивации цитохрома Р450 с превращением его в цитохром Р420 приведены на рис. 6.2.2.
Крысам-самцам (n=4 в каждой группе) вводили внутрибрюшинно CCl4 по 0,1 мл/100 г массы, или гелиотрин по 20 мг/100 г, или в течение трех дней фенобарбитал по 8 мг/кг. Через 24 часа животных забивали, выделяли фракцию микросом печени [49]. Регистрировали дифференциальные спектры поглощения цитохрома Р450 при 37îС [52]. Инкубационная смесь содержала 0,3 нмоль цитохрома Р450 в 1 мл 100 мМ трис-НСl буфера, рН 7,4. Об инактивации цитохрома Р450 судили по повышению оптической плотности его карбоксикомплекса при 420 нм. Медленное возрастание величины ∆À(420 - 450)/нмоль Р450 в микросомах контрольных животных (кривая 1) свидетельствует о стабильности цитохрома Р450 в неповрежденных микросомальных мембранах.
Здесь и далее (за исключением особо оговоренных случаев) ошибка средней не превышала 5%.
Рис. 6.2.2. Влияние введеного крысам ССl4, гелиотрина и фенобарбитала на скорость инактивации цитохрома Р450
Отчетливо видно, что при инкубации изолированных микросом печени при температуре 37°С наблюдается образование неактивной формы фермента - цитохрома Р420. Скорость инактивации фермента у животных, получавших ССl4, гелиотрин и фенобарбитал, во много раз выше по сравнению с контрольными.
Таким образом, во всех случаях отравления
202
гепатотропными ядами инактивацию цитохрома Р450 следует рассматривать как показатель процессов повреждения мембран. Метод измерения скорости инактивации цитохрома Р450 был в дальнейшем использован для мониторинга процесса восстановления поврежденных мембран ЭР фосфолипидами [50]. Использование этого теста оказалось перспективным при исследовании влияния различных лекарственных соединений на монооксигеназную систему и на мембраны ЭР [51].
Необходимо отметить, что изучение молекулярных механизмов повреждения ЭР, взаимосвязи повреждения фосфолипидного компонента с сопутствующей инактивацией мембранных ферментов создало реальные предпосылки для поиска факторов, способствующих восстановлению структуры и функции поврежденных мембран.
С помощью описанного выше метода оценки скорости инактивации цитохрома Р450 было доказано, что липидный бислой оказывает стабилизирующее действие на активность этого гемопротеина. В частности, обнаружено, что скорость инактивации восстановленного цитохрома Р450 резко замедляется при встраивании его в искусственный бислой, сформированный из ФХ или из смеси микросомальных фосфолипидов. Наиболее стабильным данный фермент был в присутствии везикул, приготовленных из фосфолипидов мембран микросом [28, 52].
Исходя из необходимости ФЛ для активности ряда мембранных ферментов, были проведены эксперименты по их использованию для репарации поврежденных мембран ЭР. Мембрано-репарирующее действие ФЛ оценивали по их способности замедлять инактивацию цитохрома Р450.
Оказалось, что инкубация микросом из печени крыс, подвергнутых действию четыреххлористого углерода или гелиотрина, с фосфатидилхолиновыми липосомами приводит к резкому замедлению скорости инактивации данного гемопротеина (рис. 6.2.3) [51]. Как видно из рисунка, преинкубация микросом выделенных из печени крыс, отравленных ССl4 (А) или гелиотрином (Б), с липосомами почти в 2 раза замедляла скорость инактивации цитохрома Р450.
Подобным эффектом обладали также липосомы, приготовленные из смеси микросомальных ФЛ. Более того, инактивированный после экстракции фосфолипидов
203

Рис. 6.2.3. Действие in vitro фосфолипидов на инактивацию цитохрома Р450 микросом печени крыс, отравленных ССl4 (А) и гелиотрином (Б).
Крысам-самцам (n=4 в каждой группе) вводили внутрибрюшинно CCl4 по 0,1 мл/100 г массы, или гелиотрин по 20 мг/100 г, или в течение трех дней фенобарбитал по 8 мг/кг. Через 24 часа животных забивали, выделяли фракцию микросом печени [49]. Микросомы преинкубировали с ФЛ в форме липосом, 5 мг ФЛ/нмоль цитохрома Р450, 60 минут при 4îС. Регистрировали дифференциальные спектры поглощения цитохрома Р450 при 37îС [52]. Инкубационная смесь содержала 0,3 нмоль цитохрома Р450 в 1 мл 100 мМ трис-НСl буфера, рН 7,4. Об инактивации цитохрома Р450 судили по повышению оптической плотности его карбоксикомплекса при 420 нм. Медленное возрастание величины ∆À(420-450)/нмоль Р450 в микросомах контрольных животных (кривая 1) свидетельствует о стабильности цитохрома Р450 в неповрежденных микросомальных мембранах [51, 52].
цитохром Р450 микросом, восстанавливал свою активность
при добавлении смеси микросомальных ФЛ или ФХ [51]. Мембраны ЭР могут быть восстановлены фосфолипидами
не только при инкубации выделенных микросом in vitro, но и при их введении животным. Как видно из представленных графиков (рис 6.2.4), трехкратное внутрибрюшинное введение ФЛ крысам, отравленным гепатотропными ядами, приводит к выраженному замедлению инактивации фермента, что особенно наглядно проявляется при отравлении ССl4. Хотя скорость инактивации у получавших ФЛ животных не возвращалась полностью к нормальному уровню, но она вдвое снизилась по сравнению с таковой у не леченных животных. В основе этого эффекта лежит
репарация поврежденных ССl4 мембран фосфолипидами. Таким образом, ФЛ, и, в частности, ФХ, обладают
репарирующими свойствами и, взаимодействуя с цитохромом Р450, стабилизируют и его, и саму мембрану, что снижает скорость инактивации фермента. Приведенные результаты позволяют считать этот класс соединений перспективным для репарации
204

Рис. 6.2.4. Влияние фосфолипидов in vivo на инактивацию цитохрома Р450 микросом печени крыс, отравленных CCl4 (А) или гелиотрином (Б)
Крысам-самцам вводили внутрибрюшинно CCl4 по 0,2 мл/100 г массы (А), или гелиотрин по 30 мг/100 г (Б). Через 24 часа животным вводили внутрибрюшинно фосфолипиды в форме липосом в дозе 20 мг ФЛ/100 г, в течение трех дней. Через 24 часа после последнего введения животных забивали, получали фракцию микросом печени. Дифференциальные спектры поглощения карбоксикомплекса цитохрома Р450 в области 400-500 нм регистрировали в течение 20 минут при 37îС в среде, содержащей 0.33 нмоль цитохрома Р450/мл, и рассчитывали разницу между оптической плотностью активной и неактивной форм цитохрома [49, 52].
поврежденных мембран [28, 48, 51, 52].
На эффективность использования ФХ для репарации поврежденных мембран указывало и его позитивное влияние на активность других ферментов микросом печени крыс, отравленных ССl4 [44, 53]. Так, в экспериментах in vivo на модели повреждения мембран
эндоплазматического ретикулума ССl4 было установлено, что липосомы из яичного ФХ способствуют стабилизации липидного матрикса мембран, замедлению инактивации цитохрома Р450, нормализации его гидроксилазной активности, восстановлению активности глюкозо-6-фосфатазы. Уменьшение гиперферментемии в сыворотке крови при введении крысам, отравленным ССl4, липосом из ФХ указывало на снижение некротических процессов в печени [54, 55].
В целом, многочисленными исследованиями 60-х - 90-х годов на различных моделях гепатитов показано (1) активное включение введенного ФХ в мембраны гепатоцитов, (2) устойчивость таких обогащенных ФХ мембран к токсическим агентам (этанол, ССl4, органические растворители, высокожировой рацион и др), (3) снижение морфологических изменений в печени [51, 54-56].
Таким образом, ФЛ, в частности, ФХ, могут быть эффективными средствами для репарации поврежденных мембран. Как показали исследования, наиболее перспективными для репарации
205
поврежденных мембран гепатоцитов являются фосфолипиды растительного происхождения (соя, хлопчатник), содержащие в большом количестве линолевую кислоту [45, 48, 51, 52, 56].
К настоящему времени можно выделить несколько способов защиты мембранных белков и ФЛ гепатоцитов от различных повреждений. Первый из них включает применение антиоксидантной терапии. Второй предусматривает использование SH-содержащих соединений, и третий - использование собственно фосфолипидов для репарации липидного матрикса мембран и микроокружения мембранных ферментов. Следует отметить, что применение антиоксидантов и SH-содержащих соединений оказывает в основном протекторное действие, то есть они эффективны, когда SH-содержащие соединения и антиоксиданты вводятся до или вместе с ядом. Так как чаще всего при различных патологических состояниях мы имеем дело с уже поврежденными мембранами и ферментными системами гепатоцитов, то необходимость поиска препаратов, способствующих восстановлению структуры и функции уже поврежденных мембран очевидна. Несмотря на то, что в качестве гепатопротекторов в настоящее время используется ряд препаратов различных фармакологических групп, таких, как корсил, гептрал, легалон, гепатофальк, эссенциале и др., эффективность их остается невысокой, что оправдывает поиск новых соединений для восстановления структуры и функций поврежденных клеток печени.
Накопленные к настоящему времени данные о роли
биомембран в жизнедеятельности клетки и об универсальном характере повреждений мембран при широком спектре патологических состояний, позволяют предполагать, что:
1)репарация поврежденных мембран, независимо от повреждающего фактора, будет неспецифично приводить к нормализации клеточных функций;
2)такую неспецифичную "мембранную терапию" целесообразно включать в схему лечения многих заболеваний, в комбинации с соответствующей специфической терапией, направленной на прекращение данного патологического воздействия.
При этом наиболее универсальным мембрано-репарирующим агентом, способным восстанавливать локальные дефекты мембраны и тем самым восстанавливать ее функции и функции клетки в целом, являются именно фосфолипиды - как естественный структурообразующий и функциональный компонент всех биомембран, особенно необходимый для такого
органа как печень в силу ее уникальной (высокой)
206
регенерирующей способности [46].
С другой стороны, для практической медицины одной из актуальных задач является создание новых высокоэффективных лекарственных препаратов, в первую очередь, для лечения так называемых "социально-значимых" заболеваний, в частности, заболеваний печени, и прежде всего - вирусных гепатитов.
Каким же должно быть высокоэффективное лекарство для лечения вирусных гепатитов? С одной стороны, оно должно восстанавливать структуру и целостность поврежденных гепатоцитов, с другой - обладать противовирусной активностью. Если в отношении фосфолипидов как наиболее активных соединений, восстанавливающих структуру и функцию биомембран, на основании приведенных выше данных, сомнений не существует, то в отношении второго компонента лекарства, обладающего противовирусным эффектом, такого простого решения нет. Число соединений с противовирусным эффектом огромно [56]. Нами на основании детального анализа литературы, в качестве такового была выбрана глицирризиновая кислота, особенности свойств которой рассматриваются в следующей главе.
СПИСОК ЛИТЕРАТУРЫ К ГЛАВЕ 6
1.Tampo Y. Studies on membrane factors in iron-supported lipid peroxidation. Yakugaku Zasshi. 2000, 120, 387-396.
2.Владимиров Ю.А. Свободные радикалы в биологических системах. Соросовский образовательный журнал. 2000, 12, 13-19.
3.Jakus V. The role of nonenzymatic glycation and glyco-oxidation in the development of diabetic vascular complications. Cesk Fysiol. 2003, 52, 51-65.
4.Adachi J., Asano M., Ueno Y., Niemela O., Ohlendieck K., Peters T.J., Preedy V.R. Alcoholic muscle disease and biomembrane perturbations. J Nutr Biochem. 2003, 14, 616-625.
5.Netzel-Arnett S., Hooper J.D., Szabo R., Madison E.L., Quigley J.P., Bugge T.H., Antalis T.M. Membrane anchored serine proteases: a rapidly expanding group of cell surface proteolytic enzymes with potential roles in cancer. Cancer Metastasis Rev. 2003, 22, 237-258.
6.Salvemini D., Cuzzocrea S. Oxidative stress in septic shock and disseminated intravascular coagulation. Free Radic Biol Med. 2002, 33, 1173-1185.
7.Bergamini C.M., Gambetti S., Dondi A., Cervellati C. Oxygen, reactive oxygen species and tissue damage. Curr Pharm Des. 2004, 10, 1611-1626.
8.Palsdottir H., Hunte C. Lipids in membrane protein structures. Biochim Biophys Acta. 2004, 1666, 2-18.
207
9.Lee A.G. How lipids affect the activities of integral membrane proteins. Biochim Biophys Acta. 2004, 1666, 62-87.
10.Gelb M.H., Min J.H., Jain M.K. Do membrane-bound enzymes access their substrates from the membrane or aqueous phase: interfacial versus non-interfacial enzymes. Biochim Biophys Acta. 2000, 1488, 2027.
11.Бергельсон Л.Д. Мембраны, молекулы, клетки. Наука, М.
1982.
12.Кравцов А.В., Алексеенко И.Р. Механизмы регуляции векторных ферментов биомембран. Киев. 1990.
13.Bracey M.H., Cravatt B.F., Stevens R.C. Structural commonalities among integral membrane enzymes. FEBS Lett. 2004, 567, 159-165.
14.Asano Y., Kim J., Ogai A., Takashima S., Shintani Y., Minamino T., Kitamura S., Tomoike H., Hori M., Kitakaze M. A calcium channel blocker activates both ecto-5'-nucleotidase and NO synthase in HUVEC. Biochem Biophys Res Commun. 2003, 311, 625-628.
15.Grybauskas P. Role of tissue factor in atherothrombosis. Medicina (Kaunas). 2003, 39, 1165-1170.
16.Gundermann K.-J. The "essential" phospholipids as a membrane therapeutic. Publisher Polish Section of European Society of biochemical pharmacology. Szczecin. 1993.
17.Ивков В.Г., Берестовский Г.Н. Липидный бислой биологических мембран. Наука, М. 1982.
18.Hidalgo C., Ikemoto N., Gergely J. Role of phospholipids in the calcium-dependent ATPase of the sapcoplasmatic reticulum. J Biol Chem. 1976, 251, 4224-4232.
19.Hjelmstad R.H., Bell R.M. Molecular insights into enzymes of membrane bilayer assembly. Biochemistry. 1991, 30, 1731-1740.
20.Chanussot F., Benkoel L. Prevention by the dietary (n-6) polyunsaturated phosphatidylcholines of intrahepatic cholestasis induced by ciclosporine A in animals. Life Sci. 2003, 73, 381-392.
21.Ito M., Feng J., Tsujino S., Inagaki N., Inagaki M., Tanaka J., Ichikava K., Hartshorne D.J., Nakano T. Interaction of smooth muscle myosin phosphatase with phospholipids. Biochemistry. 1997, 36, 76077614.
22.Santini F., Chopra I.J., Solomon D.H., Chua Teco G.N. Evidence that the human placental monodeiodinase is phospholipid-requiring enzyme. J Clin Endocrinol Metab. 1992, 74, 1366-1371.
23.Imai T., Kageyama Y., Tobari J. Mycobacterium smegmatis malate dehydrogenase: activation of the lipid-depleted enzyme by anionic phospholipids and phosphatidylethanolamine. Biochim Biophys Acta. 1995, 1246, 189-196.
24.Yui S., Yamazaki M. Relationship of ability of phospholipids to
208
stimulate growth and bind to macrophages. J Leukocyte Biol. 1987, 41, 392-399.
25.Carman C.V., Barak L.S., Chen C., Liu-Chen L.-Y., Onorato J.J., Kennedy S.P., Caron M.G., Benovic J.L. Mutational analysis of Gbetagamma and phospholipid interaction with G protein-coupled receptor kinase 2. J Biol Chem. 2000, 275, 10443-10452.
26.Archakov A.I., Bachmanova G.I. Influence of phospholipid bilayer on structure and catalytic properties of cytochromes P-450 and b5. In: Microsomes, drug oxidation and drug toxicity. (Sato R., Kato R. eds). Japan Scientific Press, Wiley-Interscience Tokyo, N.-Y. 1982, 6774.
27.Арчаков А.И., Бородин Е.А. Инактивация цитохрома Р450 в мембранах микросом, поврежденных Fe-аскорбат-зависимым перекисным окислением липидов. Биологические науки. 1986, 5, 30-34.
28.Арчаков А.И., Бородин Е.А. Восстановление фосфолипидами мембран микросом, поврежденных Fе-аскорбат- зависимым перекисным окислением липидов. Биологические науки, 1986, 7, 30-35.
29.Àrchakov A.I., Bachmanova G.I. Cytochrome P450 and active oxygen. Taylor & Francis, London, New York, Philadelphia. 1990.
30.Арчаков А.И., Карузина И.И., Адрианов Н.В. Цитохром Р450
èокислительная модификация макромолекул. Вестник АМН
ÑÑÑÐ. 1990, 2, 21-27.
31.Карузина И.И., Арчаков А.И. Цитохром Р450. В кн: Белки и пептиды (Иванова В.Т., Липкина В.М. ред.) Наука. М. 1995, 7-29.
32.Karuzina I.I., Archakov A.I. The oxidative inactivation of cytochrome P450 in monooxygenase reactions. Free Radic Biol Med. 1994, 16, 73-97.
32.Karuzina I.I., Archakov A.I. Hydrogen peroxide-mediated inactivation of microsomal cytochrome P450 during monooxygenase reactions. Free Radic Biol Med. 1994, 17, 557-567.
34.Карузина И.И., Бачманова Г.И., Арчаков А.И. Самоинактивация цитохрома Р450 в каталитическом цикле. Вестник РАМН. 1995, 2, 17-29.
35.Archakov A. I., Karuzina I. I., Petushkova N.A, Lisitsa A. V., Zgoda V. G. Production of carbon monoxide by cytochrome P 450 during iron-dependent lipid peroxidation. Toxicol In Vitro. 2002, 16, 1-10.
36.McLean A.E. Effect of hexane and carbon tetrachloride on microsomal cytochrome (P450). Biochem Pharmacol. 1967, 16, 20302033.
37.Владимиров Ю.А., Арчаков А.И. Перекисное окисление липидов в биологических мембранах. Наука, М. 1972.
209
38.Арчаков А.И., Карузина И.И. Молекулярные механизмы взаимодействия четыреххлористого углерода с мембранами эндоплазматического ретикулума печени. Усп гепатологии. 1973, 7, 39-59.
39.Савин И.Г., Бачманова Г.И., Карузина И.И., Скоцеляс Е.Д., Антонова Г.Н., Жирнов Г.Ф., Карякин А.В., Арипов А.Н., Арчаков А.И. Влияние гелиотрина на систему микросомального окисления печени крыс. Вопросы мед химии. 1983, 29, 49-52.
40.Reiner O., Uehleke H. Bindung of carbon tetrachloride to reduced microsomal cytochrome P-450 and to heme. Hoppe Seylers Z Physiol Chem. 1971, 352, 1048-1052.
41.Rao K.S., Glende E.A., Recknagel R.O. Effect of drug pretreatment on carbon tetrachloride-induced lipid peroxidation in rat liver microsomal lipids. Exp Mol Pathol. 1970, 12, 324-331.
42.Payne E., Smith J.F., Cope B.C, McGowan L.T. Studies on the role of liver cytochrome P-450 and oestradiol metabolism in the effects of nutrition and phenobarbital on ovulation rate in the ewe. Reprod Fertil Dev. 1991, 3, 725-736.
43.Chaudhury S., Mehendale H.M. Amplification of CCl4 toxicity by chlordecone: destruction of rat hepatic microsomal cytochrome P- 450 subpopulation. J Toxicol Environ Health. 1991, 32, 277-294.
44.Wills E. Effect of lipid peroxidation on membrane bound enzymes of endoplasmatic reticulum. Biochem J. 1971, 123, 983-987.
45.Болданова Н. Б., Добрынина О. В., Мигушина В. Л., Арчаков
À.И. Защитные действия фосфатидилхолиновых липосом при экспериментальном токсическом гепатите. Вопр мед химии. 1986,
42, 65-67.
46.Archakov A.I. Reconstitution and repair of microsomal monooxygenase system of the liver. In: Physico-chemical aspects of medicine. Amsterdam. 1988, 130-205.
47.Ahr H.J., King H.J., Nastainczyk W., Ullrich V. The mechanism of reductive dehalogenation of halothane by liver cytochrome P-450. Biochem Pharmacol. 1982, 31, 383-390.
48.Jaeschke H., Gores G.J., Cederbaum A.I., Hinson J.A., Pessayre D., Lemasters J.J. Mechanisms of hepatotoxity. Òoxicol Sci. 2002, 65, 166-176.
49.Добрынина О.В., Шатинина С.З., Арчаков А.И. Репарация фосфатидилхолином повреждения гелиотрином мембран гепатоцитов. Бюлл эксп биологии и медицины. 1987, 103, 413-415.
50.Гришанова А.Ю., Гуткина Н.И., Мишин В.М. Сравнительное исследование изолированных изоформ цитохрома Р-450, индуцируемых фенобарбиталом и перфтордекалином. Биохимия. 1988, 53, 368-376.
210
