
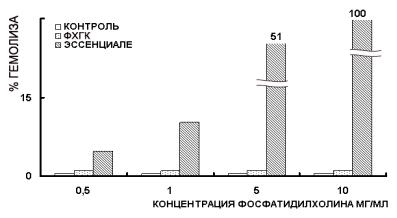
например, мембраны эритроцитов, о повреждении которых в условиях in vitro можно судить по степени гемолиза. В связи с этим были проведены сравнительные исследования действия смеси ФХГК и эссенциале на гемолиз эритроцитов (рис. 8.2.2).
Рис. 8.2.2. Влияние фосфолипидных препаратов на гемолиз эритроцитов
Эритроциты получали из гепаринизированной крови здоровых доноров, отделяли от плазмы центрифугированием и трижды промывали 0,9% NaCl. (физраствором). 0,1мл фосфолипидного препарата (50 мг СФХ/мл) и 1 мл отмытых эритроцитов добавляли к 3,9 мл 0,9% NaCl (физраствора) и инкубировали 2 часа при 37°С при осторожном перемешивании. По окончании инкубации смесь центрифугировали и определяли оптическую плотность надосадочной жидкости при 530 нм. Процент гемолиза рассчитывали по отношению к оптической плотности при 100% гемолизе - при инкубации эритроцитов в дистиллированной воде в тех же условиях.
Как видно из рисунка, инкубация эритроцитов в физиологическом растворе в присутствии эссенциале при концентрации, соответствующей 10мг/млпоСФХ,приводитпрактическикполномугемолизуужевтечение 20 минут. В противоположность этому, в присутствии смеси ФХГК даже при высоких концентрациях целостность эритроцитов не нарушается - процент гемолиза близок к таковому в физиологическом растворе (контроле), что свидетельствует об отсутствии повреждающих воздействий исследуемой фосфолипидной наноэмульсии на мембраны эритроцитов.
8.2.6. Стабилизирующее действие смеси ФХГК на культуру эндотелиальных клеток при воздействии токсических агентов.
В экспериментах in vitro была показана способность смеси ФХГК предохранять эндотелиальные клетки (в культуре) от токсического действия окисленных производных холестерина (рис. 8.2.3). Для этого к культуре эндотелиальных клеток в
251
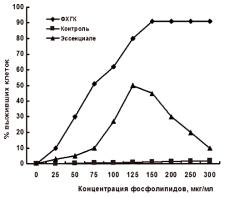
Эндотелиальные клетки пупочной вены человека культивировали в ячейках плашек Costar (5 х 104 см2) и использовали на 5-6 сутки. В среду вводили холестан-3,5,6-триол до конечной концентрации 50 мкМ [34] и фосфолипидные препараты - ФХКГ или эссенциале - в концентрациях от 25 до 250 мкг/мл. После 24-часовой инкубации клетки отмывали, снимали 0,25 М раствором трипсин - ЕДТА и считали количество клеток на гемоцитометре [35].
Рис.8.2.3. Влияние фосфолипидных препаратов на выживаемость эндотелиальных клеток в культуре в условиях токсического действия холестан-3,5,6-òриола.
состоянии конфлуэнтного монослоя добавляли холестан-3,5,6- триол до концентрации 50 мкМ, вызывающей их полную гибель [34]. Предварительное добавление в инкубационную среду эмульсии ФХГК оказывало защищающий эффект на клетки. Как видно из рисунка 8.2.3, несмотря на цитотоксическое действие холестан-3,5,6-триола, клетки оставались живыми при концентрации исследуемой смеси (по ФХ) - 150 мкг/мл среды [35]. Эссенциале в аналогичных условиях защитного действия не оказывал. При его концентрации в среде, превышающей 125 мкг/мл (по СФХ), количество погибших клеток увеличивалось, по всей вероятности, за счет цитотоксического действия входящих в состав эссенциале желчных кислот.
Таким образом, исследования показали, что фосфолипидная наноэмульсия, состоящая из СФХ и Na3ГК, способна оказывать стабилизирующее действие на ферменты микросомальных и митохондриальных мембран, а также восстанавливать целостность уже поврежденных мембран в клетках печени животных, отравленных СС14, или гелиотрином. В отличие от эссенциале, данная композиция не ингибировала активность цитохрома Р450 в поврежденных клетках и не вызывала гемолиза эритроцитов. Поэтому следующим этапом была разработка соответствующих технологий,
позволяющих получать на основе этой смеси капсульную и инъекционную формы лекарственного препарата фосфоглив (сокращенно: фосфо - фосфатидилхолин, гл - глицирризиновая кислота, лив - печень), с последующим проведением соответствующих доклинических и клинических испытаний.
252
8.3. Технология получения капсульной и инъекционной лекарственных форм фосфоглива на основе фосфатидилхолина сои и соли глицирризиновой кислоты.
Для разработки такой технологии прежде всего необходимо было подобрать соотношение СФХ : Na3ГК, оптимальное не только с точки зрения технологии, но и обеспечивающее максимальную биологическую активности лекарственных форм препарата.
При разработке технологии получения пероральной формы лекарственной композиции необходимо было учесть и устранить недостатки имеющихся коммерческих препаратов на основе растительных фосфолипидов (Эссенциале, Липостабил, RhonePoulenc Rorer, Германия). Так, пероральная форма эссенциале представляет собой капсулы, содержащие сиропообразную вязкую массу. Влага, входящая в состав массы, значительно сокращает срок хранения препарата и увеличивает его токсичность за счет образования таких продуктов окисления СФХ, как лизофосфатидилхолин (лизолецитин), который в повышенной концентрации в крови (свыше 0,2 мМ или свыше 9% от общего объема липидов в клетке) вызывает разрушение мембран [36] (см. также главу 3). Необходимо отметить, что, ни один коммерческий фосфолипидный препарат, присутствующий на рынке в Российской Федерации, не регламентирован по содержанию лизоФХ. Этот факт был учтен при разработке нормативнотехнической документации для производства препарата фосфоглив.
В ГУ НИИ БМХ РАМН была разработана технология получения
сухого гранулята для капсулирования, содержащего смесь СФХ и Na3ГК при соотношении от 2 : 1 до 3 : 1 [37, 38]. С целью выбора оптимального соотношения СФХ и соли ГК в экспериментах на крысах и мышах были исследованы токсикологические свойства смеси. Для этого животным вводили максимально допустимую дозу исследуемой смеси с соотношением фосфолипида и соли глицирризиновой кислоты от 1 : 1 до 2 : 1 (1:1; 1:3; 2:3; 1:7; 2:7 и 2:1). После введения препарата за животными велось наблюдение в течение 14 дней для определения летальности и симптомов отравления. После завершения тестирования рассчитывались значения LD50 для каждого вида и пола животного. Исследования показали, что в токсикологических свойствах исследуемых композиций практически не было различий: значения LD50 варьировали от 2480 ± 52 мг/кг для соотношения ФХ:Na3ГК 1:7 у крыс-самцов и до 2785 ± 165 мг/кг при соотношении 1:1 у крыссамок. В дальнейшем для разработки пероральной лекарственной формы была выбрана композиция с соотношением СФХ и соли
253

глицирризиновой кислоты 2 : 1 по массе.
Разработанная и масштабированная в промышленных условиях технология производства капсульной формы фосфоглива включает: получение смеси исходных и вспомогательных компонентов, влажное гранулирование, опудривание гранулята, капсулирование, упаковку готовых капсул в контурные ячейки и картонную пачку (рис. 8.3.1). Согласно разработанному промышленному регламенту, первым этапом при производстве капсул является получение смеси исходных ингредиентов (порошкообразной массы для капсулирования) с определенными технологическими характеристиками (размер гранул, влажность, сыпучесть). Дальнейшие этапы (капсулирование, упаковка в контурную ячейку, картонную пачку и др.) являются стандартными для фармацевтического производства.
Рис. 8.3.1. Схема производства капсульной формы лекарственного препарата фосфоглив
Капсульная форма лекарственного препарата фосфоглив разрешена к применению (регистрационный ¹ 99/212/11, перерегистрован в 2003г. Р¹002528/01-2003).
При разработке инъекционной формы основной задачей было получение лекарственного препарата в виде фосфолипидных наночастиц (липосом и/или мицелл) со средним диаметром не более 100 нм. Это необходимо для обеспечения наибольшей биодоступности и минимизации риска поглощения клетками ретикулоэндотелиальной системы (РЭС), захватывающими более крупные частицы [39-42].
Необходимо отметить, что в настоящее время одной из причин повышеного интереса в медицине, в частности, в фармации к наночастицам является их размер, обуславливающий фармакокинетику и эффективность проникновения в органмишень. Именно размер наночастиц влияет на их распределение в организме и на скорость захвата клетками РЭС [43-46]. Даже
254
относительно небольшое снижение размера липосом резко продлевает время их пребывания в кровотоке, а также усиливает их способность достигать определенных тканей-мишеней. При изучении фармакокинетики установлено, что комплементстимулирующий захват липосом в печени крыс зависит как от размера частиц, так и от их состава [42, 47]. Печень крыс захватывала быстрее липосомы с большим (800 нм) или средним диаметром (400 нм), чем мелкие (<200 нм) [48]. Однако, быстрое поглощение крупных частиц означает их захват купферовскими клетками печени и дальнейший метаболизм, в то время как частицы размером менее 100 нм неуловимы для ретикулоэндотелиальной системы печени [39, 42].
Поэтому подбор состава фосфолипидных наночастиц, а также оптимизация их размера являлись основной целью при разработке технологии получения инъекционной формы лекарственной композиции на основе СФХ и ГК.
Использование фосфолипидных частиц нанодиапазона для инъекционной формы препарата было выбрано на основании результатов предварительных исследований эффективности восстановления мембран гепатоцитов фосфолипидами [7, 18], показавших способность ФЛ именно в таком виде встраиваться в мембраны, эффективно восстанавливая активность мембранных ферментныхсистем.
Оптимальным решением задачи получения частиц размером до 100 нм оказалось использование глицирризиновой кислоты не только в качестве фармацевтической субстанции, но также и как детергента, способствующего получению стабильных наночастиц.
С этой целью были проведены исследования зависимости размеров получающихся частиц от соотношения СФХ и Na3ГК. Частицы получали путем впрыскивания в водный буфер изопропанольного раствора смеси СФХ и ГК в разных соотношениях. Характеристику образующихся везикул (наночастиц), находящихся в равновесии с ГК в водном растворе, проводили методами аналитического ультрацентрифугирования и электронной микроскопии (при негативном контрастировании фосфорновольфрамовой кислотой). На рис. 8.3.2 представлены электронные микрофотографии образующихся фосфолипидных частиц при разных соотношениях СФХ и Na3ГК. Как видно из представленных данных, увеличение концентрации Na3ГК в исходном растворе приводило к снижению размера образующихся частиц. Распределение последних по размерам приведено в табл. 8.3.1.
Полученные результаты показывают, что диаметр фосфолипидных частиц сформированных без ГК составлял в основном 160-220 нм.; при минимальной доле ГК (соотношение
255
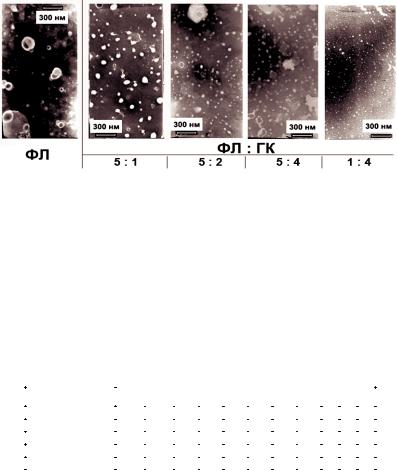
Рис. 8.3.2. Электронная микроскопия фосфолипидных везикул при разных соотношениях СФХ: Na3ÃÊ.
Электронные микрофотографии получены на приборах "JEOL JEM 100" и "Phillips". 10 мкл раствора ФХГК с разным соотношением компонентов (указано под соответствующим снимком) в 0,1 мМ NH4HCO3 наносили на медные сетки 400 меш, покрытые карбонизированным
коллодием, выдерживали 30 сек, затем промывали 2-3 каплями воды. Негативное контрастирование осуществляли добавлением 2-3 капли 2% водного раствора фосфорновольфрамовой кислоты. Концентрация СФХ во всех образцах 50 мкМ.
ÑÔÕ : Na3ГК 5:1) преимущественный диаметр составлял 95 нм. При преобладании Na3ГК (80% или соотношение СФХ : Na3ГК 1:4) эмульсия представляла собой гетерогенную смесь наночастиц широкого диапазона - от 12,5 до 60 нм (табл 8.3.1).
Таблица 8.3.1
Распределение частиц по размерам (в весовых %)*.
Соотношение СФХ: Na3ÃÊ |
|
|
Диапазоны диаметра частиц, нм |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
12,5 15 |
15 17,5 |
22 25 |
32 37 |
45 47 |
50 55 |
60 65 |
Äî 95 |
110 |
160 |
220 |
|
|
|
|
|
|
|
|
|
|
|
|
1:0 |
|
|
|
4,0 |
|
|
4,0 |
|
|
47 |
40 |
|
|
|
|
|
|
|
|
|
|
|
|
5:1 |
|
|
1 |
7 |
|
|
35 |
57 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5:2 |
|
|
4 |
20 |
|
49 |
6 |
21 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1:4 |
5 |
5 |
5 |
17 |
15 |
18 |
35 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
*Приведены средние данные трех экспериментов.
В дальнейшем выбор был остановлен на соотношении СФХ : Na3ГК 5:2, которое обеспечивает получение наночастиц с диаметром 25 - 65 нм и при этом содержит достаточное для обеспечения мембранных репарационных
процессов количество СФХ.
Вполне возможно, что ГК, обладающая детергентными свойствами, влияет на способность СФХ к образованию липосом и мицелл в водной среде, или, другими словами, на поверхностную активность фосфолипида, способствуя получению наночастиц с минимальным размером. Именно
256
это свойство, отражающее способность ФЛ снижать поверхностное натяжение на границе с водной фазой (измеряемое в миллиньютон/м2 - ìÍ/ì2), определяет прочность образующихся в воде фосфолипидных везикул [49], их способность удерживаться на границе с водной фазой. Поверхностное натяжение образуемых фосфолипидами поверхностей измеряют или с использованием сферических поверхностей - в пузырьковой пульсирующей системе [50], или в плоскости на границе раздела сред "вода - воздух" [49], что и было использовано нами для смеси СФХ с разными количествами ГК. Для этого были сформированы пленки с использованием изопропанольных растворов СФХ (5х10-3 М) с добавлением ГК, в которых измеряли натяжение на сурфактометре Kruss (Германия). Поверхностное натяжение для СФХ (без ГК) составило 26,5±0,1 мН/м2; добавление Na3ГК в широком интервале концентраций не оказывало влияния на эту величину. Таким образом, проявляя детергентные свойства, ГК не снижает поверхностную активность фосфолипида, обеспечивающую его способность к образованию наночастиц - липосом и/или мицелл - в водной среде.
В связи с хорошей растворимостью Na3ГК в воде, с одной стороны, и ее детергентными свойствами, способствующими получению фосфолипидных наночастиц, с другой, представляло интерес исследовать характер взаимодействия СФХ с ГК в водной среде, т.е. определить, является ли смесь ФХГК эмульсией фосфолипидных наночастиц в водном растворесолиГК,илиГК"встроена"вмембрануэтихнаночастиц.Дляэтого был использован метод равновесного изоплотностного ультрацентрифугирования в градиенте плотности [51].
Метод основан на том, что направление движения частиц в
центробежном поле в градиенте плотности определяется соотношением между плотностью растворителя (ρð) и сольватированной плотностью исследуемого вещества (ρ÷). Ïðè ρ÷ > ρð частицы оседают, при ρ÷ < ρð наблюдается их флотация и, наконец, при ρ÷ = ρð частицы в центробежном поле не движутся. При проведении эксперимента предварительно формировали градиент плотности, и исследуемый образец вносили в его определенную зону. В процессе центрифугирования в центробежном поле частицы исследуемого образца расходятся из первоначального положения по высоте пробирки в соответствии с установившимся градиентом, останавливаясь в тех его областях, где плотность равна плотности частиц данного типа. Таким образом, локализация частиц в той или иной зоне градиента плотности позволяет оценить их "плавучую плотность". Распределение частиц по плотности во фракциях по высоте пробирки обычно определяется с помощью какого-либо специфичного маркера (оптическая плотность, радиоактивность, флуоресценция или др.). При исследовании фосфоглива и его компонентов в качестве маркеров мы использовали:1)дляСФХ-оптическуюплотностьпри320нм(D320)è[Ñ14]-
257
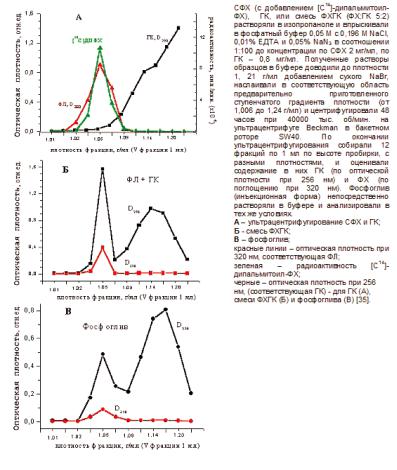
Рис. 8.3.3. Равновесное ультрацентрифугирование СФХ, Na3ГК, смеси ФХГК и фосфолипидных наночастиц (инъекционной формы фосфоглива).
метку (использование образцов фосфоглива с добавлением [С14]-ÔÕ); 2) äëÿ
ГК - оптическую плотность при 256 нм (D256 ).
Результаты такого эксперимента для эмульсии СФХ, Na3ГК, их смеси и препарата фосфоглив представлены на рис 8.3.3. Как видно из рисунка 8.3.3 (А), при ультрацентрифугировании эмульсии СФХ поглощение D320 и радиоактивность [С14] отличны от нуля во фракциях с плотностями 1,03 - 1,07 г/мл, с максимумом в плотности 1,05 г/мл, что указывает на присутствие в них СФХ. По мере возрастания плотности (начиная с плотности > 1,065 г/мл) наблюдали постепенное возрастание D256 âî
258
фракциях. Это указывает на увеличение количества ГК за счет ее седиментации, плотность которой составляет 1,3227 г/мл.
Одновременное впрыскивание растворов ФХ и ГК (получение образцов в изопропаноле см. выше) в водную среду градиента плотности и измерение D320 после ультрацентрифугирования (8.3.3 Б), выявило в этих фракциях наличие везикул с гидратированной плотностью такой же, как у везикул чистого СФХ (1,03 - 1,07 г/мл). Тот же результат наблюдали и для готового препарата фосфоглив (8.3.3 В). Соотношение в этих фракциях пиков D256/ D320 (рис. 9.3.3Б) было выше, чем для чистого СФХ (~ 4 по сравнению с ~ 2 для СФХ). Это указывает на наличие в них и СФХ, и ГК, очевидно, в состоянии смешанных липосом и/или мицелл. В зоне более высоких плотностей (1,065 - 1,215 г/мл) видно наличие пика D256 (с максимумом при 1,015 г/мл), при D320 близкой к нулю, что свидетельствует об образовании очень мелких смешанных мицелл с высоким содержанием ГК, а также о присутствии свободной ГК в водном растворе. Таким образом, приведенные результаты показывают присутствие в водной эмульсии ФХГК и в фосфогливе как свободно диффундирующих, так и ассоциированных с фосфолипидными наночастицами молекул ГК.
В дальнейшем, при разработке технологии получения инъекционной формы лекарственного препарата фосфоглив, были подобраны условия для получения фосфолипидных наночастиц из водного раствора Na3ГК и водной (первичной) эмульсии СФХ одним из известных способов - продавливанием (экструзией) водной эмульсии фосфолипидов через узкие отверстия в мембране
под высоким давлением (800 - 1000 атм.) [47]. Преимуществом этого метода являются получение наночастиц стандартного размера, высокая производительность и минимальное окисление СФХ в процессе получения препарата. Использование гомогенизатора высокого давления позволяет получать наночастицы в асептических условиях при постоянном контроле температуры и давления.
Получение препарата в форме фосфолипидных наночастиц, устойчивых при хранении, является одной из сложных задач. Известно, что для стабилизации получаемых надмолекулярных структур часто используют технологию замораживания-высушивания в присутствии криопротекторов. При этом получают лиофильно высушенный препарат, который при повторном растворении в воде сохраняет свою структуру. Основным критерием подбора криопротекторов является сохранение стабильности препарата и размера наночастиц при его растворении [47, 52]. Хотя с помощью лиофилизации можно получать стабильный сухой препарат
259
наночастиц, этот процесс требует тщательного контроля, так как на стадиях замораживания и обезвоживания возможно физическое повреждение частиц кристаллами льда. Поэтому применяемый криопротектор должен быть лишен эвтектических свойств, т.е. не должен кристаллизоваться при замерзании. Правильный подбор скорости снижения температуры (замораживания препарата), режима сушки и криопротектора (мальтозы) обеспечили в нашей работе получение стабильного препарата в виде лиофилизированного порошка с сохраненной структурой наночастиц.
Необходимо отметить, что на процесс сушки препарата и защитное действие криопротекторов существенное влияние оказывает размер фосфолипидных наночастиц. Установлено, что диаметр частиц 100 нм и меньше, а также присутствие мальтозы в соотношении 3:1 к СФХ, способствовали оптимизации технологии получения инъекционной формы лекарственной композиции.
Другим, не менее важным фактором защиты фосфолипидных наночастиц во время лиофилизации, является предотвращение слияния везикул. Этого удалось достичь подбором оптимального соотношения СФХ, Na3ГК и мальтозы в исходной эмульсии - 2,5:1:9. Оптимальное соотношение СФХ и Na3ГК, составившее в этих условиях 2,5:1, и было выбрано для дальнейшей работы.
В результате большого числа рабочих экспериментов по подбору конкретных технологических параметров была разработана и масштабирована технология производства инъекционной формы лекарственного препарата фосфоглив, основу которого составляет композиция СФХ + Na3ГК в виде лиофилизированных фосфолипидных
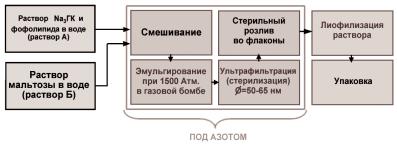
наночастиц. На рисунке 8.3.4 представлена общая схема технологии производства, которая включает такие основные стадии, как экструзия под высоким давлением, стерилизующая ультрафильтрация и лиофилизация.
Рис. 8.3.4. Общая схема технологии производства инъекционной формы лекарственного препарата фосфоглив
260
