
51.Арчаков А.И., Бачманова Г.И., Погодина О.К., Добрынина О.В., Мигушина В.Л., Савин И.Г. Способ определения деструкции эндоплазматического ретикулума клеток печени. Авторское свидетельство ¹1142802 (1.11.1984).
52.Bachmanova G.I., Abdugafurova M.A., Li V.S., Dobrynina O.V., Shatinina S.Z., Archakov A.I. Reparation of damaged rat liver cells, microsomal membranes and cytochrome P450-dependent monooxygenase system by phospholipids. In: Phosphatidylcholine (polyenephosphatidylcholine/PPC): effects on cell membranes and transport of cholesterol. (Archakov A.I., Gunderman K.J. eds). Cologne, wbn-Verlag. Bingen/Rhein. 1989, 137-145.
53.Bachmanova G.I., Kanaeva I.P., Sevrukova I.F., Archakov A.I. Reconstitution of membrane microsomal monooxygenase system from purified enzymes in solutions. Abstr. of 2-nd IUBMB Conference, Biochemistry of Cell Membranes. Bari, Italy. 1993, 272.
54.Archakov A.I., Uvarov V.Yu. Action of phospholipids on hydrophobic microsomal proteins. In: Phosphatidylcholine (polyenephosphatidylcholine/PPC): effects on cell membranes and transport of cholesterol. (Archakov A.I., Gunderman K.J. eds). Cologne, wbnVerlag. Bingen/Rhein. 1989, 127-136.
55.Panos M.Z., Polson R., Johnson R., Portman B., Williams R. Activity of polyunsaturated phosphatidylcholine in HbsAg negative chronic active hepatitis. In: 50th anniversary of phospholipid research (EPL). (Gunderman K.J., Schumacher R. eds). Wbn Press, Bingen/Rhein, 1990, 103-110.
56.Kuntz E. The "essential" phospholipids in hepatology-50 years of experimental and clinical experience. Ibid. 49-69.
57.Magden J., Kaariainen L., Ahola T. Inhibitors of virus replication: recent developments and prospects. Appl Microbiol Biotechnol. 2005, 66, 612-621.
211
ГЛАВА 7. ГЛИЦИРРИЗИНОВАЯ КИСЛОТА: БИОЛОГИЧЕСКИЕ СВОЙСТВА И ПРИМЕНЕНИЕ В МЕДИЦИНЕ В КАЧЕСТВЕ ПРОТИВОВИРУСНОГО АГЕНТА
Глицирризиновая кислота (ГК) является основным активным компонентом корня солодки, известного своими целебными свойствами. Она присутствует более чем в 10 разновидностях солодки. В России источниками ее являются солодка голая (Glycyrrhiza glabra L), солодка уральская (Gl. Uralensis Fish) и солодка Коржинского (Gl.Korshinski G.) [1-8].
Корень солодки используется в медицине уже более 3000 лет. Сведения о нем находят в древнейших китайских книгах по медицине. Корень солодки высоко ценили древнегреческие и римские врачи. Солодка упоминается в древнейшей медицинской энциклопедии - папирусе Эберса. Ее широко использовали в своей практике Гиппокрит и Гален. Высоко оценивал свойства корня солодки Авиценна. Китайские врачи считают солодку одним из трех наиважнейших лекарственных растений и уникальной по биологической активности. ГК входит в состав более 70% препаратов традиционной китайской медицины [9, 10]. В Китае ГК включают в состав препаратов не только из-за ее высокой биологической активности, а также как соединение, способное усиливать действие других компонентов, снижать их токсичность и побочные эффекты.
Традиционно экстракт корня солодки применяли в качестве отхаркивающего, слабительного, противовоспалительного и
спазмолитического средства. В настоящее время экстракт корня солодки широко применяется как в медицине (в составе лечебных и профилактических препаратов), так и в пищевой промышленности (как подсластитель и пенообразователь). Медицинское применение солодки и выделяемых из нее компонентов особенно широко развито в странах юго-восточной Азии, и именно там проводятся большинство современных исследований по изучению механизмов
ååмножественных биологических активностей [11, 12]. Наибольший интерес из компонентов корня солодки вызывает
глицирризин - ингредиент, придающий ей специфический сладкий вкус и представляющий собой смешанные калиевую и кальциевую соли трехосновной глицирризиновой кислоты [5, 13-17]. Химическое строение и название Glycyrrhiza (от латинского) было установлено в конце 30-х годов ХХ века чешским исследователем Ружечкой с соавторами [15]. Они показали, что глицирризиновая кислота представляет собой водорастворимый тритерпеновый гликозид, образованный одной молекулой глицирретовой кислоты (ГТ) и двумя молекулами глюкуроновой кислоты (рис. 7.1).
212

Рис. 7.1 Химическое строение глицирризиновой кислоты
При отщеплении углеводного компонента (гликана), которое, в частности, происходит под влиянием бактериальной флоры в кишечнике при пероральном приеме ГК, остается агликон (ГТ), также обладающий широким спектром биологического действия [16, 18, 19, 20].
Установлено, что ГК оказывает противовоспалительное, противоаллергическое, противовирусное, гепатопротекторное, иммуномодулирующее, противоязвенное действия, обладает антиоксидантными свойствами [4 - 6, 10, 17, 18]. Кроме того, наличие в молекуле ГК гидрофильного (диглюкуронидного) и гидрофобного (тритерпенового) фрагментов придает ей уникальные поверхностно-активные и гелеобразующие свойства, которые объясняют широкий диапазон ее использования.
7.1.Основные биологические свойства ГК.
7.1.1.Иммуномодулирующие свойства ГК.
Как показано во многих работах, имуномодулирующее действие ГК осуществляется за счет стимуляции образования Т-лимфоцитов и противосупрессорных вне-тимусных клеток - естественных киллеров (ЕК) и Т-клеток анти-типа 2, а также воздействием на систему цитокинов. Индукция Т-лимфоцитов приводит к активации продукции γ-интерферона (ИФН-γ) и образованию антител, усилению иммунных механизмов клетки. Повышение секреции ЕК и вне-тимусных Т-клеток, их активация также
сопровождается дальнейшей индукцией синтеза ИФН-γ. Тем самым организм модулирует неспецифический иммунный ответ, особенно на начальных стадиях болезни [4, 5,17, 21-25] (рис. 7.1.1).
Исследование действия ГК на иммунную систему у мышей показало, что на 9-й день после ее внутрибрюшинного введения в
213
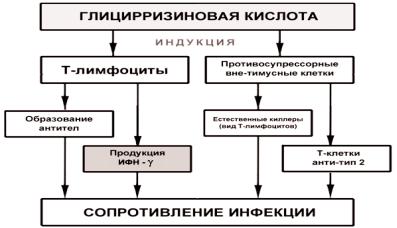
Рис. 7.1.1. Механизм иммуномодулирующего действия глицирризиновой кислоты.
крови животных повышалось общее количество лейкоцитов. При одновременном введении ГК и антигена повышался специфический титр антител и количество тромбоцитов и тромбоцит-образующих клеток в селезенке. Эти изменения указывают на иммуномодулирующую активность ГК [26]. Показано также, что введение ГК способствовало нормализации формулы крови и количества лейкоцитов при агранулоцитозе, развивающемся в результате побочного действия противотуберкулезной терапии [27].
В работе Takahara с соавт. [28] показано, что ГК подавляет секрецию белка-антигена вирусного гепатита В - HВsAg (hepatitis B surface antigen) в клетках гепатокарциномы человека, линии PLC/PRF/5, экспрессирующих HВsAg, и вызывает дозозависимое накопление антигена в вакуолях цитоплазмы в области аппарата Гольджи. При исследовании механизма этого эффекта на клетках, инфицированных рекомбинантным вирусом ветряной оспы, экспрессирующим HВsAg, было обнаружено, что ГК ингибирует сиалирование HВsAg. Поскольку десиалированный HВsAg проявляет лучшую иммуногенность, усиливая генерацию гуморальных антител и клеточно-опосредованного ответа, авторы предположили, что ГК может таким образом улучшать иммунологический статус больных вирусными гепатитами [29].
Abe с соавт. [30] обнаружили, что внутривенное введение ГК мышам в дозе 20 мг/кг через 2 и 18 часов после введения дает два пика индукции ИФН-γ с участием Т-клеток и макрофагов. Введение ГТ (агликона ГК) в меньшей дозе (5 мг/кг) также
214
индуцирует синтез ИФН-γ, что проявляется одним пиком (менее чем через 2 часа) с вдвое меньшей интенсивностью. Это может указывать на более высокую интерферон-индуцирующую способность ГТ.
Подкожное введение ГК мышам вызывало экстратимическую дифференциацию Т-клеток в печени. Даже при однократном введении ГК у животных отмечали не только увеличение количества мононуклеарных клеток в печени, но также и повышение количества функционально недифференцированных Т-клеток. В отличие от других препаратов, использованных в этих экспериментах (лимфотоксин и эстроген), ГК не изменяла соотношение Т-клеток различных классов в тимусе [31].
Считают, что ГК может служить индуктором CD4+, CD28+, αβ- Т-клеток. Так, у мышей с экспериментально индуцированной метастазирующей меланомой легких ГК активировала синтез αβ-Т- клеток имеющих маркеры CD4+ è CD28+, а также опосредованно ингибировала синтез цитокинов Т-хелперными клетками 2-го типа [32]. У мышей с моделью гепатита, индуцированного конканавалином А, ГК повышала продукцию интерлейкина-10 (IL10) дендритными клетками печени [33]. Изучая механизмы иммуномодулирующего действия ГК, Dai с соавт. [34] обнаружили ее влияние на индуцируемую липополисахаридом продукцию перитонеальными макрофагами различных типов IL-12, представляющих собой гетеродимер: IL-12 р40, IL-12 р70 и др. Увеличение продукции IL-12, обусловленное усилением транскрипции мРНК IL-12 р35 и р40, было связано с ГК-зависимой
активацией ядерного фактора NF-kB. Такое же действие ГК оказывала и на продукцию IL-12 у мышей, нокаутных по ИФН-γ. Эти данные указывают на способность ГК повышать индуцированную липополисахаридом генерацию IL-12 перитонеальными макрофагами, которая не зависела от синтеза γ- интерферона.
Utsonomiya с соавт [35] изучали влияние ГК на продукцию IL-12 у мышей после термического воздействия. Через 6 дней после такой обработки мыши теряли способность к индуцированной липополисахаридом генерации IL-12. Однако, если мышам предварительно вводили внутрибрюшинно ГК (10 мг/кг), то у них уровень IL-12 в сыворотке крови после термического воздействия был даже выше, чем у контрольных животных. Кроме того, обнаружено, что инокуляция нормальным мышам Т-клеток типа 2 (продуцирующих IL-4 и IL-10) из селезенки мышей, подвергнутых термическому воздействию, подавляла способность к стимулированному липополисахаридом синтезу IL-12. В то же
215
время, инокуляция CD4+Т-клеток из селезенки нормальных мышей, получавших ГК, наоборот, повышала генерацию IL-12, стимулированную липополисахаридом у мышей, подвергнутых
термическому воздействию. Полученные результаты позволили авторам предположить, что ингибированный в результате термической обработки путь синтеза IL-12 восстанавливается, повидимому, за счет воздействия ГК на факторы, регулирующие Т- клеточный ответ.
Анализируя значение для организма способности ГК влиять на генерацию интерлейкинов, следует иметь в виду, что интерлейкины в последние годы вызывают большой интерес как ключевые цитокины иммунной регуляции. Они активируют естественные киллеры и цитотоксические лимфоциты и являются противовоспалительными цитокинами. Показана сопряженность продукции IL-12 и основного активатора макрофагов ИФН-γ. Последний может стимулировать продукцию IL-12 через активацию клеточного сигнала с участием тирозиновой протеинкиназы [36]. С другой стороны IL-12, действуя на покоящиеся клетки ЕК, стимулирует продукцию ими ИФН-γ, стимулирующего, в свою очередь, функции макрофагов. В присутствии IL-12 клетки ЕК способны дифференцироваться в субпопуляции - ЕК1 и ЕК2; ЕK1 продуцирует ИФН- γ, а ЕК2 - другие интерлейкины (IL-5 и IL-13). ЕK1 более чувствительны к апоптозу и отвечают на IL-12 через активацию ядерных факторов [37]. IL-12 также ускоряет пролиферацию CD30+ лимфоцитов Th1 клеток, продуцирующих ИФН-γ. IL-12 активирует пролиферацию
èдифференцировку ЕК и Т-лимфоцитов, повышает их
цитотоксический эффект и продукцию других цитокинов. Основной результат этих процессов - индукция синтеза ИФН-γ. В свою очередь, ИФН-γ активирует множественные защитные функции макрофагов, включая синтез самого IL-12 [38]. ГК может
включаться в этот каскад реакций, индуцируя продукцию IL-12 и тем самым и γ-интерферона [36], или непосредственно влияя на Т- клетки [35, 39].
Имеются данные, что однократное введение животным неоминофагена С (препарата, основным действующим началом
которого является ГК и который широко используется в Японии для лечения вирусных гепатитов [40]) активирует системы ИФН-γ
èIL-12 [39]. При введении мышам препарата наблюдали значительное повышение в печени активности клеток ЕК и α-TNF. Результаты показывают, что в целом цитотоксическая функция, стимулируемая печеночными лимфоцитами, усиливается под действием ГК [39].
216
Таким образом, одним из проявлений иммуномодулирующего действия ГК является ее влияние на продукцию цитокинов, в частности IL-12, и, возможно, через них - на систему γ- интерферона.
7.1.2. Противовоспалительное действие.
Другим, чрезвычайно важным свойством ГК, сопряженным с иммуномодулирующим эффектом и обуславливающим ее широкое лекарственное применение, является противовоспалительное действие. ГК и ее производные ингибируют гистаминовую, серотониновую, брадикининовую, формалиновую и другие воспалительные реакции, уменьшают сосудистую проницаемость, обладают выраженным антипролиферативным действием и антикининовым эффектом [5, 10, 17]. Например, соли ГК в эксперименте снижают формалиновый отек как у интактных, так и
óадреноэктомированных животных [10, 41]. При внутрибрюшинном введении ГК подавляет образование гранулемы
óморских свинок и оказывает сильное противовоспалительное действие при экспериментальном конъюнктивите у кроликов. Показан противовоспалительный эффект ГК у лактирующих коров при индуцированном стафилококком мастите [42]. По противовоспалительной активности Na- и К-соли ГК не уступают вольтарену [10].
Предполагается несколько механизмов противовоспалительного действия ГК. Известно, что рецепторы лейкоцитов СD4 блокируются протеинкиназой С, что, в свою
очередь, приводит к развитию воспалительных процессов. ГК способна ингибировать PK С, восстанавливая иммунные свойства или иммунный ответ клетки и препятствуя тем самым развитию воспалительного процесса [43].
Противовоспалительное действие ГК связывают с ее псевдокортикостероидным эффектом: ГК ингибирует 11-β- оксистероиддегидрогеназу (катализирующую переход кортизола в кортизон), что приводит к увеличению кортизола в крови и инактивации иммуносупрессорного действия кортизона [44].
Кроме того, в ряде исследований показано, что противовоспалительное действие ГК близко к действию гидрокортизона и преднизолона (из-за сходства со структурами последних). Показано сохранение противовоспалительного действия ГК при введении животным в течение 6 часов. ГК является также синергистом преднизолоновых препаратов (из-за ингибирования расщепляющих их ферментов).
Противовоспалительное действие ГК также связывают с
217
ингибированием активности PLA в лизосомах, что, в свою очередь, препятствует освобождению из лизосом протеолитических ферментов и кислых фосфатаз, накопление которых в тканях приводит к повреждению клеток и развитию воспалительного процесса.
Недавно показано, что секреторная фосфолипаза А2 òèïà IIà (sPLA2), очищенная из синовиальной жидкости больных с ревматоидным артритом, способна связывать глицирризин и функционировать как глицирризин-связывающий белок [45]. При этом ГК ингибирует инициируемую протеинкиназой С активность sPLA2, а ГТ в этом отношении оказалась в три раза активнее.
На противовоспалительном эффекте основано применение ГК в форме геля для лечения кожных заболеваний, например, хронического дерматита [46]. Разработана также композиция ГК с соевым ФХ или гидрированным соевым ФХ в липосомальной форме с размером липосом 90-120 нм. Установлено оптимальное для проникновения в кожу соотношение липид:ГК - 4:1 [47].
Sakamoto с соавт [48] показали in vitro ингибирующий эффект ГК на фосфорилирование и ДНК-связывающую способность белков HMG1 и HMG2 (high mobility group proteins -1, -2), содержащих высоко реактивные сайты фосфорилирования для двух протеинкиназ - С и К. ГК конкурентно связывается с этими белками, препятствуя их фосфорилированию и присоединению к ДНК. По мнению авторов индуцированное глицирризиновой кислотой ингибирование физиологической активности HMG1/2 способствует проявлению противовоспалительного действия ГК in vivo [48].
7.1.3. Антиоксидантные свойства глицирризиновой кислоты.
ГК обладает антиоксидантной активностью [49], которую связывают с ингибированием PK C, усиливающей перекисное окисление липидов (ПОЛ) через фосфорилирование 5- липоксигеназы. Действие ГК тормозит этот процесс. Кроме того ГК способна связываться с прооксидантом простагландином Е2.
В гепатоцитах ГК способна инактивировать ферменты, инициирующие ПОЛ, с чем связывают ее гепатопротекторное действие [50].
7.1.4. Гепатопротекторные свойства.
Еще более 10 лет назад был обнаружен высокий тропизм ГК к печени, где через 1-2 часа после внутривенного введения обнаруживалось большая ее часть [15]. Скорость захвата ГК печенью зависит от функции и экспрессии особого класса гепатоцеллюлярных белков - "органических анион-
218
транспортирующих полипептидов", кодируемых семейством генов SLC21A [51]. Высокая скорость захвата ГК печенью создает условия для проявления выраженной гепатопротекторной активности, свойственной как ГК, так и ее агликону - ГТ [10, 15, 52]. На модели отравления животных D-галактозамином было показано, что существенно меньшие дозы ГТ по сравнению с ГК останавливали увеличение активности аминотрансфераз в сыворотке крови, связанное с повреждением гепатоцитов [52]. Низкие концентрации ГТ (5-50 мкг/мл) предотвращали вызванный действием СС14 на первичную культуру гепатоцитов выход аминотрансфераз из клеток. Глицирризиновая кислота оказывала такой эффект при концентрациях не менее 1000 мкг/мл. Более выраженные гепатопротекторные свойства глицирретовой кислоты авторы связывают с высокой ее адсорбцией на гепатоцитах [52].
Установлено, что при прямом воздействии токсинов (аллилформиат, четыреххлористый углерод, галактозамин) ГК препятствует повреждению гепатоцитов печени крыс [15, 53]. Комплекс ГК с метионином ингибирует развитие у животных хронического гепатита. На мышах с моделью гепатита, индуцированного ведением конканавалина А, показана способность ГК ингибировать повышение активности АлАт в крови [54-56].
На экспериментальной модели фиброза печени крыс, вызванного подкожными инъекциями СCl4, Cai с соавт [57] изучали воздействие ГК на экспрессию генов. С помощью RT-PCR-анализа (reverse transcription - polymerase chain reaction или RT-ПЦР- анализ) было показано увеличение экспрессии ряда генов (smurf2,
RTAFR, CYP2D6, FGG), связанных с воспалением. Таких изменений не наблюдали при параллельном с гепатотоксином введении крысам ГК. На основании полученных данных авторы предположили, что ГК способна оказывать антифиброзное действие [57].
Гепатопротекторные свойства ГК проявляются также в снижении уровня сывороточных трансаминаз и количества продуктов ПОЛ в печени. Большинство исследователей считают, что гепатопротекторный эффект ГК обусловлен ее антиоксидантными свойствами и особенностью химического строения молекулы, а именно, концевым расположением глюкуроновой кислоты в углеводной цепи молекулы гликозида [58].
Jeong с соавт. [59], изучая гепатозащитное действие 18-β- глицирретовой кислоты при повреждении печени, индуцированном СCl4, установили ингибирование экспрессии цитохрома Р450 2EI. В данной работе предварительное введение животным ГТ сдерживало рост активности АлАТ и АсАТ в
219
сыворотке крови, а также ПОЛ в печени. Гидроксилазная активность цитохрома Р450 2EI, выделенного из печени мышей после введения ГТ, значительно снижалась. Глицирретовая кислота проявляла также антиоксидантную активность, существенно снижая ПОЛ в гомогенатах печени мышей, индуцированное FeCl2-аскорбатом. Авторы полагают, что ГК и ее метаболит - ГТ, обладают гепатопротекторными свойствами, ослабляя цитотоксическое действие СCl4 путем подавления экспрессии и активности изоформы цитохрома Р450 2EI, а также способствуя удалению образуемых им свободных радикалов [59].
Kimura с соавт. [60] показали, что ГК и ее аналоги, особенно 18- α-глицирретовая кислота (18-α-ГТ), индуцируют рост культуры гепатоцитов крысы, воздействуя на рецептор эпидермального фактора роста. Эти соединения стимулировали синтез ДНК и пролиферацию гепатоцитов взрослых крыс в первичной культуре, а также фосфорилирование остатков тирозина в EGF-рецепторе и в р42 МАРК. Эффекты подавлялись моноклональными антителами против рецептора эпидермального фактора роста. Специфические ингибиторы трансдукции сигналов, связанных с ростом клеток - генистеин, 2-амино-3-метоксифлавон и рапамицин - полностью блокировали индуцированный ГК синтез ДНК и пролиферацию гепатоцитов. Авторы предполагают, что глицирризин и некоторые его аналоги являются митогенами для культуры гепатоцитов. Механизм их действия, возможно, связан с присоединением глицирризина и/или его аналогов к EGF-рецепторам и последующей стимуляцией каскада реакций с участием
рецепторной тирозинкиназы и МАРК; последняя индуцирует синтез ДНК и пролиферацию клеток [60]. Гепатопротекторное действие ГК продемонстрировано и в клинических исследованиях - введение ее больным с индуцированным противотуберкулезными лекарствами гепатитом, приводило к улучшению состояния печени [61].
7.1.5. Псевдокортикостероидный эффект.
ГК может оказывать псевдокортикостероидный эффект, который проявляется в повышении уровня глюкокортикостероидов и минералокортикостероидов в крови за счет ингибирования действия 11-β-оксистероиддегидрогеназы (тип 2) и 5-α-редуктазы [44, 62].
Ингибирование этих ферментов приводит к увеличению в крови содержания кортизола и активации минералокортикостероидных рецепторов. За счет этого действия ГК, вызванного, как считают, структурным сходством ее агликона и 11-кето-стероидов, глицирризиновая кислота, подобно гормонам коры надпочечников,
220
