
- •Губин сергей львович
- •Глава 1. Анализ современного состояния обогащения железных руд.
- •1.1. Ресурсная база и технология обогащения
- •1.2. Методы повышения качества железорудных концентратов
- •1.3. Катионные собиратели для флотации железных руд
- •1.4. Машины для флотации железных руд и концентратов
- •.Глава 2 исследование физико-химичсеских характеристик и механизма катионной флотации
- •2.1. Состояние катионных реагентов в водном растворе
- •2.3. Флотация магнетита
- •Глава 3. Исследование кинетики флотации магнетитового концентрата
- •3.1. Исследование вещественного состава магнетитовых концентратов
- •1 23456789 10 11 Время флотации, мин
- •23456789 10 11 Время флотации, мин
- •159,94 65,72 159,85Флотигам 90г/т 1
- •70,19 60,6 64,64Флотигам 20г/т 1
- •82,14 70,3/2,59 87,76 7,61 64,4 7,45Флотигам 40г/т I
- •289,19 49,4 217,11 119,31 67,8/5,26 122,94Лилофлот мд 20296 40г/т-1 1
- •3.4. Флотация собирателем мпа-13
- •3.5. Флотация собирателем Диамин
- •4 5 6 7 Время флотации, мин
- •134,06 65,01 113,4565,8/7,73 Уд. Поверхность-1927 г/см3 100,00
- •Основная обратной катионной флотации 4
- •Контр.Пен.Осн.Фл.З
- •Глава 4. Определение оптимальных параметров колонной флотации
- •4.1. Особенности конструкции колонны для обратной флотации
- •IV, те те тавд )Гк ггдг.
- •4.4. Несущая способность
- •0.00 0.50 1.00 1.50 2.00 2.50 3.00 3.50 4.00 Несушая способность. Т/м2/ч
- •4.5. Приведенная скорость «смещения»
- •-0.05 0.00 0.05 0.10 0.15 Скооость смешения, см/с
- •124 6 8 10 Содержание Si02,%
- •4.6. Критерии проектирования флотационных колонн
- •Глава 5. Обоснование технологических режимов и схем колонной флотации
- •Расход собирателя мпа-13
- •5.2. Определение оптимальных параметров основной колонной флотации
- •5.2.1. Влияние расхода воздуха и промывной воды
- •Примечание: дозировка реагентов производилась вручную, кроме *)
- •5.2.2. Влияние производительности и плотности питания
- •5.2.3. Влияние качества исходного концентрата
- •5.3. Определение параметров перечистной и контрольной флотации
- •5.4. Исследование продуктов обогащения
- •Анализ состава сточных вод флотационного обогащения
- •5. 5. Технологический регламент на проектирование колонной флотации
- •Низкокремнеземистый концентрат
- •Заключение
2.3. Флотация магнетита
Системных исследований по флотации магнетита катионными собирателями до настоящего времени не проводилось. В литературе имеются лишь фрагментарные сведения, по данному вопросу относящиеся к 50-60- тым годам прошлого столетия с применением первичных аминов[13, 17, 19, 28,32,34].
Очевидно, это связано, прежде всего, с тем, что из всех минералов железа магнетит наиболее эффективно извлекается методом магнитной сепарации и получаемые при этом концентраты по своим качественным показателям до последнего времени удовлетворяли требования промышленности и его флотация не являлась актуальной.
Магнетит (Ре304 или Ре++-Ре2+++-04) принадлежит к классу окислов и кристаллизуется в решетке, характеризующейся ионной связью между структурными элементами. В состав минерала входят катионы железа, образующие слабые основания и анионы кислорода (О") и иногда ОН' с весьма близкими ионными радиусами.
Ионный характер сил, связывающий катионы и анионы в решетке минерала, и наличие ненасыщенных сил этого типа на их внешней поверхности предопределяют способность магнетита к активному взаимодействию с диполями воды, к образованию устойчивых гидратных слоев и сильно выраженной гидрофильности окислов и гидроокислов железа [ ]. Ионы водорода и гидроксила в данном случае являются потенциалопределяющими, что обуславливает существенное влияние рН среды на состояние поверхности, адсорбционные и флотационные свойства магнетита. Кроме того в работах В.А. Чантурия [78], А.А. Абрамова [2], Ф. П. Белаш и А.И. Андреева [12] установлено влияние окислительно- восстановительного потенциала и аэрации пульпы на поверхностные и флотационные свойства минералов железа.
В этой связи нами выполнены термодинамический анализ возможных реакций в системе «Ре304 - Н20» в широком диапазоне значений рН и ЕЬ раствора. На рисунке приведена диаграмма Пурбэ, позволяющая диагностировать состояния для гидратированной формы окислов железа
Рис.
9.
Диаграмма термодинамической устойчивости
системы «магнетит-вода» (гидратированная
форма окислов)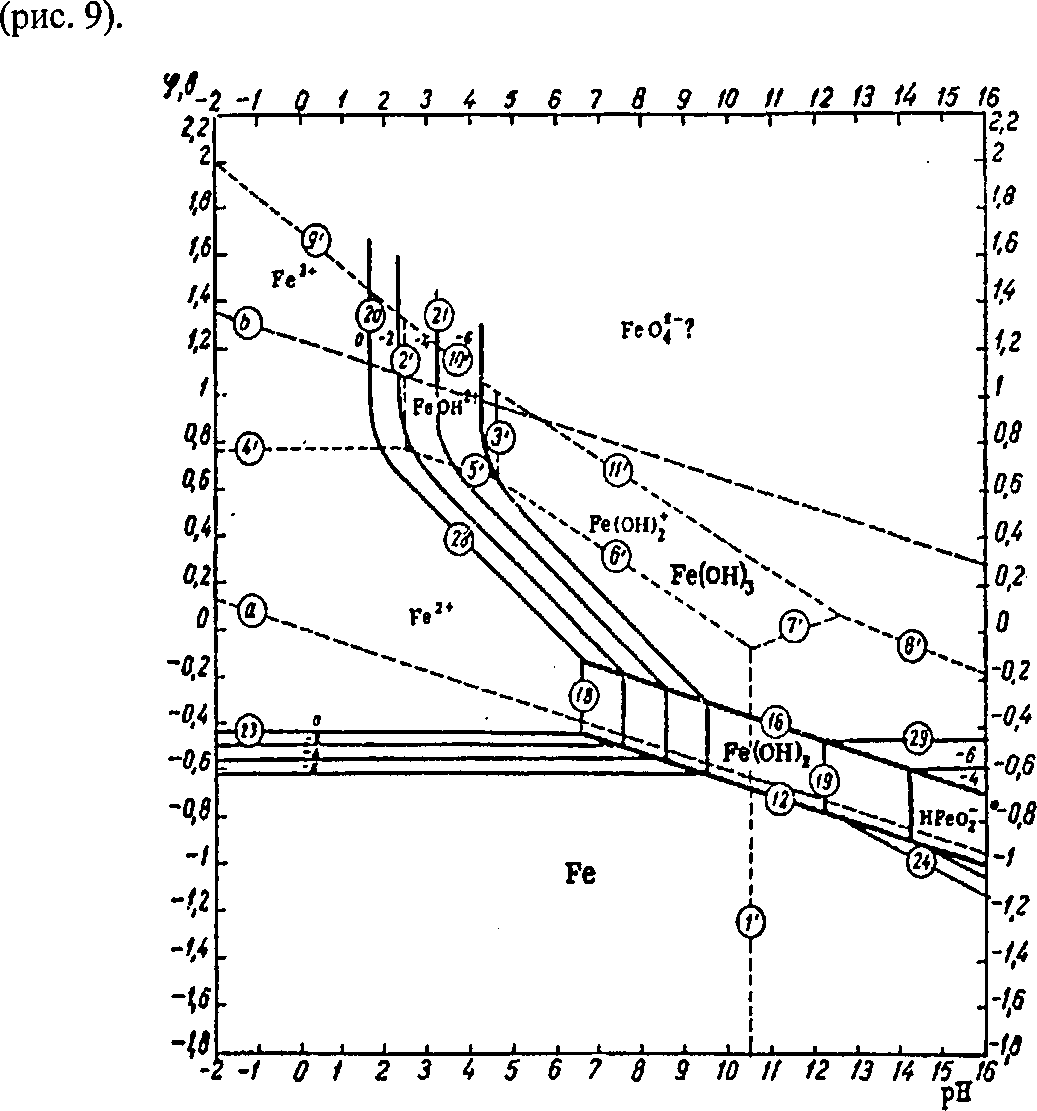
На диаграмме границы полей устойчивости твердофазных соединений обозначены сплошными линиями, а между растворимыми формами - пунктирными.
При этом цифры в кружочках на линиях обозначают соответствующие этим линиям (границам) номера реакций и уравнений расположенных по тексту.
Соотношения, определяющие активность компонентов, выражаются реакциями между устойчивыми в воде твердыми веществами - магнетитом и гематитом с одной стороны и растворенными в ней компонентами - с другой.
Граница поля устойчивости данного твердого вещества условно проведена через точки, в которых сумма активностей ионов, находящихся в равновесии с данным твердым веществом, превышает некоторую принятую величину (10'6). Если сумма активностей известных компонентов раствора, находящихся в равновесии с каким-либо твердым веществом, меньше 10"6, то это твердое вещество будет вести себя в данной среде как неподвижный компонент.
На диаграмме изображены также изолинии суммы активностей ионов, равной 10"4, 10'2 и 10°. Эти изолинии характеризуют изменение «растворимости» в зависимости от рН и Eh раствора. Между полями ионов проведены границы, а каждое поле обозначено индексом преобладающего иона. Граница поля какого-либо иона показана там, где активность данного иона становится равной активности иона, преобладающего в смежном поле.
|
Термодинамический анализ всех возможных реакций в системе «магнетит-вода» показывает, что в широкой области значений рН и окислительно-восстановительного потенциала (Eh) среды наиболее вероятными продуктами окисления будут гидроксиды двух- и трехвалентного железа: Fe(OH)2 и Fe(OH)3. К растворимым компонентам этой системы относятся ионы трехвалентного железа Fe\lÜH, Fe(OH)l^H,. FeO;eod,K и ионы двухвалентного железа Fe]^, Fe(OHYeodH^ и HFeO'endl1'. |
Fe2+/HFeO~ |
pH = 10,53 |
| ||
|
2'. |
Fe3*/FeOH2 + |
pH = |
= 2.43 |
| |
|
3'. |
PeOH2+/Fe (ОН)+ |
pH = |
= 4.69 |
| |
|
4'. |
Pe2T/Fes + |
|
0.771 |
| |
|
5'. |
Pe2+/Fe (OH)2 + |
? = |
0,914 - |
•0,0591 pH | |
|
6'. |
Fe2+/Fe (OH)2+ |
? = |
1,191- |
■0.1182 pH | |
|
7'. |
HFeO'/Fe (OH)+ |
<? = |
-0,675 + 0,0591 f | ||
|
8'. |
HFe0~/Fe02~ |
? = |
1.001 — |
• 0.0738 pH | |
|
9'. |
Fe3+/FeOj" |
? = |
1,700- |
•0,1580 pH | |
|
10'. Fe0Ha+/Fe02~ |
? = |
1.652 — |
■0,1379 pH | ||
|
11'. |
Fe (0H)2+/Fe02~ |
? = |
1.559 — |
■0,1182 pH | |
le. Fei++2HjO = Fe(OH)j+2H+
Ig (Fe2 + } = 13,29 -2pH
Fe(0H)2 = HFe02" + H+
lg (HFeOj-J = -18.30-f pH
203. 2Fe3 + -f-3H20 = Fe203-f 6H+
lg {Fe3 +} = — 0,72 — 3pH
Fe3+ -t-3H20=Pe (0H)3-f 3H+
lg {Fe3 + } = 4,84 —3pH 21a. 2Fe0HJ + + H20 = Fe503 + -lH+
lg {FeOHî + } = — 3,15 —2pH
216. FeOHî+ + 2H20 = Fe(OH)3-f2H+
Ig {FeOH2 + | = 2,41 — 2pH 22a. 2Fe (0H)2+ = Fe203 + H20-f-2H+
lg (Fe (OH)2+) = -7,84-pH 22®. Fe (OH)+ + H20 = Fe (OH), + H+
Ig [Fe (OH)+} = -2,28-pH
28a. 2Fe2 + -f 3H20 = Fe203 + 6H+ -f 2e~
? = 0,728 — 0,1773 pH -0,0591 Ig (Fe1 286. Fe2 + + 3H20 = Fe (0H)3 -+ 3H+ -f e"
9« 1,057 — 0,1773 pH — 0,0591 Ig {Fe 293. 2HFeO; = Fe203 -f H20 + 2e~
? = -1.139 - 0,0591 Ig {HFeOj-j 296. HFeOj" + H20 = Fe (OH)3 + «r
<? = —0,810 —0,0591 Ig {HFeOj-
JСоотношения активностей железосодержащих ионов в равновесии с гидроксидом двухвалентного железа Ре(ОН)г описывают реакции №№18, 19 и соответствующие им уравнения, а с гидроксидом трехвалентного железа - соответственно реакции и уравнения №№ 20, 21б, 22б, 28б и 29б. Решение указанных уравнений для соответствующих заданных условий позволяют определить активную концентрацию растворимых компонентов.
Пунктирные линии и соответствующие им номера реакции Г-1Г описывают границы полей преобладания концентраций тех или иных растворимых компонентов.
Особенностью диаграммы состояния магнетита является резкая ограниченность поля иона трехвалентного железа. Только в очень кислых и сильно окислительных условиях активность этого иона превышает 10*6. Высокая устойчивость гематита с очевидностью доказывается размерами его поля, которое охватывает диапазон от умеренно кислой окислительной среды до сильно восстановительных, нейтральных и щелочных условий. В данной системе «растворимость» почти целиком обусловливается концентрацией иона двухвалентного железа, поле которого глубоко проникает в поля устойчивости твердых веществ. Ни у гематита, ни у магнетита в пределах рН от 0 до 12 не обнаружено заметных амфотерных свойств. Активность иона НРеОз по отношению к устойчивой области существования Ре(ОН)г превышает 10'6 только при значениях рН >12,0.
В результате анализа диаграмм можно отметить, что в слабоокисленной среде наиболее устойчивым соединением на поверхности магнетита является гидроксид трехвалентного железа Ре(ОН)3 на фоне
04- О
существования в растворе ионов Ре до рН =10,5 (реакция Г) и НБеО " в более щелочной среде. Таким образом, по мере увеличения положительных значений окислительно-восстановительного потенциала (ЕЬ) и рН пульпы вместе с ростом области существования ионов ШеО" возрастают и амфотерные свойства магнетита
.
|
с О) ГС 1Л 1 | ||||||||||||
|
|
|
|
|
09 СЭ Ю...Й СП N N 03 V СО |
И т
ГО 1 1 1 .Д1 |
го СО С\ со а • а N 1 |
N !* 1 * 1 • / 1/ |
ВЙ |
ш О и л |
СП со 0 -О N |
* Й оэ 1Л ® н Ш £ N
< . и V V ' 1 /-м^уЧ^ | |
|
|
|
|
|
|
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Углы
- 2Тета;
Интенсивность - приведенная> Вся
икала = 3000
24.0
32.0
48.0
56.00
20
40.0
16.0
в.е
Анализ
дефрактограмм магнетита не подтверждает
образование других соединений на его
поверхности (рис 10).
Рис. 10. Дифрактограмма РФА магнетита
Таким образом, рассчитанные диаграммы состояния магнетита в водных растворах позволяют выявить наиболее устойчивые соединения на поверхности минерала и в объеме раствора (пульпы), определяющие его адсорбционные и флотационные свойства.
Результаты экспериментальных исследований физико-химических характеристик процесса взаимодействия магнетита с аминоэфиром в интервале изменений рН среда отЗ до 11 представлены на рис. 11.
Магнетит, также как и кварц имеет отрицательный дзета-потенциал в диапазоне значений рН от 4,0 до 10,5 с максимумом при рН = 7,5.
Такой характер изменения электрокинетического потенциала свидетельствует о том, что в данных условиях потенциалопределяющими ионами для магнетита также как и для кварца являются катионы водорода Н
*
и ионы гидроксила ОН". Поэтому изменение величины дзета-потенциала определяется соотношением концентраций водородных и гидроксильных ионов в растворе.
100
90
80
70
60
50
40 30 20
10
0
10
11 рН
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
/ |
Л |
|
|
|
|
|
|
|
/з |
|
|
|
|
|
а/ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
.—■—' |
|
и— |
|
|
5 |
8
-70
-60
-50
-40
-30 -20
-10
0 +10
Рис. 11. Физико-химические характеристики и флотируемость магнетита аминоэфиром (30 г/т): 1 - эле$трокинетический потенциал шВ); 2 - адсорбция (Г, % условного монослоя); 3 - краевой угол смачивания (0, град); 4 - извлечение магнетита (г, %); 5 - извлечение магнетита в присутствии щелочного крахмала («300 г/т).
Отрицательный знак заряда поверхности магнетита в широком интервале значений рН предопределяет возможность его взаимодействия с катионным собирателем и флотацию. Магнетит активно адсорбирует значительное количество катионного собирателя, вплоть до монослойного покрытия поверхности и более (рис.11; кривая 2). Вместе с тем необходимо отметить, что адсорбция собирателя, краевой угол смачивания и флотируемость магнетита в значительной степени зависят от рН среды
.
Изменения электрокинетического потенциала и адсорбции аминоэфира при различных значениях рН для магнетита и кварца имеют достаточно близкий характер. Адсорбция положительно заряженных ионов собирателя на отрицательно заряженной поверхности минерала снижает ее заряд вплоть до изменения его первоначального знака.
В диапазоне значений рН от 5 до 7 дзета-потенциал магнетита имеет положительные значения (около +5 мВ), после чего наблюдается быстрое смещение потенциала в область отрицательных значений с перезарядкой поверхности при рН около 7,5 (рис. 11; кривая 1). Максимум флотационного извлечения магнетита и гематита соответствует минимальному значению дзета-потенциала и наблюдается в нейтральной среде при рН = 7-7,5 (рис 11; кривая 4).
Однако уровень максимального извлечения магнетита, в отличие от кварца, даже при высокой плотности сорбции собирателя, достигающей 100% условного монослоя, не превышает 70%. Низкий уровень флотационного извлечения магнетита объясняется, по-видимому, отсутствием в этих условиях молекулярной формы собирателя, что подтверждается анализом ИК-спектров магнетита, образованного реагентом РА-12 (рис. 12).
Флотируемость магнетита снижается с повышением значений рН>8,0 и соответствует снижению величины краевого угла смачивания. Минимум флотируемости при рН~10,0 наблюдается при наиболее отрицательном значении дзета-потенциала.
Отмеченные закономерности находятся в корреляции с диаграммой состояния поверхности магнетита. Максимум адсорбции катионного собирателя и флотации магнетита при рН = 7,0-7,5 соответствует образованию на его поверхности метастабильного гидроксида трехвалентного железа на фоне переходящих в объем раствора катионов двух и трехвалентного железа Бе24" и Ре{ОНУ2
.
Поверхность минерала приобретает отрицательный заряд, способствующий электростатической адсорбции катионов собирателя во внешней обкладке двойного электрического слоя с возможным образованием более устойчивых внутрикомплексных соединений с железом. При увеличении щелочности пульпы возможно увеличение сорбции конкурирующих ионов гидроксила, а при рН > 10,0 образование гидрофильных соединений железа, связанных с увеличением концентрации ионов Н Ре 02".
В отличие от кварца неравновесная адсорбция аминоэфира на минералах железа имеет максимум не в щелочной среде, как для кварца (рН ~ 10), а в нейтральной - при рН = 7-7,5. При этих же значениях рН имеет место максимум флотационного извлечения магнетита. Таким образом, создаются благоприятные условия для селективной флотации кварца и магнетита, даже в отсутствие депрессоров окислов железа.
Рис.
12. ИК-спектр магнетита после адсорбции
реагента МПА-13
Частота,
см"1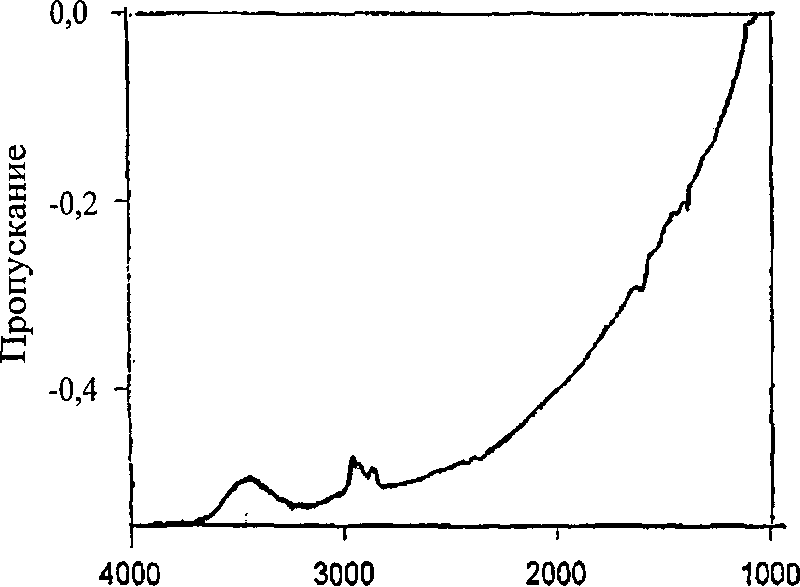
.
