
- •Розділ 1
- •1.2. Фізико-хімічна механіка як наукова дисципліна, її задачі
- •1.3. Дисперсні системи. Класифікація дисперсних систем з позицій фізико-хімічної механіки композиційних матеріалів
- •1.3.6. Періодичні колоїдні системи.
- •1.4. Особливості властивостей колоїдних систем
- •1.5. Короткий історичний огляд
- •Розділ 2
- •2.2. Змочування і набухання
- •2.3. Спонтанні процеси на межі розділу фаз
- •Розділ 3
- •3.2. Теорія мономолекулярної адсорбції Ленгмюра
- •3.3. Полімолекулярна адсорбція
- •3.4. Рівняння Гіббса. Двомірний тиск
- •3.5. Правило Дюкло-Траубе
- •3.6. Адсорбція на межі тверде тіло – розчин
- •Розділ 4
- •4.2. Класифікація пар за хімічною будовою
- •4.3. Аніоноактивні пар
- •4.4. Катіоноактивні пар
- •4.5. Класифікація пар за механізмом дії
- •4.6. Термодинамічні, поверхневі й об'ємні властивості розчинів пар у зв'язку зі стійкістю дисперсних систем
- •4.7. Використання пар в техніці
- •Розділ 5
- •5.1.1. Будова подвійного електричного шару (пдеш)
- •5.2. Стійкість і коагуляція дисперсних систем
- •5.3. Седиментаційна (кінетична) стійкість
- •5.4. Процеси стабілізації дисперсних систем і їхня роль у техніці
- •Розділ 6
- •6.2. Загальні відомості про структуроутворення в дисперсних системах
- •Розділ 7
- •7.2. Методи реологічного моделювання
- •7.3. Криві течії і в'язкості
- •7.4. Методика побудови реологічних кривих
- •7.5. Моделі і рівняння течії структурованих дисперсних систем
- •7.6. Про реологічні криві течії і в'язкості структурованих рідин на прикладі цементобетонних сумішей
- •Іі частина
- •8.2. Розчинення в'яжучих речовин
- •8.3. Основні закономірності кінетики кристалізації нової фази з пересичених розчинів і фазовий склад цементного каменю
- •8.4. Формування структури цементного каменю
- •Розділ 9
- •9.2. Основні параметри вібраційного ущільнення бетонної суміші
- •9.3. Вібродиспергування та виброперемішування суміші
- •9.4. Основи технології виробництва дорожніх бетонів на основі органічних в'яжучих
- •9.4.2. Принцип та метод визначення температури перемішування сумішей
- •9.4.3. Температурні параметри приготування сумішей
- •9.4.4. Змочування кам'яних матеріалів в'яжучим як фактор якості перемішування
- •9.4.5. Зміст процесу ущільнення асфальтобетону.
- •9.4.6. Шляхи інтенсифікації ущільнення сумішей
- •Розділ 10
- •10.1. Склад, структура і властивості кам'яновугільних дорожніх дьогтів
- •10.2 Склад, структура і властивості нафтових дорожніх бітумів
- •10.3. Бітумні емульсії
- •10.3.2. Бітумні емульсії – мікрогеторогенні дисперсні системи
- •10.3.3. Технологія виробництва
- •Технічна характеристика диспергатора дб – 1
- •Технічна характеристика триступеневого диспергатора
- •10.3.4. Фізико-механічні властивості та технологічні вимоги.
- •10.3.5. Галузі застосування.
- •Бітумополімерні в’яжучі і асфальтобетони на їх основі
- •Розділ 11
- •11.2. Дьогтебетон
- •11.3. Асфальтобетон
- •11.3.1. Утомленісна довговічність асфальтобетонів і роль агресивних середовищ
- •11.4. Дьогтебетони і асфальтобетони з комплексно-модифікованою мікроструктурою
- •Рекомендована література до вивчення теоретичного матеріалу
2.3. Спонтанні процеси на межі розділу фаз
З термодинаміки відомо – система знаходиться в стійкій рівновазі, якщо її вільна енергія мінімальна в даних умовах:
F = Fmin (2.21)
Якщо надлишок вільної енергії в поверхневому шарі,
F1,2 = 1,2S1,2 , (2.22)
то зміна надлишку вільної енергії поверхневого шару, який визначається шляхом множення поверхневого натягу σ1,2 на площу поверхневого шару S1,2 , може йти двома шляхами:
площа поверхневого шару S1,2 постійна, змінюється тільки поверхневий натяг σ1,2;
поверхневий натяг σ1,2 – постійний, змінюється тільки площа поверхні розділу S1,2.
У першому випадку мають місце – адсорбційні процеси поверхнево-активних речовин – згущування в поверхневому шарі компонентів, що знижують своєю присутністю поверхневий натяг.
Спонтанний процес пониження σ1,2 – поверхневого натягу продовжуватиметься до тих пір, поки не досягне мінімально можливого в даних умовах значення σ1,2 → min.
У другому випадку всі самовільні процеси ведуть до зменшення поверхні розділу фаз до мінімуму. Наприклад, прагнення краплі рідини набрати рівноважної форми кулі.
Самовільні процеси ведуть до коалісценції і коагуляції – Smin при Vconst.
Розділ 3
АДСОРБЦІЯ. ОСНОВНІ ЗАКОНОМІРНОСТІ АДСОРБЦІЇ
3.1. Адсорбція. Основні закономірності адсорбції
3.2. Теорія мономолекулярної адсорбції
3.3. Полімолекулярна адсорбція
3.4. Рівняння Гіббса. Двомірний тиск
3.5. Правило Дюкло - Траубе
3.6. Адсорбція на межі тверде тіло – розчин
3.1. Адсорбція. Основні закономірності адсорбції
Адсорбцією (Г) називається згущення (концентрування) газоподібної чи розчиненої речовини на поверхні розподілу фаз – на поверхні твердого тіла або рідини. Газ або розчинену речовину прийнято називати адсорбтивом або адсорбатом, а речовину, що адсорбує їх, – адсорбентом.
Розрізняють фізичну (адсорбційні сили – міжмолекулярні сили Ван-дер-Ваальса) і хімічну адсорбцію – хемосорбцію. Фізична адсорбція завжди оборотна, хімічна як правило необоротна.
Фізична адсорбція протікає самовільно. Адсорбтив прагне цілком зайняти всю поверхню адсорбенту. Цьому перешкоджає десорбція, викликана прагненням до рівномірного розподілу речовини внаслідок теплового руху. Для кожної концентрації адсорбтиву в навколишньому середовищі існує стан адсорбційної рівноваги, аналогічний рівновазі між конденсацією і випаром Г → f (Cm, Т, p).
Кількість адсорбованої речовини в даний момент часу характеризується відношенням надлишку його в поверхневому шарі до площі поверхні чи до маси адсорбенту Г, моль/см2, мольсм-2; Г, моль/г, мольг-1. Адсорбцію можна характеризувати по-різному.
Для цього визначають:
залежність кількості адсорбованої речовини від температури Г = f (Т) при рівноважному тиску p або концентраціях C = const.
Графіки Г = f (Т) при p = const називають ізобарами, а при С = const – ізопікнами адсорбції:
залежність рівноважного тиску (концентрації) від температури при постійних кількостях адсорбційної речовини; графіки p = f (Т) і С = f (Т) при Г – const – називають ізостерами;
залежність кількості адсорбованої речовини від рівноважного тиску або концентрації при постійній температурі. Графіки Г = f(p) при Т = const або Г = f (С) при Т = const називають ізотермами адсорбції (рис. 3.1).
Як видно з рис. 3.1, ізотерми мають три ділянки, дві з яких прямолінійні й одна криволінійна.
|
ІІІ
І ІІ 1 2 Г Рр
(Сс) |
Рис.3.1. Загальний вид ізотерм адсорбції при різних температурах: 1 – Т1; 2 – Т2 (Т2 Т1)
|
І ділянка – адсорбція при невеликих тисках чи концентраціях пропорційна або тиску або концентрації; це відповідає в значній мірі ще вільній поверхні адсорбенту.
ІІ ділянка – перехідна ділянка.
ІІІ ділянка – відповідає поверхні адсорбенту, повній насиченості адсорбтивом.
Якщо на поверхні виник мономолекулярний шар адсорбтиву, кількість адсорбованої речовини перестає практично залежати від тиску чи концентрації.
Ізотерма адсорбції за своїм виглядом нагадує параболу. Тому Бедекер, а потім Фрейндліх для її аналітичного визначення запропонували рівняння (3.1):
 (3.1)
(3.1)
де: х – кількість молів адсорбованої речовини; m – маса адсорбенту;
К і
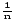 – константи; p – рівноважний тиск газу
навколо адсорбенту.
– константи; p – рівноважний тиск газу
навколо адсорбенту.
Для адсорбції з розчинів рівняння Бедекера – Фрейндліха записують так:
 (3.2)
(3.2)
де β-константа,
що відповідає константі К
рівняння 3.1;
С
– рівноважна
концентрація, моль·л-1.
Фізичний зміст β при С=1 – величина
адсорбції при рівноважній концентрації
адсорбтива, що відповідає 1 моль·л-1.
Показник ,
що пред’являє собою правильний дріб,
характеризує ступінь наближення ізотерми
до прямої. З підвищенням температури β
– зменшується, а
,
що пред’являє собою правильний дріб,
характеризує ступінь наближення ізотерми
до прямої. З підвищенням температури β
– зменшується, а – зростає.
– зростає.
Рівняння (3.1; 3.2) придатні для інтервалу середніх тисків і концентрацій.
Константи рівняння Фрейндліха знаходять графічно при логарифмуванні рівняння (рис. 3.2):
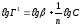 (3.3)
(3.3)
|
|
Рис.3.2. Логарифмічна ізотерма адсорбції де:
Г´ = моль г-1; Ср = моль л-1
|







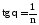 ;
;