
- •Розділ 1
- •1.2. Фізико-хімічна механіка як наукова дисципліна, її задачі
- •1.3. Дисперсні системи. Класифікація дисперсних систем з позицій фізико-хімічної механіки композиційних матеріалів
- •1.3.6. Періодичні колоїдні системи.
- •1.4. Особливості властивостей колоїдних систем
- •1.5. Короткий історичний огляд
- •Розділ 2
- •2.2. Змочування і набухання
- •2.3. Спонтанні процеси на межі розділу фаз
- •Розділ 3
- •3.2. Теорія мономолекулярної адсорбції Ленгмюра
- •3.3. Полімолекулярна адсорбція
- •3.4. Рівняння Гіббса. Двомірний тиск
- •3.5. Правило Дюкло-Траубе
- •3.6. Адсорбція на межі тверде тіло – розчин
- •Розділ 4
- •4.2. Класифікація пар за хімічною будовою
- •4.3. Аніоноактивні пар
- •4.4. Катіоноактивні пар
- •4.5. Класифікація пар за механізмом дії
- •4.6. Термодинамічні, поверхневі й об'ємні властивості розчинів пар у зв'язку зі стійкістю дисперсних систем
- •4.7. Використання пар в техніці
- •Розділ 5
- •5.1.1. Будова подвійного електричного шару (пдеш)
- •5.2. Стійкість і коагуляція дисперсних систем
- •5.3. Седиментаційна (кінетична) стійкість
- •5.4. Процеси стабілізації дисперсних систем і їхня роль у техніці
- •Розділ 6
- •6.2. Загальні відомості про структуроутворення в дисперсних системах
- •Розділ 7
- •7.2. Методи реологічного моделювання
- •7.3. Криві течії і в'язкості
- •7.4. Методика побудови реологічних кривих
- •7.5. Моделі і рівняння течії структурованих дисперсних систем
- •7.6. Про реологічні криві течії і в'язкості структурованих рідин на прикладі цементобетонних сумішей
- •Іі частина
- •8.2. Розчинення в'яжучих речовин
- •8.3. Основні закономірності кінетики кристалізації нової фази з пересичених розчинів і фазовий склад цементного каменю
- •8.4. Формування структури цементного каменю
- •Розділ 9
- •9.2. Основні параметри вібраційного ущільнення бетонної суміші
- •9.3. Вібродиспергування та виброперемішування суміші
- •9.4. Основи технології виробництва дорожніх бетонів на основі органічних в'яжучих
- •9.4.2. Принцип та метод визначення температури перемішування сумішей
- •9.4.3. Температурні параметри приготування сумішей
- •9.4.4. Змочування кам'яних матеріалів в'яжучим як фактор якості перемішування
- •9.4.5. Зміст процесу ущільнення асфальтобетону.
- •9.4.6. Шляхи інтенсифікації ущільнення сумішей
- •Розділ 10
- •10.1. Склад, структура і властивості кам'яновугільних дорожніх дьогтів
- •10.2 Склад, структура і властивості нафтових дорожніх бітумів
- •10.3. Бітумні емульсії
- •10.3.2. Бітумні емульсії – мікрогеторогенні дисперсні системи
- •10.3.3. Технологія виробництва
- •Технічна характеристика диспергатора дб – 1
- •Технічна характеристика триступеневого диспергатора
- •10.3.4. Фізико-механічні властивості та технологічні вимоги.
- •10.3.5. Галузі застосування.
- •Бітумополімерні в’яжучі і асфальтобетони на їх основі
- •Розділ 11
- •11.2. Дьогтебетон
- •11.3. Асфальтобетон
- •11.3.1. Утомленісна довговічність асфальтобетонів і роль агресивних середовищ
- •11.4. Дьогтебетони і асфальтобетони з комплексно-модифікованою мікроструктурою
- •Рекомендована література до вивчення теоретичного матеріалу
1.3. Дисперсні системи. Класифікація дисперсних систем з позицій фізико-хімічної механіки композиційних матеріалів
1.3.1. Дисперсними (мікрогетерогенними) системами називаються системи, що складаються з двох чи декількох фаз, одна з яких представлена окремими дрібними часточками (дисперсна фаза), розподіленими в іншій неперервній фазі (дисперсійне середовище).
Коли розміри часточок настільки малі, що їх можна порівняти з найбільшою товщиною граничного шару (з робіт Б.В. Дерягіна – 1·10-7м) система стає гранично дисперсною – колоїдною. Подальше диспергування дисперсної фази, якщо воно можливо в даному середовищі, привело б до утворення гомогенної однофазної системи – істинного розчину.
Дисперсність виражається
питомою поверхнею дисперсної фази
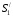 і
визначається відношенням (1.1):
і
визначається відношенням (1.1):
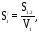 м-1
(см-1), або
м-1
(см-1), або 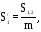 м2/кг
(см2/г) (1.1)
м2/кг
(см2/г) (1.1)
де: S 1,2 – поверхня розподілу між дисперсною фазою (1) і дисперсійним середовищем (2); V1 – об’єм дисперсної фази; m – маса часток дисперсної фази.
Наприклад, питома поверхня цементу і мінерального порошку складає 300 м2/кг та 200…400 м2/кг відповідно. Швидкотверднучі цементи виготовляють шляхом тонкого помелу цементного клінкеру до величини питомої поверхні близької 500 м2/кг, при цьому забезпечується суттєва зміна властивостей цементу.
Дисперсність обернено пропорційна лінійним розмірам часточок і виражається в м-1 (см-1). Оскільки поверхня часточок пропорційна квадрату їхнього радіуса, а обсяг – кубу радіуса, дисперсність може бути виражена через радіус r чи діаметр δ = 2 r часточок дисперсної фази (1.2):
 (1.2)
(1.2)
де: β – коефіцієнт форми.
Для часточок кулястої форми, що мають найменшу поверхню при заданому об’ємі, β мінімально (β = 6).
У цьому випадку об’єм кулі V = (4/3)∙πr3, поверхня кулі S = 4 πr2.
 (1.3)
(1.3)
У загальному випадку β 6.
Наочне уявлення про розвиток поверхні в дисперсних системах і про положення колоїдної області дає графік залежності величини питомої міжфазної поверхні від радіуса часток твердої фази. Крива дисперсності S′1 = f (r) має форму рівносторонньої гіперболи. Згідно з (рис. 1.1) колоїдні дисперні системи – це проміжні системи між грубодисперсними та молекулярними системами. Представники таких систем у будівельному матеріалознавстві є: глини, цементи у стадії гідратації в цементному тісті; бітуми, коли асфальтени знаходяться у завислому стані у мальтеновому середовищі з масел та смол тощо. Але будівельне матеріалознавство вивчає і грубодисперсні системи: цементобетони, асфальтобетони, пластмаси і таке інше.
|
|
|
Рис.1.1.
Залежність питомої міжфазної поверхні
дисперсної системи
|
З підвищенням дисперсності питома поверхня дисперсної системи різко зростає (табл. 1.1).
Властивості дисперсних систем суттєво відрізняються між собою (табл. 1.2) саме завдяки розмірам їх складових часток. В основу розподілення дисперсних систем покладені не просто розміри, а саме властивості (табл. 1.2).
Таблиця 1.1
|
Довжина ребра кубика, см |
Число кубиків, N |
Об’єм кубика, см3 |
Поверхня кубика, см2 |
|
|
1 |
1 |
1 |
6 |
6 |
|
1 · 10-2 |
1 · 106 |
1 ·10-6 |
6 · 10-4 |
6 · 102 |
|
1 · 10-7 (1 нм) |
1 · 1021 |
1 · 10-21 |
6 · 10-14 |
6 · 107 |
Таблиця 1.2
Властивості дисперсних та молекулярних систем
|
Тонко- і грубодисперсні = 10-4 … 10-7 м |
Колоїдно-дисперсні = 10-7 … 10-9 м |
Молекулярні та іонні розчини < 10-9 м |
|
Непрозорі, відбивають світло |
Прозорі, розсіюють світло, опалесцюють |
Прозорі, не опалесцюють |
|
Частки не проходять крізь паперовий фільтр |
Частки проходять крізь паперовий фільтр |
Проходять крізь паперовий фільтр |
|
Частки затримуються целофаном |
Частки затримуються целофаном |
Частки проходять крізь целофан |
|
Гетерогенні |
Гетерогенні |
Гомогенні |
|
Нестійкі |
Відносно стійкі |
Цілком стійкі |
|
Частки, що видимі в оптичний мікроскоп |
Частки, що видимі в електронний мікроскоп |
Частки, невидимі у сучасні мікроскопи |
Примітка: Опалесценція - розсіювання світла, зниження прозорості розчину.
1.3.2. Класифікація дисперсних систем за агрегатним станом фаз (запропонована В. Освальдом: імовірні 9 комбінацій дисперсної фази і дисперсійного середовища в різних їх станах, табл. 1.3).
У колоїдній хімії всі системи, що відповідають колоїдній дисперсності, прийнято називати золями. Тому системи ж/г і т/г мають загальну назву аерозолів.
Колоїдні системи з рідким дисперсійним середовищем (г/р, р/р і т/р) називають ліозолями (від грец. ліоз - рідина) (табл. 1.3).
1.3.3. Класифікація дисперсних систем (колоїдних розчинів) за інтенсивністю молекулярних взаємодій на границі розподілу фаз здійснюється за здатністю сухого залишку, отриманого при обережному випаровуванні, розчинятися в чистому дисперсійному середовищі.
Системи, сухий залишок яких не здатний самовільно диспергуватися в дисперсійному середовищі, називаються необоротними (наприклад, ліозолі металів, гідрозолі йодиду срібла та ін.).
Таблиця 1.3
|
Дисперсна фаза |
Дисперсійне середовище |
Умовне позначення системи |
Назва системи |
|
Дисперсні системи в газах | |||
|
Газ
Рідина Тверде тіло |
Газ
Газ Газ |
г/г
р/г т/г |
Колоїдна система не можлива Туман Дим, пил |
|
Дисперсні системи в рідинах | |||
|
Газ
Рідина Тверде тіло |
Рідина
Рідина Рідина |
г/р
р/р т/р |
Піна, газова емульсія
Емульсія Колоїдний розчин |
|
Дисперсні системи у твердих тілах | |||
|
Газ
Рідина Тверде тіло |
Тверде тіло
Тверде тіло Тверде тіло |
г/т
р/т т/т |
Тверда піна, пористе тіло Тверда емульсія Твердий золь, сплав |
Оборотними колоїдними системами називаються системи, у яких сухий залишок при зіткненні із середовищем звичайно спочатку набухає, а потім самовільно розчиняється й утворює колишню дисперсію (наприклад, розчин желатини у воді або каучуку у бензолі). Дисперсна фаза оборотних колоїдів молекулярно взаємодіє з дисперсійним середовищем і тому здатна в ній розчинятися. За цією ознакою дисперсні системи поділяють на дві основні групи ліофільні (оборотні), – розчини ВМР) і системи ліофобні (необоротні) – типові колоїдні системи.
Ліофільні системи – стійкі і стабільні у часі. Ліофобні – нестійкі і поступово руйнуються, виділяючи дисперсну фазу внаслідок коагуляції – укрупнення її часточок під дією молекулярних сил зчеплення.
1.3.4. Дисперсні системи також підрозділяються на вільнодисперсні і зв’язнодисперсні. У перших частинки дисперсної фази не зв'язані в одну суцільну сітку і здатні незалежно одна від одної переміщатися в дисперсійному середовищі під впливом теплового руху або сили ваги (розведені суспензії, емульсії, аерозолі – мають плинність і усі властивості, що характерні для рідин).
Зв’язнодисперсні системи – це системи, у яких часточки дисперсної фази зв'язані одна з одною за рахунок молекулярних сил, вони утворюють в дисперсійному середовищі своєрідні просторові сітки або каркаси (структури). Структуротвірні елементи роблять лише коливальні рухи – пасти (концентровані суспензії), концентровані емульсії, порошки.
Перехід золю в стан гелю називається гелеутворенням (коагуляцією), а процес утворення золю з гелю (зворотна коагуляція) зветься пептизацією. Ці переходи відбуваються за схемою:
|
Вільнодисперні → системи – золі ← |
Пептизація ← |
Зв’язнодисперсні структури – гелі
коагелі ліогелі (ліофобні системи) (ліофільні системи) |
1.3.5. Класифікація дисперсних систем за розмірами часточок дисперсної фази (рис. 1.1).
Колоїдними вважаються часточки з діаметром δ<0,1 мкм, чи <10-5см, якщо δ >1мкм, чи > 10-4см – грубодисперсні.
Частки з розмірами менш 1 мкм виявляють помітний броунівський рух.
Седиментація (осадження) часточок з діаметром менш 0,1 мкм під дією сили ваги практично врівноважується броунівським рухом, тобто їх дифузією.
|
Діаметр частинок..... |
більше 1 мкм......... |
0,1 - 1мкм................................. |
менше 0,1 мкм |
|
Система...... |
грубодисперсна…. |
з проміжною дисперсністю… |
колоїдно-дисперсна |
|
|
|
(мікрогетерогенні) |
|


 від
розміру її часток r
від
розміру її часток r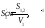
 Коагуляція
→
Коагуляція
→