
- •Розділ 1
- •1.2. Фізико-хімічна механіка як наукова дисципліна, її задачі
- •1.3. Дисперсні системи. Класифікація дисперсних систем з позицій фізико-хімічної механіки композиційних матеріалів
- •1.3.6. Періодичні колоїдні системи.
- •1.4. Особливості властивостей колоїдних систем
- •1.5. Короткий історичний огляд
- •Розділ 2
- •2.2. Змочування і набухання
- •2.3. Спонтанні процеси на межі розділу фаз
- •Розділ 3
- •3.2. Теорія мономолекулярної адсорбції Ленгмюра
- •3.3. Полімолекулярна адсорбція
- •3.4. Рівняння Гіббса. Двомірний тиск
- •3.5. Правило Дюкло-Траубе
- •3.6. Адсорбція на межі тверде тіло – розчин
- •Розділ 4
- •4.2. Класифікація пар за хімічною будовою
- •4.3. Аніоноактивні пар
- •4.4. Катіоноактивні пар
- •4.5. Класифікація пар за механізмом дії
- •4.6. Термодинамічні, поверхневі й об'ємні властивості розчинів пар у зв'язку зі стійкістю дисперсних систем
- •4.7. Використання пар в техніці
- •Розділ 5
- •5.1.1. Будова подвійного електричного шару (пдеш)
- •5.2. Стійкість і коагуляція дисперсних систем
- •5.3. Седиментаційна (кінетична) стійкість
- •5.4. Процеси стабілізації дисперсних систем і їхня роль у техніці
- •Розділ 6
- •6.2. Загальні відомості про структуроутворення в дисперсних системах
- •Розділ 7
- •7.2. Методи реологічного моделювання
- •7.3. Криві течії і в'язкості
- •7.4. Методика побудови реологічних кривих
- •7.5. Моделі і рівняння течії структурованих дисперсних систем
- •7.6. Про реологічні криві течії і в'язкості структурованих рідин на прикладі цементобетонних сумішей
- •Іі частина
- •8.2. Розчинення в'яжучих речовин
- •8.3. Основні закономірності кінетики кристалізації нової фази з пересичених розчинів і фазовий склад цементного каменю
- •8.4. Формування структури цементного каменю
- •Розділ 9
- •9.2. Основні параметри вібраційного ущільнення бетонної суміші
- •9.3. Вібродиспергування та виброперемішування суміші
- •9.4. Основи технології виробництва дорожніх бетонів на основі органічних в'яжучих
- •9.4.2. Принцип та метод визначення температури перемішування сумішей
- •9.4.3. Температурні параметри приготування сумішей
- •9.4.4. Змочування кам'яних матеріалів в'яжучим як фактор якості перемішування
- •9.4.5. Зміст процесу ущільнення асфальтобетону.
- •9.4.6. Шляхи інтенсифікації ущільнення сумішей
- •Розділ 10
- •10.1. Склад, структура і властивості кам'яновугільних дорожніх дьогтів
- •10.2 Склад, структура і властивості нафтових дорожніх бітумів
- •10.3. Бітумні емульсії
- •10.3.2. Бітумні емульсії – мікрогеторогенні дисперсні системи
- •10.3.3. Технологія виробництва
- •Технічна характеристика диспергатора дб – 1
- •Технічна характеристика триступеневого диспергатора
- •10.3.4. Фізико-механічні властивості та технологічні вимоги.
- •10.3.5. Галузі застосування.
- •Бітумополімерні в’яжучі і асфальтобетони на їх основі
- •Розділ 11
- •11.2. Дьогтебетон
- •11.3. Асфальтобетон
- •11.3.1. Утомленісна довговічність асфальтобетонів і роль агресивних середовищ
- •11.4. Дьогтебетони і асфальтобетони з комплексно-модифікованою мікроструктурою
- •Рекомендована література до вивчення теоретичного матеріалу
4.6. Термодинамічні, поверхневі й об'ємні властивості розчинів пар у зв'язку зі стійкістю дисперсних систем
Відповідно до граничної форми термодинамічного адсорбційного рівняння Гіббса для розведених розчинів, поверхнева активність G΄m визначається найбільшим значенням відносної адсорбції Г (мольсм-2) до рівноважної концентрації С (мольсм-3) в одній з фаз у розчині. Якщо немає точки перегину на ізотермах Г (С), σ (С), найбільше значення (Г/С)m збігається з початковим (Г/С). Визначена в такий спосіб поверхнева активність має розмірність довжини і може бути зіставлена з товщиною адсорбційного шару (звичайно моношару), далеко від насичення δ = 4,5 Å (діаметр поперечного перерізу вуглеводного ланцюга):
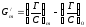 (4.1)
(4.1)
Якщо ПАР розчинний практично тільки в одній з фаз, то
Г = (Сs – С) δ (4.2)
де: Сs – концентрація в адсорбційному шарі і
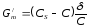 (4.3)
(4.3)
Коли Сs >> С при малих С і досить високій поверхневій активності
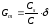 (4.4)
(4.4)
Це свідчить про те, що визначена в такий спосіб поверхнева активність більше δ у співвідношенні Cδ/C. При множенні на величину RT (ерг ∙ моль-1), відповідно до рівняння Гіббса, одержують найбільше значення похідної поверхневого натягу за концентрацією (4.5):
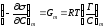 (4.5)
(4.5)
Ця похідна виміряється в ерг·см·моль-1 = Гіббс.
Поверхневу активність можна тоді представити як (4.6):
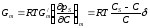 (4.6)
(4.6)
де: рs = σ0 – σ (Г) – двомірний тиск, а для Сs >> С
 (4.7)
(4.7)
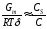 (4.8)
(4.8)
Мийні речовини
знижують σ води на границі з повітрям
при кімнатній температурі з 73 до 30-27
ергсм-2
вже при С ≈ 10-6
мольсм-3,
що відповідає Gm
≈ 107
Гіббс. Таким чином, концентрація в
адсорбційному шарі уже відповідає
чистому ПАР. Фізичний зміст RTδ полягає
в тому, що ця величина визначає найбільше
підвищення σ води на одиницю концентрації
будь-якої поверхнево-активної речовини.
Дійсно, при Г < 0,
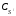 <<С,
<<С,
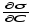 >
0 і
>
0 і
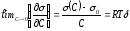 (4.9)
(4.9)
Це означає, що при С=10-3 моль·см-3 (1 моль·л-1) для будь-якої інаактивної мінеральної солі σ(С) – σ0 не більш CRTδ, тобто не більш 0,8 ерг·см-2 (моль·л-1).
Найбільша
поверхнева активність
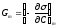 відповідно до теорії Ленгмюра зростає
з подовженням вуглеводного ланцюга в
гомологічних рядах у геометричній
прогресії за правилом Дюкло-Траубе
(4.10):
відповідно до теорії Ленгмюра зростає
з подовженням вуглеводного ланцюга в
гомологічних рядах у геометричній
прогресії за правилом Дюкло-Траубе
(4.10):
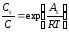 (4.10)
(4.10)
За принципом Больцмана рівноважний розподіл молекул між адсорбційним шаром і об’ємом розчину виводиться рівнянням (4.11):
AS = N ψOS + NΔ1 ψSn = N ψS (4.11)
де: As = NψS – робота адсорбції (адсорбційний потенціал), ергсм-1 , при цьому:
n – число груп – CH2 –, чи число ланок прямого вуглеводного ланцюга, що визначає положення даного ПАР в гомологічному ряду n – заміщених з однією полярною групою наприкінці ланцюга: – OH, –COO (H, Me), – SO3 (H, Me), – O – SO3 – (H, Me) – NH2 і ін.; Δ1ψs внесок однієї ланки ланцюга в ізотермічну роботу розсовування молекул води при введенні у воду однієї молекули ПАР.
Об’єднавши (4.10) і (4.11), після перетворень для концентрації С, при яких РS=σ0 - σс= const, одержують математичний вираз (4.12) для правила Дюкло-Траубе.
 , (4.12)
, (4.12)
де: β – коефіцієнт правила Дюкло-Траубе при переході від одного з гомологів, n – го, до наступного (n + 1) – го.
За значеннями поверхневих міжфазних натягів σ, а також розмірів молекул ПАР і молекул води можна приблизно розрахувати N∆1ψs = 650 кал·моль-1, тоді β = 3,3 при 20°С, що добре відповідає експериментальним даним (β=3,0-3,5). Це означає, що при подовженні вуглеводного ланцюга на 2 ланки, тобто при переході від n-гомолога до (n + 2) -го, поверхнева активність Gm зростає приблизно в 10 разів.
Можна оцінювати поверхневу активність як найбільше зниження поверхневого натягу, ділене на відповідну концентрацію (4.13):
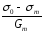 (4.13)
(4.13)
Для милоподібних ПАР – мийних речовин, визначена в такий спосіб поверхнева активність практично виражається відношенням зниження σ у критичній концентрації міцелоутворення (ККМ) (σ – σк) до концентрації в цій крапці Ск. Граничні зниження (σ – σк) для границі вода-повітря порівняно мало розрізняються в таких ПАР і складають біля σ–σк ≈ 73–28 ерг · см-2.
Значення ж ККМ розрізняються на 2-3 порядки і тому приблизно поверхнева активність милоподібних ПАР зворотно пропорційна ККМ, що свідчить про взаємозв'язок поверхневих і об'ємно-колоїдних властивостей водяних розчинів таких речовин.
Оцінка поверхневої активності за критичною концентрацєю Ск має важливе економічне значення, визначаючи мінімальну витрату ПАР, необхідну для забезпечення найбільш ефективної дії.
Для оцінки поверхневих і об’ємних властивостей ПАР, а також спроможності їх використання для тих чи інших цілей, зокрема як емульгаторів, користуються відношенням характеристик двох протилежних частин молекули ПАР (гідрофільної – полярна група, що визначає гідрофільні властивості – взаємодію з водою) і гідрофобної (ліпофільної – неполярний ланцюг, що визначає ліпофільні властивості – взаємодію з маслом), так званим гідрофільно-ліпофільним балансом (ГЛБ).
Поки що не існує строгої теорії, яка дозволяє точно визначити значення ГЛБ молекули або фізико-хімічних властивостей речовини. Як перше наближення використують запропоновану Гріффіном, Девісом і Бернсом напівемпіричну систему ГЛБ, що дозволяє з енергетичних пропозицій кількісно оцінити у вигляді умовних групових чисел ступінь взаємодії з водою окремих груп, з яких складається молекула ПАР. Числа ГЛБ визначаються за спеціальними формулами.
Так, наприклад, для ефірів жирних кислот, багатоатомних спиртів і оксіетильованих жирних кислот запропонована наступна формула (4.14):
ГЛБ
= 20
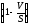 (4.14)
(4.14)
де: V – число омилення продукту; S – кислотне число жирної кислоти.
Числа ГЛБ визначають області використання ПАР. Для приготування емульсії типу “вода у маслі” значення ГЛБ повинно змінюватися в інтервалі від 3 до 8, а для емульсій, “масло у воді” від 8 до 13, для змочувачів – від 7 до 9, для мийних ПАР від 13 до 15. Значення ГЛБ характеризуються числами від 1 до 40 і визначаються за виглядом дисперсії речовини у воді. Якщо речовина не диспергується у воді і має явно виражені гідрофобні властивості, ГЛБ 1 – 4, якщо дуже добре диспергується, то ГЛБ 9-12, якщо виникає прозорий розчин, то ГЛБ >13. При цьому за основу беруть розмір гідрофобної частини молекули ПАР, що переводиться в розчин відповідно однією гідроксильною, карбоксильною, амінною, ефірною або іншою функціональною групою. Встановлено, що одна гідроксильна група ОН забезпечує розчинність у воді частини молекули з молекулярною масою 115, група СООН – 215, а аміногрупа NH2 – 215, ефірний кисень – 30. Ці числа називаються критичними числами гідратації. Вони вказують на кількість молекул води, що гідратовано однією полярною, неіоногенною або іоногенною групою.
Зокрема активність ПАР по відношенню до бітуму запропоновано визначати як відношення (4.15):
 (4.15)
(4.15)
де: АПАР – зчеплення бітуму з ПАР; АБ – зчеплення чистого бітуму; СПАР – вміст ПАР у бітумі.
Усі ПАР поділяють на два великих класи з різким, хоча і безперервним, переходом між ними.
Неповноцінні, по справжньому розчинні у воді ПАР. Полярні групи їхніх молекул (чи іонів) недостатньо гідрофільні. Недолік таких ПАР полягає насамперед у тому що, незважаючи на дуже велику поверхневу активність, вони не здатні забезпечити досить велике зниження поверхневого натягу, а тому і не мають змочувальної здатності. Вони не утворюють міцелярних структур ні в об’ємі розчину, ні в поверхневих адсорбційних шарах, не виявляючи тому солюбілізувальних і стабілізувальних властивостей, а отже, не виявляючи і мийної дії.
Повноцінні (милоподібні) ПАР з дуже сильно гідрофільними полярними групами, при розвинутих гідрофобних радикалах, тобто при досягненні в молекулі визначеного гідрофільно-олеофільного балансу, що утворюють у воді термодинамічні рівноважні колоїдні системи, і названі напівколоїдами.
Такі ультрадисперсні,
але вже двофазні системи виникають при
концентраціях, вище деякої – критичної
концентрації міцелоутворювання ККМ =
Ск. Різкість цієї границі визначається
тим, що утворювані в зворотному процесі
nм
АБ ↔ (АВ)nм
асоціати (агрегати міцел) складаються
з дуже великого числа молекул чи іонів
мила АВ (nм
змінюється від 50 до декількох сотень).
Рівноважна концентрація таких міцел
відповідно до закону хімічної рівноваги
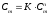 зростає надзвичайно різко при С > Ск
порівняно з дуже малими значеннями в
області С < Ск.
зростає надзвичайно різко при С > Ск
порівняно з дуже малими значеннями в
області С < Ск.
У загальному випадку ентропійні фактори (зменшення ентропії системи при росту міцел і збільшенні ступеня упорядкованості під час орієнтації молекул, особливо в шаруватих чи взагалі асиметричних міцелах) відіграють головну роль у встановленні рівноваги, тобто в обмеженні росту міцел.
Стабілізувальна дія адсорбційних шарів милоподібних ПАР завжди виявляється в підвищенні поверхневої структурної в’язкості і поверхневої міцності на границях вода-повітря і вода-масло.
