
- •Розділ 1
- •1.2. Фізико-хімічна механіка як наукова дисципліна, її задачі
- •1.3. Дисперсні системи. Класифікація дисперсних систем з позицій фізико-хімічної механіки композиційних матеріалів
- •1.3.6. Періодичні колоїдні системи.
- •1.4. Особливості властивостей колоїдних систем
- •1.5. Короткий історичний огляд
- •Розділ 2
- •2.2. Змочування і набухання
- •2.3. Спонтанні процеси на межі розділу фаз
- •Розділ 3
- •3.2. Теорія мономолекулярної адсорбції Ленгмюра
- •3.3. Полімолекулярна адсорбція
- •3.4. Рівняння Гіббса. Двомірний тиск
- •3.5. Правило Дюкло-Траубе
- •3.6. Адсорбція на межі тверде тіло – розчин
- •Розділ 4
- •4.2. Класифікація пар за хімічною будовою
- •4.3. Аніоноактивні пар
- •4.4. Катіоноактивні пар
- •4.5. Класифікація пар за механізмом дії
- •4.6. Термодинамічні, поверхневі й об'ємні властивості розчинів пар у зв'язку зі стійкістю дисперсних систем
- •4.7. Використання пар в техніці
- •Розділ 5
- •5.1.1. Будова подвійного електричного шару (пдеш)
- •5.2. Стійкість і коагуляція дисперсних систем
- •5.3. Седиментаційна (кінетична) стійкість
- •5.4. Процеси стабілізації дисперсних систем і їхня роль у техніці
- •Розділ 6
- •6.2. Загальні відомості про структуроутворення в дисперсних системах
- •Розділ 7
- •7.2. Методи реологічного моделювання
- •7.3. Криві течії і в'язкості
- •7.4. Методика побудови реологічних кривих
- •7.5. Моделі і рівняння течії структурованих дисперсних систем
- •7.6. Про реологічні криві течії і в'язкості структурованих рідин на прикладі цементобетонних сумішей
- •Іі частина
- •8.2. Розчинення в'яжучих речовин
- •8.3. Основні закономірності кінетики кристалізації нової фази з пересичених розчинів і фазовий склад цементного каменю
- •8.4. Формування структури цементного каменю
- •Розділ 9
- •9.2. Основні параметри вібраційного ущільнення бетонної суміші
- •9.3. Вібродиспергування та виброперемішування суміші
- •9.4. Основи технології виробництва дорожніх бетонів на основі органічних в'яжучих
- •9.4.2. Принцип та метод визначення температури перемішування сумішей
- •9.4.3. Температурні параметри приготування сумішей
- •9.4.4. Змочування кам'яних матеріалів в'яжучим як фактор якості перемішування
- •9.4.5. Зміст процесу ущільнення асфальтобетону.
- •9.4.6. Шляхи інтенсифікації ущільнення сумішей
- •Розділ 10
- •10.1. Склад, структура і властивості кам'яновугільних дорожніх дьогтів
- •10.2 Склад, структура і властивості нафтових дорожніх бітумів
- •10.3. Бітумні емульсії
- •10.3.2. Бітумні емульсії – мікрогеторогенні дисперсні системи
- •10.3.3. Технологія виробництва
- •Технічна характеристика диспергатора дб – 1
- •Технічна характеристика триступеневого диспергатора
- •10.3.4. Фізико-механічні властивості та технологічні вимоги.
- •10.3.5. Галузі застосування.
- •Бітумополімерні в’яжучі і асфальтобетони на їх основі
- •Розділ 11
- •11.2. Дьогтебетон
- •11.3. Асфальтобетон
- •11.3.1. Утомленісна довговічність асфальтобетонів і роль агресивних середовищ
- •11.4. Дьогтебетони і асфальтобетони з комплексно-модифікованою мікроструктурою
- •Рекомендована література до вивчення теоретичного матеріалу
4.7. Використання пар в техніці
На даний час ПАР широко використовують у багатьох галузях господарства. Наприклад, у текстильній і паперовій промисловості, у виробництві косметики, фармацевтичних, бактерицидних, фунгіцидних і засобів, які дезінфікують, у побутовій хімії, при виробленні шкіри, флотації, у сільському господарстві, будівництві, при фотографуванні, у друкарській справі і гравіюванні та ін. Поверхнево-активними речовинами є малярські і друкарські фарби, лаки і пігменти, нафта, кам'яновугільні дьогті і мастильні матеріали.
Яскравим прикладом ефективної дії ПАР є мийні засоби. Як відомо, тверді чи рідкі забруднення видаляються з поверхні волокон тканин чистою водою на превелику силу при підвищеній температурі та інтенсивному механічному впливу. Однак процес цей йде порівняно легко, якщо для прання застосовують розчин ПАР. Мийна дія ПАР зв'язана з наступними ефектами.
За присутністю у воді ПАР знижується поверхневий натяг розчину, тим самим поліпшується змочування тканини мийною рідиною. Це сприяє проникненню рідини в тонкі капіляри забрудненої тканини, у які чиста вода проникнути не може.
Молекули мила, які адсорбуються на поверхні волокна і частках твердих чи рідких забруднень, створюють добре гідратований шар, що обумовлює виникнення тиску, який розклинює. Це сприяє відриву часток забруднень від поверхні волокна і переходу їх у мийну рідину.
Адсорбційні плівки на поверхні часток забруднень додають цим часткам високу агрегативну стійкість і протидіють їх прилипанню до поверхні волокна в іншому місці.
З присутністю ПАР в миючій рідині утворюється піна, що сприяє механічному винесенню тих забруднень, частки яких унаслідок зниженої здатності до змочування прилипають до бульбашок повітря.
Нарешті, мийна дія ПАР певною мірою зв'язана зі здатністю часток забруднень, особливо якщо вони мають маслянистий характер, солюбілізуватися в їх розчинах. Це підтверджується тим, що мийна дія часто виявляється лише при концентраціях, що перевищують ККМ.
Розділ 5
СТІЙКІСТЬ ДИСПЕРСНИХ СИСТЕМ
5.1. Будова колоїдних міцел
5.2. Стійкість і коагуляція дисперсних систем
5.3. Седиментаційна (кінетична) стійкість
5.4. Процеси стабілізації дисперсних систем і їхня роль у техніці
5.1. Будова колоїдних міцел
Частки дисперсної фази ліозолів несуть на своїй поверхні заряд, що обумовлений наявністю на їх поверхні подвійного електричного шару, який представляє собою тонкий поверхневий шар із просторово розділених електричних зарядів протилежного знака. У дисперсних системах подвійний електричний шар утворюють іони і дипольні молекули. Іонний подвійний електричний шар виникає або в результаті дисоціації іоногенних груп речовини твердої фази, або унаслідок виборчої адсорбції іонів із дисперсійного середовища, що добудовують кристалічну решітку твердої фази. У результаті на границі між твердою фазою і розчином виникає подоба конденсатора, внутрішня обкладка якого утворена потенціалвизначальними іонами. А зовнішня протиіонами.
На рис. 5.1. у загальному вигляді зображений подвійний електричний шар, що виникає на кристалах йодиду срібла, що знаходиться в слабкому розчині йодиду калію. Йодидіони (потенціалвизначальні іони) добудовують кристалічну решітку йодиду срібла і тим самим додають часткам негативний заряд, а іони калію (протиіони) знаходяться в розчині поблизу міжфазної поверхні. У цілому, однак, весь комплекс, названий міцелою, залишається електронейтральним.
Виникнення
подвійного електричного шару за рахунок
іонізації можна проілюструвати утворенням
подвійного електричного шару на частках
водяного золю двоокису кремнію. Молекули
 ,
що знаходяться на поверхні таких часток,
взаємодіють з дисперсійним середовищем,
гідратуються та утворюють кремінну
кислоту, здатну іонізуватися:
,
що знаходяться на поверхні таких часток,
взаємодіють з дисперсійним середовищем,
гідратуються та утворюють кремінну
кислоту, здатну іонізуватися:
H2SiО3
↔
 + 2H+ (5.1)
+ 2H+ (5.1)
При цьому силікатні
іони
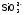 залишаються на поверхні частки,
обумовлюючи її негативний заряд, а іони
водню переходять у розчин. Схематично
це показано на рис. 5.2.
залишаються на поверхні частки,
обумовлюючи її негативний заряд, а іони
водню переходять у розчин. Схематично
це показано на рис. 5.2.
|
|
|
|
Рис.5.1. Схема утворення подвійного електричного шару навколо частки йодиду срібла, що знаходиться в розчині йодиду калію |
Рис.5.2. Схема утворення подвійного електричного шару навколо частки двоокису кремнію, що знаходиться у воді |
Будову міцели золю йодиду срібла у слабкому розчині йодиду калію представляють схемою, що наведена на рис. 5.3 (побудована за правилом Панета-Фаянса). Усередині міцели знаходиться кристал, що складається з молекул AgІ. Ця частина міцели – агрегат, тому що вона завжди складається з агрегату атомів, молекул чи іонів, що утворюють частки дисперсної фази.
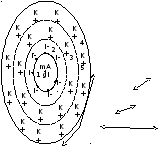
Рис. 5.3. Схема будови колоїдної міцели золю йодиду срібла у слабкому розчині йодиду калію: 1 – агрегат; 2 – ядро; 3 – адсорбційна частина подвійного електричного шару; 4 – дифузійна частина подвійного електричного шару; 5 – подвійний електричний шар міцели
На поверхні кристала знаходяться його іони, що добудовують його і додають йому електричний заряд. Агрегат разом з адсорбованими на ньому потенціалвизначальними іонами складає ядро міцели. У безпосередній близькості від ядра в адсорбційному шарі знаходиться частина протиіонів К+, що міцно зв'язані з ядром електричними та адсорбційними силами (адсорбційна частина подвійного електричного шару). Ядро разом з частиною міцно зв'язаних з ним протиіонів складають колоїдну частку. На відміну від міцели, у цілому електронейтральної, колоїдна частка завжди має заряд (у розглянутому випадку негативний).
Протиіони, що знаходяться ближче до периферійної частини міцели, утворюють дифузійний шар міцели. Границя між дифузійним шаром і шаром власне колоїдної частки, по якій міцела “розривається” при електрофорезі, називається площиною границі ковзання.
Будову міцели
можна представити формулою. Наприклад,
для золю AgІ, міжміцелярною рідиною якого
є слабкий розчин KI, можна написати
наступну формулу міцели (5.2). У цій формулі
m [AgІ] відповідає числу молекул AgІ, що
містяться в агрегаті міцели,
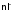 –
числу потенціалвизначальних іонів,(n–x)
K+–
числу протиіонів у безпосередній
близькості від ядра і хK+–
число протиіонів, що знаходяться в
дифузійному шарі. Як правило, m ›› n.
Таким чином формула міцели в даному
випадку має вигляд (5.2):
–
числу потенціалвизначальних іонів,(n–x)
K+–
числу протиіонів у безпосередній
близькості від ядра і хK+–
число протиіонів, що знаходяться в
дифузійному шарі. Як правило, m ›› n.
Таким чином формула міцели в даному
випадку має вигляд (5.2):
(5.2)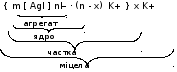
Вище розглянуто будову міцели, у якої іоногенна частина утворюється у результаті адсорбції стабілізувального електроліту, що відрізняється за своєю хімічною природою від речовини дисперсної фази. У інших випадках неіоногенна частина міцели може утворитися із речовини самого агрегату. Прикладом такої колоїдної системи може служити достатнього застарілий гідрозоль двоокису кремнію (рис. 5.2). Поверхня агрегату, реагує з навколишньою водою, утворює метакремінну кислоту Н2SiO3, яка і буде стабілізатором. Будову міцели такого золю, звичайно, слід, зображувати формулою (5.3):
{m [SiO2] nSiO-23 · 2 (n-x) H+} 2xH+ (5.3)
Чисельний коефіцієнт 2 перед (n-x) і х у цій формулі показує двохосновність метакремінної кислоти.


