- •Розділ 1
- •1.2. Фізико-хімічна механіка як наукова дисципліна, її задачі
- •1.3. Дисперсні системи. Класифікація дисперсних систем з позицій фізико-хімічної механіки композиційних матеріалів
- •1.3.6. Періодичні колоїдні системи.
- •1.4. Особливості властивостей колоїдних систем
- •1.5. Короткий історичний огляд
- •Розділ 2
- •2.2. Змочування і набухання
- •2.3. Спонтанні процеси на межі розділу фаз
- •Розділ 3
- •3.2. Теорія мономолекулярної адсорбції Ленгмюра
- •3.3. Полімолекулярна адсорбція
- •3.4. Рівняння Гіббса. Двомірний тиск
- •3.5. Правило Дюкло-Траубе
- •3.6. Адсорбція на межі тверде тіло – розчин
- •Розділ 4
- •4.2. Класифікація пар за хімічною будовою
- •4.3. Аніоноактивні пар
- •4.4. Катіоноактивні пар
- •4.5. Класифікація пар за механізмом дії
- •4.6. Термодинамічні, поверхневі й об'ємні властивості розчинів пар у зв'язку зі стійкістю дисперсних систем
- •4.7. Використання пар в техніці
- •Розділ 5
- •5.1.1. Будова подвійного електричного шару (пдеш)
- •5.2. Стійкість і коагуляція дисперсних систем
- •5.3. Седиментаційна (кінетична) стійкість
- •5.4. Процеси стабілізації дисперсних систем і їхня роль у техніці
- •Розділ 6
- •6.2. Загальні відомості про структуроутворення в дисперсних системах
- •Розділ 7
- •7.2. Методи реологічного моделювання
- •7.3. Криві течії і в'язкості
- •7.4. Методика побудови реологічних кривих
- •7.5. Моделі і рівняння течії структурованих дисперсних систем
- •7.6. Про реологічні криві течії і в'язкості структурованих рідин на прикладі цементобетонних сумішей
- •Іі частина
- •8.2. Розчинення в'яжучих речовин
- •8.3. Основні закономірності кінетики кристалізації нової фази з пересичених розчинів і фазовий склад цементного каменю
- •8.4. Формування структури цементного каменю
- •Розділ 9
- •9.2. Основні параметри вібраційного ущільнення бетонної суміші
- •9.3. Вібродиспергування та виброперемішування суміші
- •9.4. Основи технології виробництва дорожніх бетонів на основі органічних в'яжучих
- •9.4.2. Принцип та метод визначення температури перемішування сумішей
- •9.4.3. Температурні параметри приготування сумішей
- •9.4.4. Змочування кам'яних матеріалів в'яжучим як фактор якості перемішування
- •9.4.5. Зміст процесу ущільнення асфальтобетону.
- •9.4.6. Шляхи інтенсифікації ущільнення сумішей
- •Розділ 10
- •10.1. Склад, структура і властивості кам'яновугільних дорожніх дьогтів
- •10.2 Склад, структура і властивості нафтових дорожніх бітумів
- •10.3. Бітумні емульсії
- •10.3.2. Бітумні емульсії – мікрогеторогенні дисперсні системи
- •10.3.3. Технологія виробництва
- •Технічна характеристика диспергатора дб – 1
- •Технічна характеристика триступеневого диспергатора
- •10.3.4. Фізико-механічні властивості та технологічні вимоги.
- •10.3.5. Галузі застосування.
- •Бітумополімерні в’яжучі і асфальтобетони на їх основі
- •Розділ 11
- •11.2. Дьогтебетон
- •11.3. Асфальтобетон
- •11.3.1. Утомленісна довговічність асфальтобетонів і роль агресивних середовищ
- •11.4. Дьогтебетони і асфальтобетони з комплексно-модифікованою мікроструктурою
- •Рекомендована література до вивчення теоретичного матеріалу
10.3.2. Бітумні емульсії – мікрогеторогенні дисперсні системи
Дослідники розглядають емульсію як дисперсну мікрогетерогенну стабілізовану систему рідина – рідина. У емульсії виділяють дві фази: дисперговану (переривну) і диспергуючу (або непереривну). На поверхні розділу фаз у прямих емульсіях між краплями бітуму і дисперсійного середовища (вода) знаходиться стабілізувальна речовина (емульгатор).
П.О. Ребіндером показано, що агрегативно стійкі емульсії можуть бути отримані двома способами: утворюванням на поверхні крапель диспергованого бітуму із боку дисперсійного середовища стабілізувального адсорбційного шару, який структурно-механічно перешкоджає агрегуванню і коалісценції крапель бітуму; зниженням поверхневого натягу на межі розділу фаз “бітум-вода” майже до нуля.
В розріджених емульсіях можливість коалесценції виражена слабо через малу ймовірність зіткнення крапельок бітуму і малої ефективності цих зіткнень. В концентрованих емульсіях агрегування крапель бітуму і коалесценція з проривом плівок дисперсійного середовища йде дуже інтенсивно. Емульгатори утворюють на поверхні крапель бітуму адсорбційні шари гелеподібної структури, що включають сольватну оболонку, яка має визначену міцність на зсув і високу в’язкість. Наявність цих шарів ( структурно-механічний фактор стабілізації) практично усуває можливість агрегування і коалесценції крапель бітуму в концентрованих бітумних емульсіях.
В загальному випадку іоногенні ПАР орієнтуються на межі розділу “бітум-вода” таким чином, що неполярною частиною вони звернуті до бітуму, а полярною – до води. У результаті виникає подвійний електричний шар, який урівнює різницю полярності фази і середовища, знижуючи поверхневий натяг на межі їх розділу. За рахунок дисоціації полярної групи ПАР частка фази (крапля бітуму) здобуває електричний заряд (при аніоноактивному емульгаторі – негативний, при катіоноактивному - позитивний) (рис.10.24).
Звичайно, стабілізувальна дія ПАР досягає максимуму поблизу насичення, а потім різко падає при переході до повністю насичених шарів. Це пояснюється тим, що для стабілізації, поряд з високою структурною в’язкістю або міцністю плівки, що уповільнює зменшення прошарку, який заповнений дисперсійним середовищем, між краплями або частками, що зближуються необхідно, щоб випадковий розрив адсорбційного шару зміг швидко затягуватися, завдяки його легкорухливості. В протилежному випадку утворюються розриви, що приводять до зниження стабільності емульсії.
Роль молекулярно-сольватаційного фактору особливо ефективна при наявності на поверхні бітумних крапель достатньої кількості функціональних гідрофільних груп. Висока гідрофільність емульгатора приводить до залучання в міцелярну структуру адсорбційних шарів молекул води, що сприяє зміцненню системи і уповільненню процесів розпаду емульсії.
При наявності у вуглеводному ланцюгу катіоноактивного ПАР не менш 6-8 молекул вуглеводню і при концентраціях, що перевищують критичну концентрацію міцелоутворення (ККМ), виникають міцели ПАР, що дозволяють використати поверхнево-активні речовини для емульгування бітуму. Емульгаторами ж аніонних емульсій можуть служити солі кислот, які утримують число атомів вуглеводню в інтервалі від С12 до С18 , у яких полярна і неполярна групи збалансовані. Поверхневий натяг емульгаторів, які придатні для виробництва бітумних емульсій, повинен знаходитися в межах (27-41) · 10-11 Дж/м2.
Відомо (розділ 4), що як аніоноактивні емульгатори використовують ПАР, які утримують в молекулах гідрофільні функціональні групи –СОО - , - SO3 - , - OSO3 – і ін., і у водному середовищі дисоціюють за схемою (10.8)
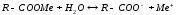 (10.8)
(10.8)
де: R – вуглеводневий радикал з 12-18 атомами вуглецю; Ме – катіон металу, Na+ або K+.
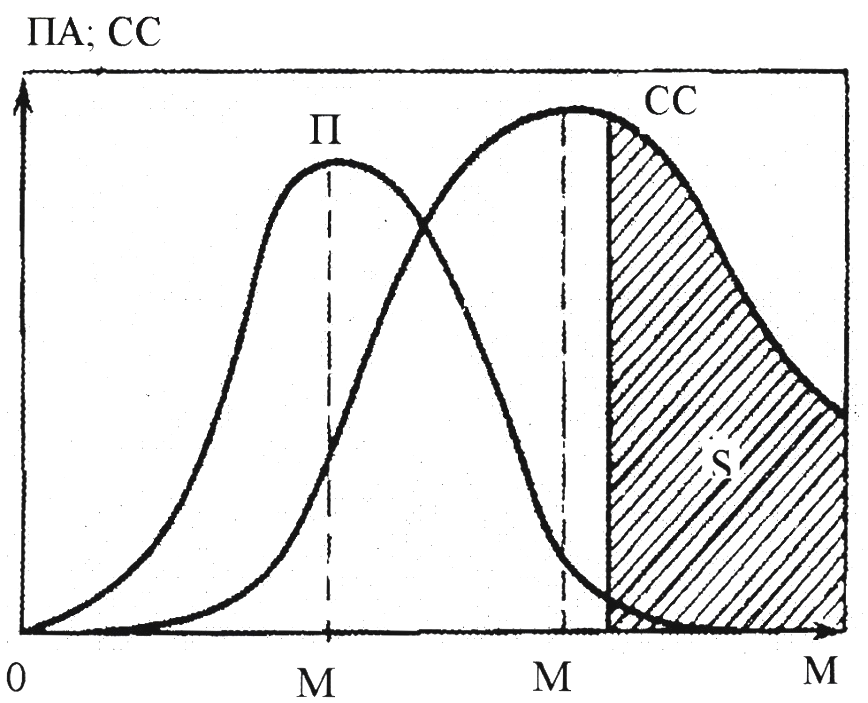
Дія емульгатора ефективніша тоді, коли краще збалансовані полярні і неполярні частини його молекул на межі розподілу фаз. Схема на рис. 10.25 показує залежність ефективності емульгатора, а також його поверхневої активності від ступеня складності або маси його первинної (кінетичної) частинки. Ця схема показує, що найбільш активні поверхнево-активні речовини є ще слабкими емульгаторами через недостатню їх спроможність до колоїдоутворення. При подальшому збільшенні молекулярної маси ПАР йде зменшення асиметрії молекули, і, внаслідок цього, поверхнева активність ПАР знижується, а емульгувальна спроможність зростає.
|
|
Рис.10.25. Схема співвідношень поверхневої активності емульгатору (ПА) і їх стабілізуючої спроможності (СС) (ці величини представлені в залежності від розмірів молекул (або міцел) емульгатора в розчині для емульгаторів, що споріднені за хімічною природою, або від довжини ланцюга ПАР у гомологічному ряду (М – по осі абсцис). S – область твердих (бронювальних, поверхнево-активних емульгаторів)
Ефективність емульгаторів, як це показано в розділі 4, характеризують гідрофільно-ліпофільним балансом ПАР, який для прямих емульсій повинен дорівнювати ГЛБ=8-13.
Таким чином, обираючи ПАР для емульсії, необхідно знати, чи забезпечить вона необхідну стійкість і стабільність дисперсної фази, і ураховувати спосіб емульгування, а також фізико-хімічні властивості емульсії і область її застосування.
Так, у кислому середовищі емульгувальну здатність проявляють катіоноактивні ПАР, а у лужному – аніоноактивні. Оптимальна кислотність або лужність емульгувального середовища звичайно знаходиться у визначених межах. Аніонні емульсії мають найвищу стабільність при рН = 10 – 13, а катіонні при рН = 2 – 4. Якщо у воді присутня значна кількість солей, то найбільш стійкі емульсії утворюються на неіоногенних емульгаторах, що у меншій мірі реагують на рН середовища.