
- •Розділ 1
- •1.2. Фізико-хімічна механіка як наукова дисципліна, її задачі
- •1.3. Дисперсні системи. Класифікація дисперсних систем з позицій фізико-хімічної механіки композиційних матеріалів
- •1.3.6. Періодичні колоїдні системи.
- •1.4. Особливості властивостей колоїдних систем
- •1.5. Короткий історичний огляд
- •Розділ 2
- •2.2. Змочування і набухання
- •2.3. Спонтанні процеси на межі розділу фаз
- •Розділ 3
- •3.2. Теорія мономолекулярної адсорбції Ленгмюра
- •3.3. Полімолекулярна адсорбція
- •3.4. Рівняння Гіббса. Двомірний тиск
- •3.5. Правило Дюкло-Траубе
- •3.6. Адсорбція на межі тверде тіло – розчин
- •Розділ 4
- •4.2. Класифікація пар за хімічною будовою
- •4.3. Аніоноактивні пар
- •4.4. Катіоноактивні пар
- •4.5. Класифікація пар за механізмом дії
- •4.6. Термодинамічні, поверхневі й об'ємні властивості розчинів пар у зв'язку зі стійкістю дисперсних систем
- •4.7. Використання пар в техніці
- •Розділ 5
- •5.1.1. Будова подвійного електричного шару (пдеш)
- •5.2. Стійкість і коагуляція дисперсних систем
- •5.3. Седиментаційна (кінетична) стійкість
- •5.4. Процеси стабілізації дисперсних систем і їхня роль у техніці
- •Розділ 6
- •6.2. Загальні відомості про структуроутворення в дисперсних системах
- •Розділ 7
- •7.2. Методи реологічного моделювання
- •7.3. Криві течії і в'язкості
- •7.4. Методика побудови реологічних кривих
- •7.5. Моделі і рівняння течії структурованих дисперсних систем
- •7.6. Про реологічні криві течії і в'язкості структурованих рідин на прикладі цементобетонних сумішей
- •Іі частина
- •8.2. Розчинення в'яжучих речовин
- •8.3. Основні закономірності кінетики кристалізації нової фази з пересичених розчинів і фазовий склад цементного каменю
- •8.4. Формування структури цементного каменю
- •Розділ 9
- •9.2. Основні параметри вібраційного ущільнення бетонної суміші
- •9.3. Вібродиспергування та виброперемішування суміші
- •9.4. Основи технології виробництва дорожніх бетонів на основі органічних в'яжучих
- •9.4.2. Принцип та метод визначення температури перемішування сумішей
- •9.4.3. Температурні параметри приготування сумішей
- •9.4.4. Змочування кам'яних матеріалів в'яжучим як фактор якості перемішування
- •9.4.5. Зміст процесу ущільнення асфальтобетону.
- •9.4.6. Шляхи інтенсифікації ущільнення сумішей
- •Розділ 10
- •10.1. Склад, структура і властивості кам'яновугільних дорожніх дьогтів
- •10.2 Склад, структура і властивості нафтових дорожніх бітумів
- •10.3. Бітумні емульсії
- •10.3.2. Бітумні емульсії – мікрогеторогенні дисперсні системи
- •10.3.3. Технологія виробництва
- •Технічна характеристика диспергатора дб – 1
- •Технічна характеристика триступеневого диспергатора
- •10.3.4. Фізико-механічні властивості та технологічні вимоги.
- •10.3.5. Галузі застосування.
- •Бітумополімерні в’яжучі і асфальтобетони на їх основі
- •Розділ 11
- •11.2. Дьогтебетон
- •11.3. Асфальтобетон
- •11.3.1. Утомленісна довговічність асфальтобетонів і роль агресивних середовищ
- •11.4. Дьогтебетони і асфальтобетони з комплексно-модифікованою мікроструктурою
- •Рекомендована література до вивчення теоретичного матеріалу
3.4. Рівняння Гіббса. Двомірний тиск
Величина адсорбції Г (моль∙см-2) визначається як надлишок маси даного (адсорбованого) компонента, що припадає на одиницю площі поверхневого шару:
 (3.9)
(3.9)
де: М − маса даного компонента в системі; m1 і m2 – маси компонента в об’ємі кожної з фаз.
Зв'язок між адсорбцією Г і зниженням поверхневого натягу, тобто двомірним тиском рs.
ps=σ0 – σг (3.10)
(σ0 – поверхневий натяг чистої рідини, σГ – теж для розчину), описується рівнянням Гіббса
Г = f (ps) (3.11)
У похідних це виражається наступними рівняннями
–
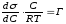 і –
і –
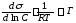 (3.12)
(3.12)
або відповідно
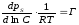 (3.13)
(3.13)
Величина –
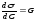 – є мірою поверхневої активності
речовини. Коли
– є мірою поверхневої активності
речовини. Коли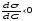 ;
;
G › 0 і Г › 0 речовина поверхнево–активна і позитивно адсорбується на даній міжфазній поверхні розділу фаз.
Коли
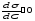 ;
G ‹ 0 і Г ‹ 0 – речовина поверхнево –
інактивна і підвищує поверхневий натяг.
Поверхнева активність –
;
G ‹ 0 і Г ‹ 0 – речовина поверхнево –
інактивна і підвищує поверхневий натяг.
Поверхнева активність –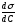 може
бути велика за абсолютною величиною
лише тоді, коли вона позитивна (рис.
3.8).
може
бути велика за абсолютною величиною
лише тоді, коли вона позитивна (рис.
3.8).

|
Рис.3.8. Ізотерми зміни поверхневого натягу залежно від концентрації розчину: 1 – для ПАР; 2 – для поверхнево - інактивної речовини; 3 – для речовини, що не впливає на поверхневу активність |
3.5. Правило Дюкло-Траубе
Адсорбція та орієнтація молекул поверхнево-активних речовин на поверхні розділу фаз – це самовільні процеси, що приводять до мінімуму вільної енергії системи. Знаходячись в об’ємі більш полярної фази, наприклад води, мізерно мало гідратований вуглеводний ланцюг розсовує молекули води, виконуючи при цьому роботу, пропорційну довжині ланцюга і спрямовану проти сил молекулярного зчеплення.
Тому процес переходу таких молекул у поверхневий шар при зануренні полярних груп у воду, а вуглеводних ланцюгів у неполярну фазу, супроводжується недостачею вільної енергії (3.14):
– ΔF =
φ n
>
0 (3.14)
n
>
0 (3.14)
Тут φ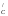 – робота розсовування молекул води
при впровадженні у водяне середовище
СН2
– ланки, а n
– число ланок вуглеводного ланцюга.
Величину φ
– робота розсовування молекул води
при впровадженні у водяне середовище
СН2
– ланки, а n
– число ланок вуглеводного ланцюга.
Величину φ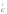 можна знайти з рівняння (3.15):
можна знайти з рівняння (3.15):
φ = φ
= φ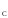 – φ
– φ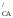 (3.15)
(3.15)
де:
φ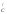 – є власно роботою розсовування однієї
СН2–
ланки;
– є власно роботою розсовування однієї
СН2–
ланки;
φ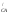 – половина поправки на гідратацію
вуглеводної ланки і дорівнює менше 5%
величини φ
– половина поправки на гідратацію
вуглеводної ланки і дорівнює менше 5%
величини φ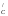 ;
;
φС – робота розсовування молекул води на одну ланку СН2 без поправки на гідратацію.
Встановлено, що для переведення кожної СН2 – групи з поверхневого шару в об’ємну фазу треба затратити ≈ 3 кДж/моль. Це робота розсування диполів води (на величину об’єму СН2 – групи). Отже адсорбція ПАР в гомологічному ряду зростає в 3-3,5 рази при збільшенні його ланцюга на СН2 – групу.
Тобто довжина вуглеводневого радикалу сильно впливає на поверхневу активність молекули. Правило Дюкло-Траубе (для розчинів насичених жирних кислот): поверхнева активність речовин на межі розчин-повітря тим вище, чим більше довжина вуглеводневого радикалу; в середньому поверхнева активність зростає в 3,2 рази на кожну групу СН2. Правило Дюкло-Траубе виконується при температурах, близьких до кімнатної, при підвищенні температури відношення 3,2 знижується, наближаючись до одиниці.
