- •Розділ 1
- •1.2. Фізико-хімічна механіка як наукова дисципліна, її задачі
- •1.3. Дисперсні системи. Класифікація дисперсних систем з позицій фізико-хімічної механіки композиційних матеріалів
- •1.3.6. Періодичні колоїдні системи.
- •1.4. Особливості властивостей колоїдних систем
- •1.5. Короткий історичний огляд
- •Розділ 2
- •2.2. Змочування і набухання
- •2.3. Спонтанні процеси на межі розділу фаз
- •Розділ 3
- •3.2. Теорія мономолекулярної адсорбції Ленгмюра
- •3.3. Полімолекулярна адсорбція
- •3.4. Рівняння Гіббса. Двомірний тиск
- •3.5. Правило Дюкло-Траубе
- •3.6. Адсорбція на межі тверде тіло – розчин
- •Розділ 4
- •4.2. Класифікація пар за хімічною будовою
- •4.3. Аніоноактивні пар
- •4.4. Катіоноактивні пар
- •4.5. Класифікація пар за механізмом дії
- •4.6. Термодинамічні, поверхневі й об'ємні властивості розчинів пар у зв'язку зі стійкістю дисперсних систем
- •4.7. Використання пар в техніці
- •Розділ 5
- •5.1.1. Будова подвійного електричного шару (пдеш)
- •5.2. Стійкість і коагуляція дисперсних систем
- •5.3. Седиментаційна (кінетична) стійкість
- •5.4. Процеси стабілізації дисперсних систем і їхня роль у техніці
- •Розділ 6
- •6.2. Загальні відомості про структуроутворення в дисперсних системах
- •Розділ 7
- •7.2. Методи реологічного моделювання
- •7.3. Криві течії і в'язкості
- •7.4. Методика побудови реологічних кривих
- •7.5. Моделі і рівняння течії структурованих дисперсних систем
- •7.6. Про реологічні криві течії і в'язкості структурованих рідин на прикладі цементобетонних сумішей
- •Іі частина
- •8.2. Розчинення в'яжучих речовин
- •8.3. Основні закономірності кінетики кристалізації нової фази з пересичених розчинів і фазовий склад цементного каменю
- •8.4. Формування структури цементного каменю
- •Розділ 9
- •9.2. Основні параметри вібраційного ущільнення бетонної суміші
- •9.3. Вібродиспергування та виброперемішування суміші
- •9.4. Основи технології виробництва дорожніх бетонів на основі органічних в'яжучих
- •9.4.2. Принцип та метод визначення температури перемішування сумішей
- •9.4.3. Температурні параметри приготування сумішей
- •9.4.4. Змочування кам'яних матеріалів в'яжучим як фактор якості перемішування
- •9.4.5. Зміст процесу ущільнення асфальтобетону.
- •9.4.6. Шляхи інтенсифікації ущільнення сумішей
- •Розділ 10
- •10.1. Склад, структура і властивості кам'яновугільних дорожніх дьогтів
- •10.2 Склад, структура і властивості нафтових дорожніх бітумів
- •10.3. Бітумні емульсії
- •10.3.2. Бітумні емульсії – мікрогеторогенні дисперсні системи
- •10.3.3. Технологія виробництва
- •Технічна характеристика диспергатора дб – 1
- •Технічна характеристика триступеневого диспергатора
- •10.3.4. Фізико-механічні властивості та технологічні вимоги.
- •10.3.5. Галузі застосування.
- •Бітумополімерні в’яжучі і асфальтобетони на їх основі
- •Розділ 11
- •11.2. Дьогтебетон
- •11.3. Асфальтобетон
- •11.3.1. Утомленісна довговічність асфальтобетонів і роль агресивних середовищ
- •11.4. Дьогтебетони і асфальтобетони з комплексно-модифікованою мікроструктурою
- •Рекомендована література до вивчення теоретичного матеріалу
Розділ 4
ПОВЕРХНЕВО-АКТИВНІ РЕЧОВИНИ
4.1. Склад і фізико-хімічна природа ПАР
4.2. Класифікація ПАР за хімічною будовою
4.3. Аніоноактивні ПАР
4.4. Катіоноактивні ПАР
4.5. Класифікація ПАР за механізмом дії
4.6. Термодинамічні, поверхневі та об'ємні властивості розчинів ПАР в зв'язку зі стійкістю дисперсних систем
4.7. Використання ПАР в техніці
4.1. Склад і фізико-хімічна природа ПАР
Речовини, що при розчиненні навіть у дуже малих концентраціях здатні різко знижувати поверхневий натяг розчинника, називають поверхнево-активними речовинами (ПАР), а їх властивість знижувати поверхневий натяг – поверхневою активністю.
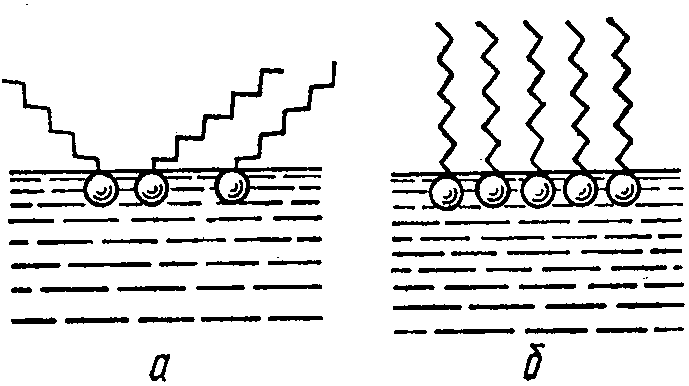
Утворення найтоншого насиченого адсорбційного шару ПАР товщиною в одну молекулу (мономолекулярного шару) може викликати різкі зміни інтенсивності молекулярної взаємодії дотичних тіл і швидкості обміну речовин між цими тілами (рис. 4.1).
|
|
Рис. 4.1. Адсорбційний шар: а – ненасичений; б – насичений
|
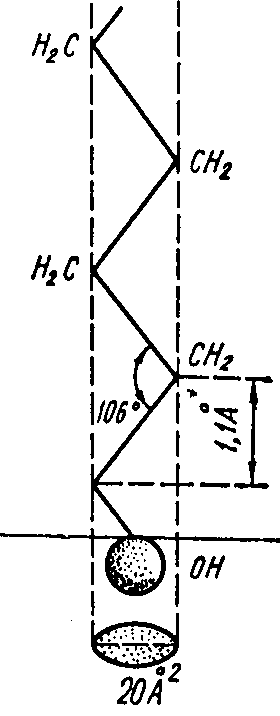
ПАР – органічні сполуки, у молекули яких входять одночасно полярна група (наприклад ОН, СООН, NН2) і неполярний вуглеводний ланцюг (рис. 4.2).
Найбільш часто зустрічаються у складі ПАР наступні функціональні групи: (–ОН) – гідроксильна;

(–NO2) – нітрогрупа; (–SO3H) – сульфогрупа
 Рис.4.2.
Схема молекули поверхнево-активної
речовини
Рис.4.2.
Схема молекули поверхнево-активної
речовини
Символ зображення ПАР
кружок позначає полярну групу; риска – неполярний радикал.
Функціональними
групами також є карбонільна група
,
альдегідна
група
, група
(–SH),
нітрозогрупа
(–N
= 0),
гідрозогрупа
і ін.



Усі галогени (–Сl, –Вr, –F, –I), кисень (–О–), азот , сірка (–S–), а також метали (–Ме) можуть виконувати роль функціональних груп у складі ПАР. Від того, яка із функціональних груп приєднана до вуглеводного радикала, залежать хімічні, фізичні і інші властивості ПАР.
Якщо до аліфатичного радикала С10Н2n+1 приєднати (–ОН) – групу утворюється спирт СnH2n+1OH, якщо ж приєднати карбоксильну групу, утворюється карбонова кислота СnH2n+1СОOH. Приєднання аміногрупи дає аліфатичний амін СnH2n+1NH2 і т. ін.
За кількістю функціональних груп у молекулі ПАР можуть бути одно-, дво- і багатоосновні: RCOOH – одноосновна карбонова кислота; НООСRCOOH – двоосновна карбонова кислота; NH2RNH2 – двоосновний амін.
При зміні в молекулі ПАР функціональних груп змінюється клас сполуки.
Наприклад, якщо в молекулу карбонової кислоти вводиться –ОН, =СО або – NH2 група, то утворюються відповідно окси-, кето- і амінокислоти.
Поверхнево-активні властивості утворюваних таким чином сполук залежать від властивостей і хімічної структури радикалів і функціональних груп. Радикалами можуть служити не тільки насичені аліфатичні вуглеводні сполуки з відкритим ланцюгом атомів типу СnНn , СnН2n - 2 , СnН2n - 4 і ін., а також циклічні сполуки з зімкнутим (кільцевим) ланцюгом атомів.
Відомі ПАР, до складу яких входять аліфатичні і циклічні радикали і декілька функціональних груп. Часто зустрічаються ПАР, що називаються аліфатичними (аліфатичний радикал) або алкіл ароматичними (радикал складається з бензольного циклу з побічним аліфатичним ланцюгом), наприклад:
С17Н35–СООН – жирна (стеаринова) кислота з аліфатичним радикалом С17Н35 (функціональна група СООН);
С18Н37–NH2 – жирний амін (октадециламін) з аліфатичним радикалом С18Н37 (функціональна група NH2);
– натрова сіль алкілбензосульфокислоти, де n = 11 - 12. Радикал складається з бензольного циклу з аліфатичним вуглеводним ланцюгом СnН2n+1 (функціональна група SO
СnН2n + 1ОSO3H – сульфоефір жирних спиртів з аліфатичним радикалом СnН2n + 1 , де n в основному дорівнює 12-16 (функціональна група SO3H); );
);

4)
– алкілбензолпиридінійхлорид,
де R =
С6–С8.
Радикал складається з аліфатичного
вуглеводного ланцюга, ароматичного
радикала і гетероциклів. Роль
функціональної групи виконує азот у
гетероциклі.
5)
Сполуки, у яких аліфатичний радикал утримує менше 10 атомів вуглеводню, як правило, не мають поверхневої активності (спроможності адсорбуватися і знижувати поверхневий натяг рідин або поверхневу енергію твердих тіл). При утриманні у радикалі більше 10 атомів вуглеводню вони, звичайно, поверхнево-активні і називаються вищими жирними поверхнево-активними речовинами (вищі жирні кислоти, вищі жирні спирти, вищі жирні аміни і ін.).
Слід відмітити, що активність ПАР підвищується при подовженні аліфатичного ланцюга:

 а
також при заміні водню функціональної
групи алкільними групами (особливо,
метильними).
а
також при заміні водню функціональної
групи алкільними групами (особливо,
метильними).
Від типу функціональної групи і структури радикала залежить розчинність ПАР в різних розчинниках і спроможність дисоціювати на іони. ПАР, у яких функціональні групи несуть позитивний заряд, активні у кислому середовищі і неактивні у лужному, тоді як ПАР з негативно зарядженими функціональними групами, навпаки, активні у лужному і не активні у кислому середовищі. Активність щільно пов’язана з омиленням (створенням солей) ПАР і іонів.
 Наприклад,
жирні кислоти у лужному середовищі
реагують з лугом з утворенням мил:
Наприклад,
жирні кислоти у лужному середовищі
реагують з лугом з утворенням мил:
Аміни у кислому середовищі омиляються кислотами:

У воді ці і подібні їм солі нерідко дисоціюють з утворенням відповідних аніонів або катіонів
RCOONa → RCOO– + Na+
RNH3Cl → RNH+3 + Cl–
Оскільки ПАР у сольовій формі більш активні, ніж у вихідній, у техніці вони застосовуються саме у формі солей.
Поверхнево-активними речовинами щодо води є багато органічних сполук, а саме: жирні кислоти з досить великим вуглеводним радикалом; солі цих жирних кислот (мила); сульфокислоти і їх солі, спирти, аміни. Характерною рисою будови молекул більшості ПАР є їх дифільність – будова молекули з 2-х частин – полярної групи і неполярного вуглеводного радикала (рис. 4.2), що має значний дипольний момент і здатна до гідратації. Полярна група обумовлює спорідненість ПАР з водою. Гідрофобний вуглеводний радикал є причиною зниженої розчинності цих сполук у воді.
а 1
|
б 2 3 4 |
Рис. 4.3.Орієнтація поверхнево – активних молекул в адсорбційному шарі: а – на твердій поверхні; б – на поверхні розподілу неполярної рідини з полярною; 1 – тверде тіло; 2 – повітря або рідина; 3 – полярна рідина; 4 – неполярна рідина
|
В тому випадку, коли поверхня була вуглеводною, наприклад, поверхня бітуму, невелика добавка ПАР – жирної кислоти (С17Н33СООН) або жирного аміну (С17Н35NН2) може самовільно змінити її на полярну, завдяки полярним групам СООН або NН2 (рис. 4.3, б), що концентруються у верхньому шарі бітуму.
При цьому концентрація ПАР у поверхневому адсорбційному шарі може у десятки тисяч разів перевищувати концентрацію його в об’ємі навколишнього середовища (наприклад, у розчині).
Адсорбційний шар ПАР забезпечує ніби перехід між двома фазами, які межують і які протилежні за молекулярною природою. Завдяки цьому шару забезпечується тісний зв’язок між контактними тілами (адгезія).