
- •Введение Важнейшие проблемы народного хозяйства России
- •Улучшение качественных характеристик
- •Снижение себестоимости производимой промышленной продукции
- •3. Расширение масштабов технического перевооружения промышленных предприятий
- •Тема 1. Системный подход в управлении промышленными технологиями и инновациями
- •Конкурентные преимущества российской экономики.
- •Роль технологии и технологической инфраструктуры в современной экономике. Наукоемкая продукция и макротехнологии. Пути интеграции в мировой рынок наукоемкой продукции.
- •1.2. Промышленные технологии и технический прогресс
- •Физический эффект и его модель
- •Основные закономерности проявления физических эффектов
- •Модель физического эффекта
- •1.3. Конкурентоспособность промышленной продукции и пути ее достижения Потребительские свойства и цена продукции
- •Классификация технологий: по функциональному составу – технологии заготовительного, основного и вспомогательного производства
- •Классификация технологий по отраслям народного хозяйства
- •Тема 2. Конструкторская и технологическая подготовка производства
- •1. Конструкторская подготовка производства на основе cad/cam систем: классификация сапр, технические возможности, критерии выбора
- •2. Технологическая подготовка производства на основе cad/cam систем: классификация сапр, технические возможности, критерии выбора
- •Создание системы pdm на предприятии:
- •Тема 3. Промышленные технологии в машиностроении
- •3.1. Технологии переработки сырья и производство промышленных материалов Виды природных ресурсов, их запасы
- •Топливно-энергетическое сырье
- •Металлы
- •Понятие промышленных материалов
- •Стали, классификация сталей, свойства сталей
- •Маркировка стали:
- •Чугуны, классификация чугунов, свойства
- •Цветные сплавы, область применения и свойства
- •Методы и средства определения физико-механических характеристик сталей и сплавов
- •Методика выбора материала
- •Пластмассы: типы, состав, методы получения
- •Керамика, основные виды и область применения
- •Технические керамики
- •Огнеупоры
- •Применение алюминиевых керамик
- •Особенности промышленных технологий металлургического комплекса Доменное производство
- •Продукты доменной плавки
- •Производство стали Сущность процесса
- •Способы выплавки стали
- •Производство стали в электропечах
- •Дуговая плавильная печь.
- •Индукционные тигельные плавильные печи
- •Разливка стали
- •Способы повышения качества стали
- •Прокат и его производство
- •Способы прокатки
- •Технологический процесс прокатки
- •Основы порошковой металлургии
- •1. Основные свойства и классификация металлокерамических материалов
- •2. Получение металлических порошков
- •3. Получение неметаллических порошков
- •4. Формообразование заготовок и изделий из порошков
- •Проблема переработки промышленных отходов, рециклинг
- •3.2. Технологии механической, электро-физической, электро-химической и др. Видов обработки в машиностроении Машина – как объект производства. Классификация машин
- •Качество машин
- •Изделие и его элементы
- •Производственный процесс изготовления машины
- •Технологический процесс, классификация технологических процессов по ес тпп
- •Технологическая операция. Структура технологической операции
- •Заготовительное производство. Основные технологии получения заготовок: литье, ковка, штамповка Способы изготовления заготовок Выбор метода и способа получения заготовки
- •Общие принципы выбора заготовки
- •Способы изготовления отливок Изготовление отливок в песчаных формах
- •Литье в оболочковые формы
- •Литье по выплавляемым моделям
- •Литье в металлические формы
- •Изготовление отливок центробежным литьем
- •Литье под давлением
- •Изготовление отливок электрошлаковым литьем
- •Изготовление отливок непрерывным литьем
- •Способы обработки металлов давлением
- •Классификация процессов обработки давлением
- •Операции ковки
- •Предварительные операции
- •Основные операции
- •Горячая объемная штамповка
- •Формообразование при горячей объемной штамповке
- •Механическая обработка металлов и сплавов
- •Движения для осуществления процесса резания и схема обработки
- •Режим резания и геометрия срезаемого слоя
- •Инструмент для формообразования поверхностей деталей машин
- •Влияние углов резца на процесс резания
- •Физические закономерности (явления) процесса резания
- •1) Стружкообразование и виды стружек.
- •2) Усадка стружки
- •3) Силы резания
- •4) Наростообразование
- •5) Наклеп (упрочнение)
- •6) Тепловыделения в зоне резания
- •7) Трение, износ и стойкость инструмента
- •8) Вибрации при резании металлов
- •9. Точность и качество обработанной поверхности.
- •10. Производительность и выбор режима резания
- •11. Инструментальные материалы
- •Рассмотрим каждую группу материалов подробнее.
- •Металлорежущие станки
- •Классификатор металлорежущих станков ( по энимс)
- •Обработка заготовок на токарных станках
- •1. Типы станков токарной группы
- •Карусельные станки
- •Револьверные станки
- •Токарные автоматы и полуавтоматы
- •1.Станина. 2. Коробка подач. 3. Передняя бабка.
- •3. Типы токарных резцов
- •4. Принадлежности к токарным станкам
- •5. Способы закрепления заготовок
- •6. Работы, выполняемые на токарных станках
- •Обработка заготовок на фрезерных станках
- •1. Особенности процесса фрезерования
- •2. Работы, выполняемые на фрезерных станках.
- •3. Типы фрез.
- •4. Элементы режима резания.
- •5. Машинное время при фрезеровании
- •6. Схемы цилиндрического фрезерования
- •7. Типы фрезерных станков
- •8. Принадлежности к фрезерным станкам
- •9. Делительные головки
- •Обработка на сверлильных и расточных станках
- •1. Работы, выполняемые на сверлильных станках
- •2. Конструкции и геометрия осевых инструментов
- •1) Сверла
- •2) Зенкеры
- •3) Развертки.
- •3. Элементы режима резания
- •4. Типы сверлильных расточных станков
- •Обработка на строгальных, долбежных и протяжных станках
- •1. Особенности процессов строгания, долбления и протягивания
- •2. Строгание и долбление
- •2) Элементы режима резания
- •3. Протягивание
- •4. Станки строгально-протяжной группы
- •Зубонарезание
- •1. Методы нарезания зубчатых колес.
- •2. Схемы обработки методом копирования
- •1) Схема нарезания дисковой модульной фрезой
- •3) Схема нарезания зубодолбежной головкой
- •3. Схемы обработки зубчатых колес методом обкатки
- •1) Схема нарезания червячной фрезой
- •2) Схема нарезания зубодолбяком
- •3) Схема зубострогания
- •Шлифование
- •1. Особенности процесса шлифования
- •2. Характеристика и маркировка абразивного инструмента
- •1) Абразивные материалы
- •2) Зернистость абразивных материалов
- •3) Связка абразивных инструментов
- •4) Твердость абразивных инструментов
- •5) Структура абразивного инструмента
- •6) Классы точности и неуравновешенности шлифовальных кругов
- •7) Форма и размеры абразивного инструмента
- •8) Маркировка шлифовальных кругов
- •3. Основные схемы шлифования
- •1) Круглое шлифование
- •2) Плоское шлифование
- •3) Профильное шлифование
- •4. Шлифовальные станки
- •Отделочные методы обработки
- •1. Обработка абразивными инструментами
- •2. Методы отделки зубьев зубчатых колес
- •3. Обработка методами пластического деформирования
- •Электрохимические и электрофизические методы размерной обработки
- •1. Электрохимические методы
- •2. Электроэрозионные методы
- •3. Ультразвуковая обработка
- •4. Лучевые методы
- •3.3. Автоматизация технологических процессов и производств термины и определения гибких производственных систем
- •Классификация гпс
- •Гибкость гап
- •Cтруктура и уровни асу
- •Основные функции эвм в развитых гибких производствах:
- •Программное управление оборудованием
- •Различают 3 вида dnc - систем
- •Оперативное планирование гпс
- •Тема 4. Промышленные технологии топливно-энергетического комплекса Перспективы развития топливно-энергетического комплекса
- •1. Нефтяной комплекс
- •Нефтедобывающая промышленность
- •Нефтеперерабатывающая промышленность
- •Развитие транспортной инфраструктуры нефтяного комплекса
- •3. Газовая промышленность
- •5. Электроэнергетика
- •6. Атомная энергетика и ядерно-топливный цикл
- •7. Возобновляемые источники энергии и местные виды топлива
- •Тема 5. Наукоемкие промышленные технологии Нанотехнологии
- •История развития нанотехнологии.
- •Основные достижения нанотехнологии.
- •2. Наночастицы
- •3. Новейшие достижения
- •3. Промышленность и сельское хозяйство. Экология.
- •4. Освоение космоса. Информационные и военные технологии.
- •Тема 6. Основы проектирования и управления производственными системами
- •1.1. Организационные технологии проектирования производственных систем
- •Формы проектирования в зависимости от типа производства
- •Методы организационного проектирования производственной системы (пс)
- •Характеристика типов производства
- •Характеристики различных типов производства
Понятие промышленных материалов
Конструкционный материал – материал, предназначаемый для изготовления деталей машин и механизмов и способный выдержать прикладываемые к деталям нагрузки.

Рис. 7. Классификация конструкционных материалов
Под металлами понимают определенную группу элементов, расположенную в левой части Периодической таблицы Д.И.Менделеева. В технике под металлом понимают вещества, обладающие "металлическим блеском", в той или иной мере присущим всем металлам, и пластичностью. По этому признаку металлы можно легко отличить от неметаллов, например дерева, камня, стекла или фарфора.
Особенность строения металлических веществ заключается в том, что они все построены в основном из таких атомов, у которых внешние электроны слабо связаны с ядром. Это обусловливает и особый характер химического взаимодействия атомов металла, и металлические свойства. Электроны имеют отрицательный заряд, и достаточно создать ничтожную разность потенциалов, чтобы началось перемещение электронов по направлению к положительно заряженному полюсу, создающие электрический ток. Вот почему металлы являются хорошими проводниками электрического тока, а неметаллы или не являются. Слабая связь наружных электронов с ядром обусловливает химические и физические свойства металлов.
В силу указанных выше особенностей металлы и их сплавы имеют следующее атомно-кристаллическое строение. В определенных местах кристаллической решетки располагаются положительно заряженые ионы, а наружные свободные электроны создают внутри металла, как бы легкотекучую жидкость, или электронный газ, который беспорядочно движется во всех направлениях. При определенных условиях, например при создании разности потенциалов, движение электронов получает определенное направление и возникает электрический ток.
Теория металлического состояния рассматривает металл как вещество, состоящее из положительно заряженных ионов, окруженных отрицательно заряженными частицами - электронами, слабо связанными с ядром. Эти электроны непрерывно перемещаются внутри металла и принадлежат не одному какому-то атому, а всей совокупности атомов.
Таким образом, характерной особенностью атомно-кристаллического строения металлов является наличие электронного газа внутри металла, слабо связанного с положительно заряженными ионами. Легкое перемещение этих электронов внутри металла и малая их связь с атомами обусловливают наличие у металлов определенных металлических свойств (высокая электро- и теплопроводность, металлический блеск, пластичность и др.)
Все металлы можно разделить на две большие группы - черные и цветные металлы.
Черные металлы темно-серого цвета, с большой плотностью (кроме щелочноземельных) , высокой температурой плавления, и во многих случаях обладают полиморфизмом. Наиболее типичным металлом этой группы является железо.
Цветные металлы чаще всего имеют характерную окраску: красную, желтую, белую. Обладают большой пластичностью, малой твердостью, относительно низкой температурой плавления, для них характерно отсутствие полиморфизма. Наиболее типичным металлом этой группы является медь.
Все металлы - можно подразделить следующим образом:
1. Железные металлы - железо, кобальт, никель и близкий к ним по своим свойствам марганец. Кобальт, никель и марганец часто применяют как добавки к сплавам железа, а также в качестве основы для соответствующих сплавов, похожих по своим свойствам на высоколегированные стали.
2. Тугоплавкие металлы (вольфрам), температура плавления которых выше, чем железа (т.е. 1539 оС),применяют как добавки к легированным сталям, а также в качестве основы для соответствующих сплавов.
3. Редкоземельные металлы (РМЗ) - лантан, церий, неодим, празеодим и др., объединяемые под названием лантаноидов, и сходные с ними по свойствам иттрий и скандий.
4. Щелочноземельные металлы (литий, калий, натрий и др) в свободном металлическом состоянии не применяются, за исключением специальных случаев.
Цветные металлы подразделяются:
1. Легкие металлы - бериллий, магний, алюминий, обладающие малой плотностью.
2. Благородные металлы - серебро, золото, металлы платиновой группы.
3. Легкоплавкие металлы - цинк, кадмий, ртуть, олово, свинец, висмут, таллий, сурьма и элементы с ослабленными металлическими свойствами - галлий, германий.
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определённым порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решётка.
Это понятие используют для описания атомно-кристаллической структуры и является воображаемой пространственной сеткой с ионами (атомами) в узлах.
Другими словами, кристаллическая решетка это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Для упрощения пространственное изображение принято заменять схемами, где центры тяжести частиц представлены точками. В точках пересечения прямых линий располагаются атомы; они называются узлами решетки. Расстояния a, b и c между центрами атомов, находящихся в соседних узлах решетки, называют параметрами, или периодами решетки. Величина их в металлах порядка 0,1–0,7 нм, размеры элементарных ячеек — 0,2–0,3 нм.
Элементарная ячейка – элемент объёма из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл.
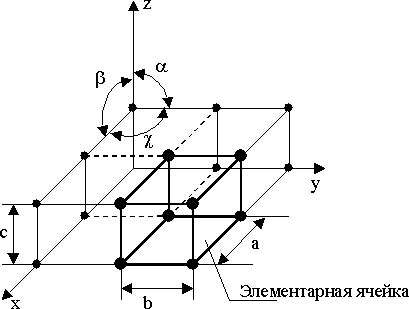

Рис. 8. Схема кристаллической решетки
Элементарная ячейка характеризует особенности строения кристалла. Основными параметрами кристалла являются
размеры рёбер элементарной ячейки. a, b, c – периоды решётки – расстояния между центрами ближайших атомов. В одном направлении выдерживаются строго определёнными.
- углы между осями (∠ α ∠ β ∠ χ ).
- координационное число (К) указывает на число атомов, расположенных на ближайшем одинаковом расстоянии от любого атома в решетке.
- базис решетки количество атомов, приходящихся на одну элементарную ячейку решетки.
- плотность упаковки атомов в кристаллической решетке – объем, занятый атомами, которые условно рассматриваются как жесткие шары. Ее определяют как отношение объема, занятого атомами к объему ячейки (для объемно-центрированной кубической решетки – 0,68, для гранецентрированной кубической решетки – 0,74)
Классификация возможных видов кристаллических решеток была проведена французским ученым О. Браве, соответственно они получили название «решетки Браве». Всего для кристаллических тел существует четырнадцать видов решеток, разбитых на четыре типа;
- примитивный – узлы решетки совпадают с вершинами элементарных ячеек;
- базоцентрированный – атомы занимают вершины ячеек и два места в противоположных гранях;
- объемно-центрированный – атомы занимают вершины ячеек и ее центр;
- гранецентрированный – атомы занимают вершины ячейки и центры всех шести граней




Рис. 9. Типы кристаллических решеток
Основными типами кристаллических решеток являются:
Объемно - центрированная кубическая (ОЦК) (см. рис.9а), атомы располагаются в вершинах куба и в его центре (V, W, Ti, Feα)
Гранецентрированная кубическая (ГЦК) (см. рис. 1.2б), атомы рассполагаются в вершинах куба и по центру куждой из 6 граней (Ag, Au, Feβ)
Гексагональная, в основании которой лежит шестиугольник:
Простая – атомы располагаются в вершинах ячейки и по центру 2 оснований (углерод в виде графита);
Плотноупакованная (ГПУ) – имеется 3 дополнительных атома в средней плоскости (цинк).
