
конспекты / ------------------
.pdf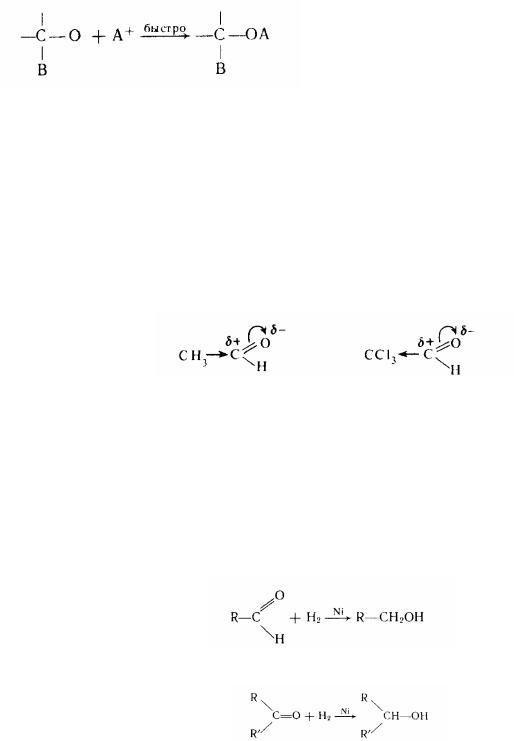
101
При взаємодії з полярними реагентами л-зв’язок карбонільною групи розривається У результаті відбувається приєднання атомів або груп атомів реагенту, що атакує, (А-В). Нуклеофільне приєднання до карбонільної групи - процес східчастий. Реакція починається з повільної атаки вуглецю карбонільною групи нуклеофілом Потім проходить швидке приєднання до аніона , що утворився , позитивно зарядженого катіона А+ (наприклад, протону):
Швидкість нуклеофільного приєднання тим вище, чим більше частковий позитивний заряд на атомі вуглецю в карбонилі. Збільшення або зменшення цього заряду залежить від природи замісників, пов'язаних із вуглецем карбонільною групи. Відомо, що электроноакцепторні (електрофільні) замісники збільшують δ + і тим самим сприяють приєднанню нуклеофільних реагентів. Навпаки, электронодонорні (нуклеофільні) замісники понижають δ + (за рахунок зсуву електронної щільності убік атома вуглецю). У результаті процес нуклеофільного приєднання утрудняється. Наприклад, оцтовий альдегід буде виявляти меншу активність у реакціях нуклеофільного приєднання, чим його трихлорзамещєний аналог - хлораль:
оцтовий альдегід |
хлораль |
Таким чином, алкільні радикали, володіючи электронодонорними властивостями, уповільнюють цю реакцію, а у хлораля (за рахунок электроноакцепторного дії групи СС1з) спостерігається збільшення реакційної спроможності карбонільного вуглецю. \Варто звернути увагу на те, що у кетонів на відміну від альдегідів із карбонільною групою пов'язано два радикали, що понижають активність молекули. Тому альдегіди мають більшу хімічну активність, чим кетони.
1. Приєднання водню (гідрування). Після приєднання водню до карбонільної групи альдегіди переходять у первинні спирти, а кетони - у вторинні:
альдегід |
первинний спирт |
кетон |
вторинний спирт |
Які відновник в цьому випадку часто застосовують літій-алюмінійгідрид LiА1Н4. Дія його вибірково. Відновлюючи карбонильну групу, він не торкає подвійний вуглець-вуглецевий зв'язок (у ненасичених альдегідах і кетонах). Реакція
102
відновлення йде за участю гідридного іона (Н-):
2. Приєднання синильної кислоти (НСN);
Отримані сполуки називаються оксинитрилами або циангидринами. Вони використовуються при одержанні гідроксикислот, амінокислот і ін.
3. Приєднання гідросульфіту натрію (NаНS0з):
За нуклеофільною атакою гидросульфіт-іона проходить приєднання протону. У цю реакцію вступають тільки ті кетони, що містять хоча б одну метильну групу:
У результаті реакцій утворюються гидросульфітні сполуки, що легко розкладаються при нагріванні з розведеними кислотами з виділенням у чистому вигляді альдегідів або кетонів. Цією реакцією часто користуються для виділення цих речовин із сумішей або з метою їхнього очищення.
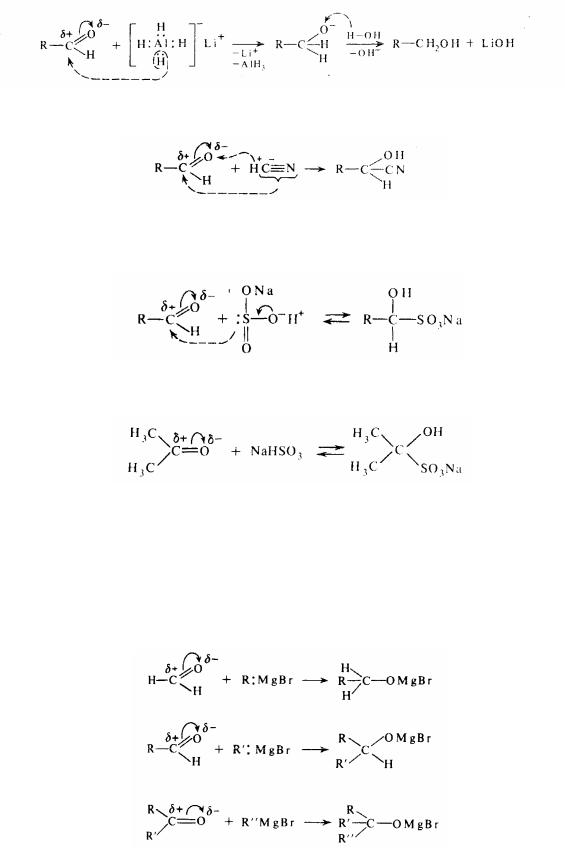
3. Приєднання магнійорганичних сполук (реактивів Гриньяра):
Органічний радикал, що іде разом із парою електронів від магнія, є потужним нуклеофілом. При розкладанні водою продуктів , що утворилися , одержують відповідно первинні, вторинні або третинні спирти:
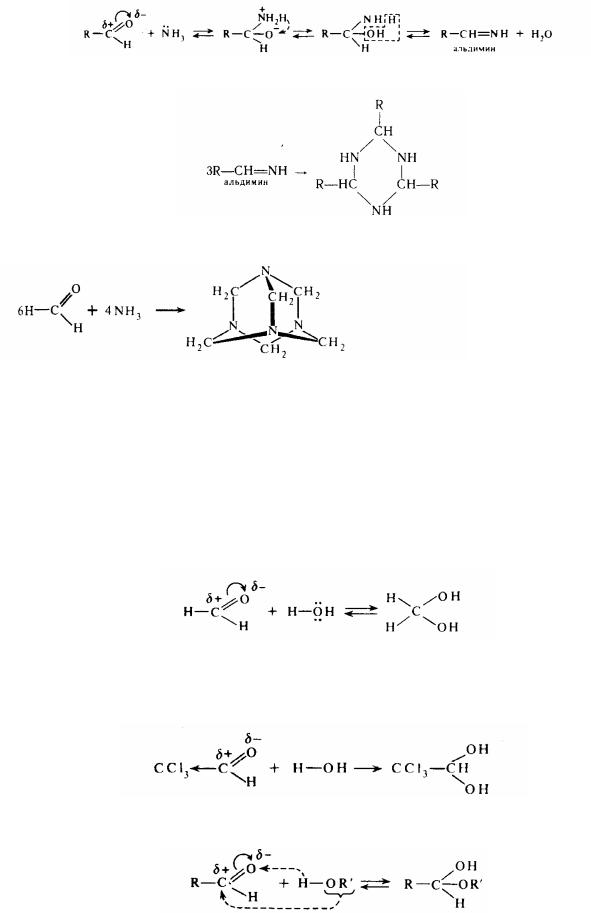
3. Приєднання аміаку:
103
Альдимін легко полімерізується (циклізується) з утворенням альдегідаміаку:
альдегідаміак
При взаємодії аміаку і мурашиного альдегіду (при легкому нагріванні)
уротропін
утворюється циклічна сполука, уперше синтезована А.М.Бутлеровим. Воно було названо уротропіном (гексаметілентетраміном). Уротропін широко використовують у виробництві високомолекулярних сполук (наприклад, фенолоформальдегідних полімерів), вибухових речовин, при вулканізації каучуку (пришвидшувач) і в медицині.
Кетони також вступають у взаємодію з аміаком, але дають більш складні продукти.
5. Приєднання води (реакція гідратації). Формальдегід легко приєднує воду,
утворюючи гідрат:
гідрат формальдегіду
Гідрати інших альдегідів і кетонів у вільному виді виділити не вдається. Проте з сильними електроноакцепторними групами (-І-ефект) альдегіди спроможні утворювати стійкі гідрати, наприклад, хлоралгідрат:
хлораль хлоральдегидрат
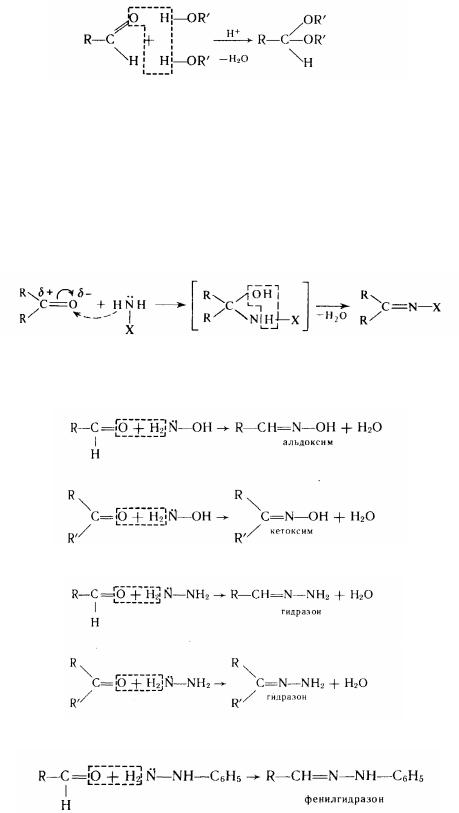
6. Приєднання спиртів. Ця реакція призводить до утворення полуацеталей:
полуацеталь
104
Полуацеталі - досить хитливі сполуки. У надлишку спирту у присутності хлороводню можна одержати повні прості ефіри гідратної форми альдегіду -
ацеталі:
ацеталь
Кетони в цих умовах ацеталей не утворюють.
Реакції заміщення.
Реакції заміщення можуть йти з заміною кисню карбонільною групи на інші атоми або групи або з заміщенням атомів водню в радикалі. Особливо цікавими і важливими є реакції заміщення карбонільного кисню. Їх можна розглядати як результат попереднього приєднання реагенту до карбонільною групи з наступним відщепленням води або іншої молекули. Наприклад
1. Утворення оксимів і гідразонів. При взаємодії альдегідів і кетонів із гідроксиламіном H2N—ОН утворюються оксими:
При взаємодії альдегідів і кетонів з гідразіном Н2N—NН2 утворяться гідразони:
Альдегіди і кетони з фенілгідразіном H2N—NН—СбН6 дають фенілгидразони:
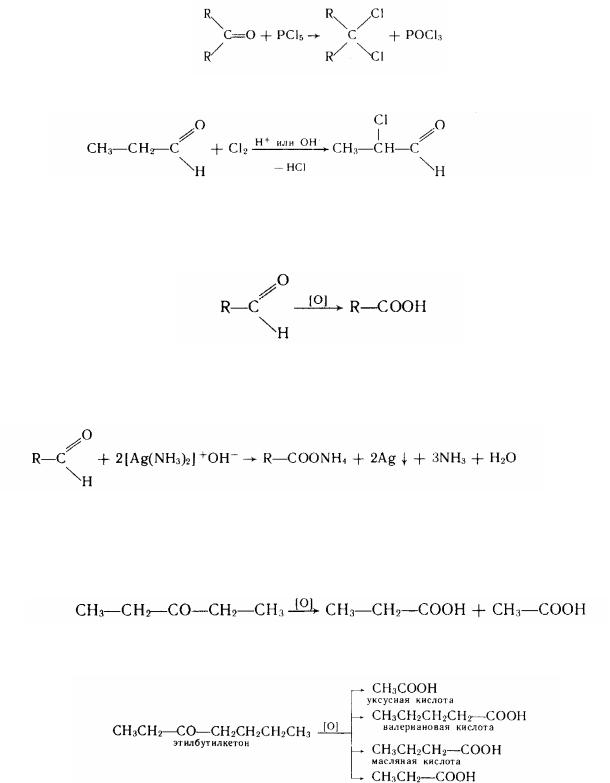
2. Заміщення карбонільного кисню хлором. Заміщення кисню карбонільною групи на хлор при дії на карбонільну сполуку РCl5 призводить до утворення гемінального дігалогенпохідного:
105
3. Заміщення на галоген водневих атомів у радикалі:
пропіоновий альдегід |
α –хлорпропіноновий альдегід |
Окислення альдегідів і кетонів.
При окисленні альдегідів утворюються відповідні карбонові кислоти:
При окисленні альдегідів аміачним розчином оксиду срібла відбувається виділення металевого срібла, при цьому срібло тонким прошарком покриває внутрішню знежирену поверхню скляної пробірки, у якій проводилася реакція. Ця характерна для альдегідів реакція відома за назвою «реакції срібного дзеркала»:
Альдегіди окислюються також фелінговою рідиною. Кетони окислюються сутужніше. Вони більш стійкі до слабких окислювачів і до кисню повітря. При дії на кетони сильних окислювачів відбувається розрив вуглецевого ланцюга й
утворення суміші різноманітних |
кислот. При окисленні |
симетричних |
кетонів |
утвориться не більш двох кислот: |
; |
|
|
|
|
|
|
діетилкетон |
пропановая кислота |
оцтова кислота |
|
а кетони з різноманітними радикалами утворять декілька: |
1 |
||
пропанова кислота
Работи А.Н.Попова й Е.Е.Вагнера дозволили встановити залежність процесу окислення кетонів (правило Попова-Вагнера). За продуктами, що отримані у процесі окислення, можна судити про будову кетонів.
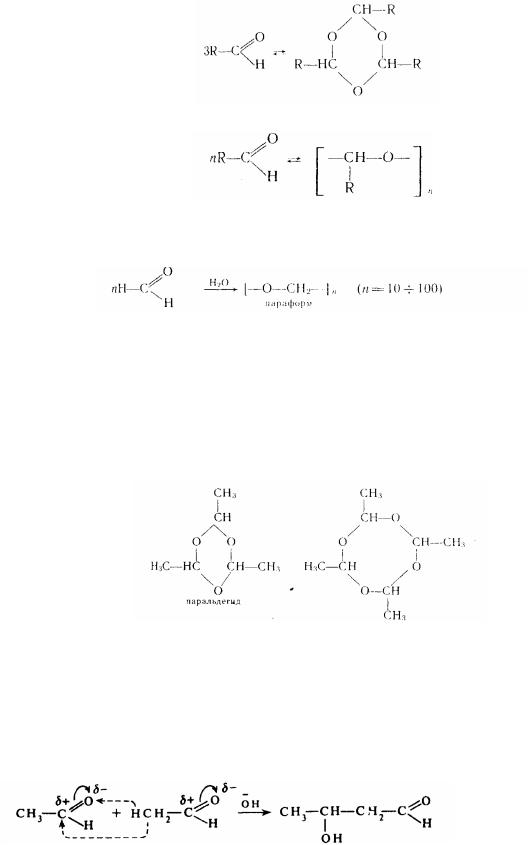
Реакції полімеризації. Ці реакції характерні тільки для альдегідів. Під впливом мінеральних кислот альдегіди спроможні полімерізоватися з утворенням циклічних продуктів:
106
або лінійних полімерних сполук:
Наприклад, мурашиний і оцтовий альдегіди спроможні утворювати лінійні і циклічні речовини. При цьому мурашиний альдегід полімерізуеться з кращим утворенням лінійного полімерного продукту - парoформа:
Мурашиний альдегід може давати і високомолекулярну сполуку -
поліформальдегід (поліметіленоксид). Цей полімер із п 1000 одержують полімеризацією абсолютно сухого формальдегіду в безводному середовищі у присутності каталізаторуа (карбоніл залоза). Поліформальдегід використовується для виробництва синтетичного волокна і різноманітних виробів.
Полімеризація альдегідів йде за іонним механізмом (катіонним або аніонним). Оцтовий альдегід під впливом слідів мінеральних кислот утворить циклічний тример (паральдегід) і тетрамер (метальдегід):
Реакції конденсації. Під впливом карбонільною групи водневі атоми сусідньої з ній метиленової групи (α -вуглецевий атом) або метильної групи, пов'язаної безпосередньо з карбонільною, у слаболужному середовищі одержують якусь рухливість (активуються). Водень у вигляді протону, відриваючись, переходить до кисню карбонільною групи іншої молекули альдегіду (або кетону), а аніон , що залишився , зв'язується з вуглецем радикалом. У результаті утворюється альдоль (оксиальдегід):
бутанол-З-аль (альдоль)
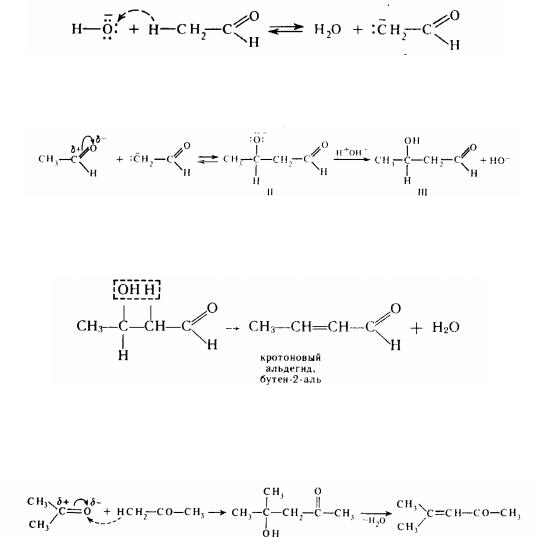
Така реакція називається альдольною конденсацією (А.П.Бородін). Механізм цієї реакції можна уявити таким чином. Каталізатор сприяє відриву протону від α -вуглецевого атома й утворенню аніона I:
107
Виниклий карбаніон, приходячи сильним нуклеофілом, приєднується до позитивно зарядженого атому вуглецю карбонільною групи іншої молекули альдегіду:
Більш складаний аніон II приєднує протон води, висвобождаючи каталізатор (ОН- ). і перетворюється в альдоль III. При нагріванні відбувається відщеплення води від альдоля й утворюється ненасичений альдегід:
Конденсація, що супроводжується відщепленням води й утворенням ненасиченого альдегіду (через альдоль), називається кротоновою конденсацією. У кротонову конденсацію можуть вступати не тільки альдегіди, але і кетони (у більш жорстких умовах):
У присутності сильних основ (лугів) альдегіди звичайно осмоляються в результаті глибокої альдольною або кротоновою поліконденсації.
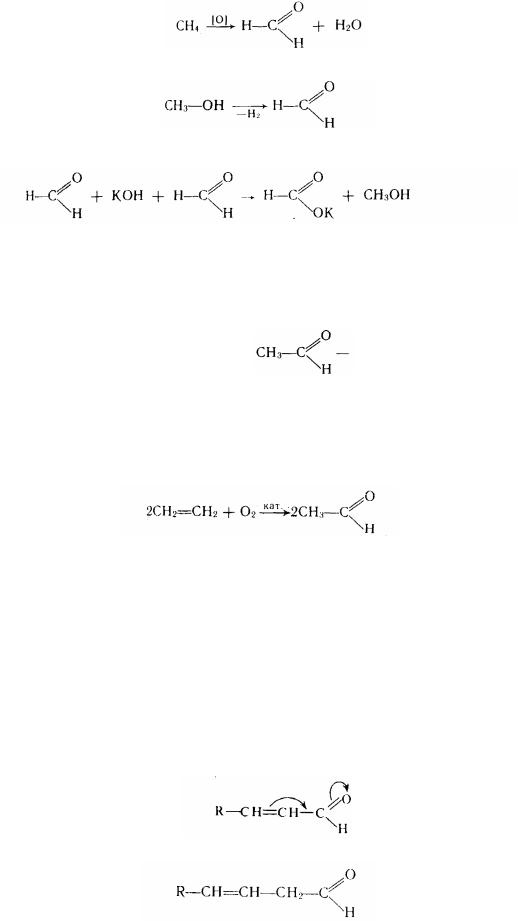
Окремі представники Формальдегід (мурашиний альдегід, або метаналь) газ із різким подразним
запахом. У промисловості формальдегід одержують неповним окислюванням метан
108
або каталітичним дегідруванням метилового спирту:
У концентрованому водно-лужному середовищі формальдегід вступає в реакцію окислення - відновлення (реакція Канниццаро):
40%-ний розчин формальдегіду називається формаліном. Формальдегід застосовується для одержання фенолоформальдегідних і карбамідних полімерів, органічних барвників, вибухових речовин, різноманітних матеріалів, що клеять, і лаків, використовується в шкіряній промисловості, а також як дезінфікуючий засіб в медицині.
Оцтовий альдегід (ацетальдегід, або етаналь)
Це рідина. У промисловості утворюється за реакцією Кучерова окисленням етилового спирту або окисленням етілену киснем повітря у присутності каталізатору (Рd-Сu):
Ацетальдегід має велике промислове значення. З нього одержують оцтову кислоту, етиловий спирт, етилацетат, бутиловий спирт, хлораль і багато інших продуктів.
Ацетон (діметилкетон, або пропанон) СНз—СО—СНз - безбарвна рідина.
Одержують окисленням ізопропилбензолу (кумолу) або ізопропилового спирту. Застосовують як розчинник лаків і фарб, використовують у виробництві кіноплівки, ацетатного шовку і т.д.
Ненасичені альдегіди і кетони
Якщо з карбонільною групою пов'язані ненасичені радикали, то такі альдегіди і кетони називають ненасиченими. При цьому подвійний зв'язок може знаходитися поруч із карбонілом:
або віддалена від її однієї або декількома метиленовими групами:
особливий інтерес подають α і β -ненасичені (сполучені) альдегіди і кетони. Найпростішими представниками таких сполук є акролеїн і кротоновій альдегід, а
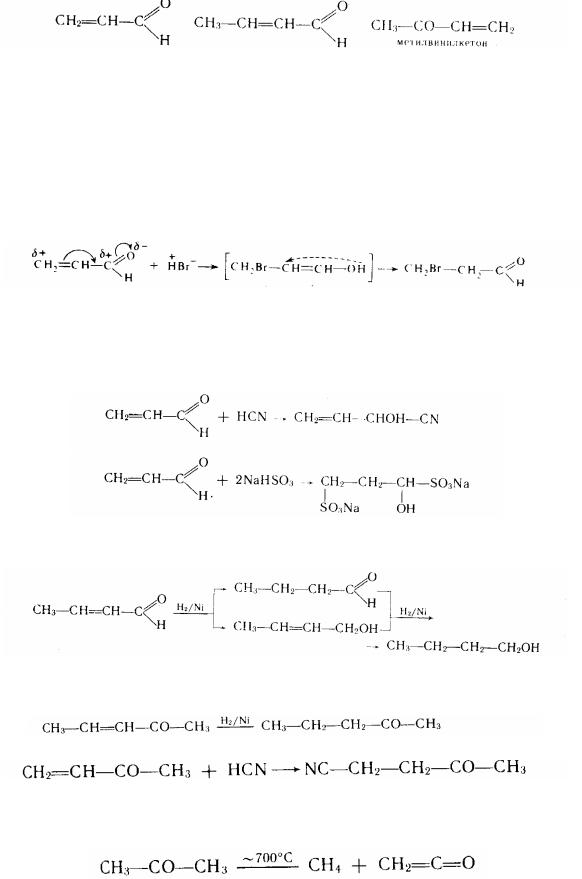
109
з ненасичених кетонів - метилвінилкетон-
акролеїн |
кротоновий альдегід |
Хімічні властивості. Ненасичені альдегіди і кетони виявляють властивості карбонільних сполук і ненасичених речовин. Проте взаємний вплив карбонільної групи і подвійного зв'язку позначається на властивостях таких сполук.
Маючи систему сполучених зв'язків С==С-С==0, вони в залежності від умов і характеру реагенту можуть приєднувати в положення 1,2; 3,4 і 1,4. Наприклад, приєднання галогеноводнів у цих сполукам йде проти правила Марковникова - відповідно до електронної поляризації молекули:
енольная форма
Хитлива єнольна форма перегруповується в стійку сполуку - альдегід.
Синильна кислота приєднується до акролеїну по карбонільній групі, а гідросульфіт натрію - по карбонільною групі і по етіленовому зв'язку:
Гідрування а,β - ненасичених альдегідів призводить до утворення насичених первинних спиртів:
а, , -ненасичені кетони в цих умовах утворяють насичені кетони:
Точно так саме приєднується до них і НСN:
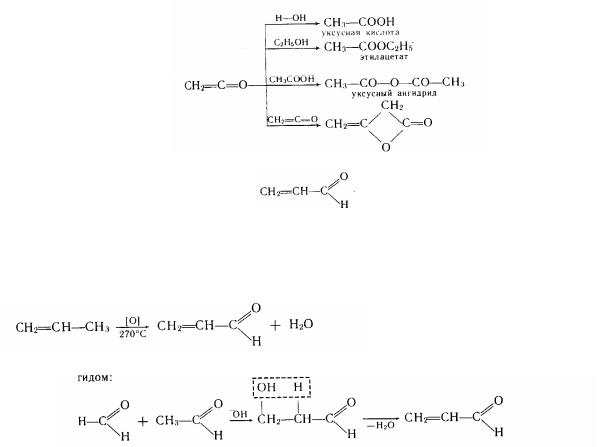
Своєрідною сполукою із кумулірованими карбонільним і етіленовим зв'язками, що нагадує за будовою ненасичені кетони, є кетен СН2=С=0, що утворюється піролізом ацетону:
Кетени відрізняються винятковою реакційною спроможністю:
110
Окремі представники.
Акролеїн (пропеналь) з різким запахом. Одержують прямим каталітичним окисленням пропилена:
або кротоновою конденсацією формальдегіду з оцтовим альдегідом
