
- •Механика Основы молекулярной физики и термодинамики
- •Курс лекций.
- •Оглавление
- •Глава 1. Кинематика материальной точки
- •Глава 2. Динамика материальной точки
- •Глава 3. Динамика твердого тела
- •Глава 4. Работа и энергия
- •Глава 5. Законы сохранения в механике
- •Глава 6. Механические волны
- •Глава 7. Молекулярное движение
- •Глава 8. Основы термодинамики
- •Глава 1. Кинематика материальной точки
- •1.1 Понятия и определения
- •Модуль вектора ускорения
- •Для самостоятельного изучения
- •1.2. Виды движения
- •При постоянной угловой скорости , угловой путь и угол поворота определяется из равенств:
- •Для самостоятельного изучения
- •Глава 2. Динамика материальной точки
- •2.1 Понятие силы. Равнодействующая сила.
- •2.2 Силы гравитационного взаимодействия
- •2.3 Силы трения
- •2.4 Сила вязкого трения и сопротивления среды.
- •2.5 Сила упругости. Закон Гука.
- •2.6 Законы Ньютона
- •2.7 Принцип относительности Галилея. Неинерциальные системы отсчета
- •2.8 Задачи динамики материальной точки.
- •2.9 Примеры решения типовых задач.
- •Глава 3. Динамика твердого тела
- •3.1. Поступательное движение
- •3.2. Вращательное движение
- •3.3. Колебательное движение
- •Глава 4. Работа и энергия
- •4.1. Работа. Мощность
- •4.2. Кинетическая энергия
- •И всегда положительна в любой системе отсчета.
- •4 Dr.3. Потенциальная энергия
- •4.4. Связь потенциальной энергии с силой
- •Для самостоятельного изучения
- •4.5. Потенциальная энергия тела относительно поверхности Земли
- •4.6. Работа силы тяжести
- •4.7. Потенциальная энергия пружины
- •4.8 Потенциальный барьер и яма
- •4.9. Работа и энергия при вращательном движении
- •4.10 Кинетическая энергия вращательного движения
- •4.11 Энергия колебательного движения тела
- •4.12 Добротность
- •Лекция 12
- •Глава 5. Законы сохранения в механике
- •5.1 Закон сохранения импульса
- •5.2 Закон сохранения момента импульса
- •При составлении равенства (5.5) учтено, чтои.
- •5.3 Закон сохранения энергии
- •Для самостоятельного изучения
- •5.4 Применение законов сохранения к упругому и неупругому соударению двух тел
- •5.4.1 Абсолютно упругий удар
- •5.4.2 Абсолютно неупругий удар
- •Глава 6. Механические волны
- •6.1 Продольные и поперечные волны
- •Уравнение плоской гармонической волны. Волновое уравнение.
- •Глава 7. Молекулярное движение
- •7.1 Размеры и масса молекул
- •7.2. Движение и столкновение молекул газа
- •7.3 Давление и температура.
- •7.4 Скорость и энергия молекул [распределение Максвелла]
- •7.5 Диффузия, внутреннее трение, теплопроводность.
- •7.6 Давление идеального газа на стенку
- •7.7 Уравнение состояния идеального газа
- •Глава 8. Основы термодинамики
- •8.1. Термодинамическая система. Внутренняя энергия идеального газа
- •8.2. Работа и теплопередача
- •8.3. Первое начало термодинамики, термодинамические изопроцессы.
- •8.4 Теплоемкость
- •Теплоемкость газов при постоянном объеме.
- •8.5 Обратимые и необратимые процессы. Термодинамическая вероятность. Энтропия.
- •8.6 Изменение энтропии в изопроцессах
- •8.7 Тепловая машина. Цикл Карно.
- •Для самостоятельного изучения
- •8.8 Второе начало термодинамики
- •Основные понятия в механике Кинематика
- •Динамика
- •Вес тела – сила, приложенная к опоре или подвесу, которые удерживают тело от свободного падения. При неподвижной опоре (подвесе) или при их равномерном движении вес тела равен силе тяжести.
- •Работа и энергия
- •Механические волны
- •Молекулярная физика
- •Термодинамика
- •Основные законы Механика
- •Молекулярная физика
- •Обозначения
- •Механика Основы молекулярной физики и термодинамики
8.4 Теплоемкость
Теплоемкость – количество тепла δQ, которое необходимо сообщить телу, чтобы повысить его температуру на один градус:
C=![]() .
.
Различают:
1) молярную теплоемкость равную количеству тепла δQ, которое необходимо сообщить киломолю вещества, чтобы повысить его температуру на один градус
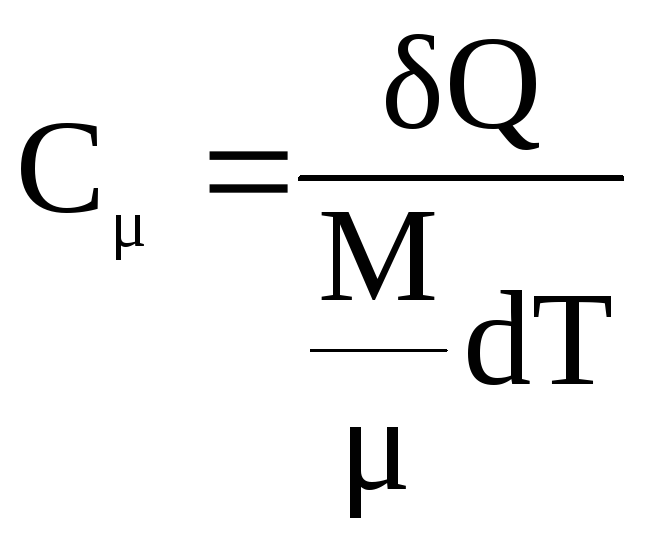 ,
(8.16)
,
(8.16)
2) массовую (удельную) теплоемкость равную количеству тепла δQ, которое необходимо сообщить единице массы вещества, чтобы повысить его температуру на один градус
![]() .
(8.17)
.
(8.17)
3) объемная теплоемкость равна количеству тепла δQ,которое нужно сообщить единице объема вещества, чтобы повысить его температуру на один градус
![]() .
.
Из сопоставления формул (8.16) и (8.17)
![]() .
.
Теплоемкость зависит от характера термодинамического процесса, при котором система получает тепло. В связи с этими вводится понятие теплоемкости при постоянном объеме Cv и давлении Сp.
Теплоемкость при постоянном объеме определяется в изохорическом процессе, при котором обмен энергией между газом и внешней средой происходит только в форме теплопередачи и подводимое тепло затрачивается лишь на изменение внутренней энергии газа.
Молярная теплоемкость при постоянном объеме
 .
.
Так как
![]() ,
то
,
то
 (8.18)
(8.18)
где R- универсальная газовая постоянная.
Молярная теплоемкость идеального газа при постоянном объеме зависит только от числа степеней свободы молекул.
Теплоемкость при постоянном давлении определяется для изобарического процесса, при котором обмен энергией происходит и в форме работы, и в форме теплопередачи. Подводимое к газу тепло затрачивается на изменение внутренней энергии газа и на совершение им работы.
Молярная теплоемкость при постоянном давлении
 .
.
Подставим в
последнее соотношение вместо PdV=![]() и
и
 ,
,
тогда
 ,
,
![]() .
(8.19)
.
(8.19)
Отношение молярных теплоемкостей при постоянном давлении и объеме
 .
.
Для одноатомных молекул газа (i=3)
![]() ,
,
для жестких двухатомных молекул (i=5)
![]() ,
,
для жестких трехатомных и многоатомных молекул (i=6)
![]() .
.
Теоретические и экспериментальные значения теплоемкости при постоянном объеме приведены в таблице 1 (см. табл).
Согласно классической теории, теплоемкость идеальных газов не зависит от температуры. Однако, теплоемкость реальных газов зависит от температуры, поэтому ее определяют для каждого интервала температур отдельно.
Возрастание теплоемкостей в реальных двухатомных и многоатомных газов с повышением температуры объясняется заметным воздействием колебательного движения атомов внутри сложных молекул на изменение их энергии, а также термической диссоциации молекул (распад сложных молекул на более простые). Затрата энергии на диссоциацию приводит к увеличению теплоемкости газов.
Таблица 1
