
- •Механика Основы молекулярной физики и термодинамики
- •Курс лекций.
- •Оглавление
- •Глава 1. Кинематика материальной точки
- •Глава 2. Динамика материальной точки
- •Глава 3. Динамика твердого тела
- •Глава 4. Работа и энергия
- •Глава 5. Законы сохранения в механике
- •Глава 6. Механические волны
- •Глава 7. Молекулярное движение
- •Глава 8. Основы термодинамики
- •Глава 1. Кинематика материальной точки
- •1.1 Понятия и определения
- •Модуль вектора ускорения
- •Для самостоятельного изучения
- •1.2. Виды движения
- •При постоянной угловой скорости , угловой путь и угол поворота определяется из равенств:
- •Для самостоятельного изучения
- •Глава 2. Динамика материальной точки
- •2.1 Понятие силы. Равнодействующая сила.
- •2.2 Силы гравитационного взаимодействия
- •2.3 Силы трения
- •2.4 Сила вязкого трения и сопротивления среды.
- •2.5 Сила упругости. Закон Гука.
- •2.6 Законы Ньютона
- •2.7 Принцип относительности Галилея. Неинерциальные системы отсчета
- •2.8 Задачи динамики материальной точки.
- •2.9 Примеры решения типовых задач.
- •Глава 3. Динамика твердого тела
- •3.1. Поступательное движение
- •3.2. Вращательное движение
- •3.3. Колебательное движение
- •Глава 4. Работа и энергия
- •4.1. Работа. Мощность
- •4.2. Кинетическая энергия
- •И всегда положительна в любой системе отсчета.
- •4 Dr.3. Потенциальная энергия
- •4.4. Связь потенциальной энергии с силой
- •Для самостоятельного изучения
- •4.5. Потенциальная энергия тела относительно поверхности Земли
- •4.6. Работа силы тяжести
- •4.7. Потенциальная энергия пружины
- •4.8 Потенциальный барьер и яма
- •4.9. Работа и энергия при вращательном движении
- •4.10 Кинетическая энергия вращательного движения
- •4.11 Энергия колебательного движения тела
- •4.12 Добротность
- •Лекция 12
- •Глава 5. Законы сохранения в механике
- •5.1 Закон сохранения импульса
- •5.2 Закон сохранения момента импульса
- •При составлении равенства (5.5) учтено, чтои.
- •5.3 Закон сохранения энергии
- •Для самостоятельного изучения
- •5.4 Применение законов сохранения к упругому и неупругому соударению двух тел
- •5.4.1 Абсолютно упругий удар
- •5.4.2 Абсолютно неупругий удар
- •Глава 6. Механические волны
- •6.1 Продольные и поперечные волны
- •Уравнение плоской гармонической волны. Волновое уравнение.
- •Глава 7. Молекулярное движение
- •7.1 Размеры и масса молекул
- •7.2. Движение и столкновение молекул газа
- •7.3 Давление и температура.
- •7.4 Скорость и энергия молекул [распределение Максвелла]
- •7.5 Диффузия, внутреннее трение, теплопроводность.
- •7.6 Давление идеального газа на стенку
- •7.7 Уравнение состояния идеального газа
- •Глава 8. Основы термодинамики
- •8.1. Термодинамическая система. Внутренняя энергия идеального газа
- •8.2. Работа и теплопередача
- •8.3. Первое начало термодинамики, термодинамические изопроцессы.
- •8.4 Теплоемкость
- •Теплоемкость газов при постоянном объеме.
- •8.5 Обратимые и необратимые процессы. Термодинамическая вероятность. Энтропия.
- •8.6 Изменение энтропии в изопроцессах
- •8.7 Тепловая машина. Цикл Карно.
- •Для самостоятельного изучения
- •8.8 Второе начало термодинамики
- •Основные понятия в механике Кинематика
- •Динамика
- •Вес тела – сила, приложенная к опоре или подвесу, которые удерживают тело от свободного падения. При неподвижной опоре (подвесе) или при их равномерном движении вес тела равен силе тяжести.
- •Работа и энергия
- •Механические волны
- •Молекулярная физика
- •Термодинамика
- •Основные законы Механика
- •Молекулярная физика
- •Обозначения
- •Механика Основы молекулярной физики и термодинамики
7.4 Скорость и энергия молекул [распределение Максвелла]
Для простоты рассмотрения движения молекул. Примем:
а) соударения молекул газа происходят как соударения упругих шаров;
б) размеры молекул пренебрежительно малы по сравнению с объемом, занимаемым газом;
в) между молекулами не проявляются силы взаимного притяжения.
Газ в котором выполняются эти условия называется идеальным. Реальным приближением к этой простейшей системе являются газы при низких давлениях и не очень низких температурах. Идеальным можно считать воздух, азот, кислород, гелий и водород при обычных условиях.
Из предположения хаотичности молекулярного движения следует, что скорости молекул идеального газа могут принимать любые значения в пределах от 0 до ∞, Что определяет непрерывность функции распределения молекул по скоростям. Максвеллом в 1859 г. теоретически найдена функция распределения молекул по скоростям и энергиям, которая позволяет вычислять число молекул, находящихся в единице объема газа, скорость которых лежит в единичном интервале скоростей dυ в окрестности заданной скорости υ. Функция распределения имеет вид
![]() ,
(7.5)
,
(7.5)
где k – постоянная Больцмана, равная 1,38·10-23 Дж/К.
При некотором значении скорости функция распределения проходит через максимум (рис. 7.6). Скорость, соответствующая максимуму функции распределения, называется вероятной скоростью
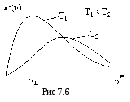
![]() ,
,
Средняя скорость молекул
![]() ,
,
Среднеквадратичная скорость молекул
![]()
Распределение молекул по энергиям поступательного движения
 (7.6)
(7.6)
где
![]() .
.
Наряду
с поступательным движением возможно
вращение и колебание молекул. На
каждую поступательную и вращательную
степень свободы приходится энергия
теплового движения
![]() ,
колебательную –kT.
,
колебательную –kT.
Числом степеней свободы материального объекта называется количество независимых координат, которые необходимо задать, чтобы однозначно определить положение этого объекта относительно рассматриваемой системы отсчета.
Так, положение материальной точки в пространстве определяется тремя координатами х, у, z. Следовательно, материальная точка обладает тремя степенями свободы. Твердое тело имеет шесть степеней свободы: координаты х, у, z определяют положение центра масс, углы θ, φ,ψ – вращение тела вокруг оси x, y, z.
Система из N материальных точек, между которыми нет жестких связей, имеет 3 N степеней свободы. Двухатомная молекула с жесткой связью между атомами имеет пять степеней свободы: три поступательные и две вращательные.
Трех- и многоатомные молекулы с жесткой связью имеют, как и твердое тело, шесть степеней свободы.
Двухатомная молекула с упругой связью между атомами имеет шесть степеней свободы: координаты х, у, г определяют положение центра инерции, углы θ и φ— положение оси системы, l — расстояние между молекулами.
Распределение энергии по степеням свободы остается справедливым, пока кинетическая энергия частиц является квадратичной функцией скорости (нерелятивистское приближение), а потенциальная — квадратичной функцией координат (малые гармонические колебания).
Энергия хаотического теплового движения одной молекулы
![]() ,
,
где i — сумма числа поступательных, вращательных и удвоенного числа колебательных степеней свободы молекулы.
