
- •Глава 2. Молекулы
- •Механическая модель физической молекулы
- •Подходы к построению волновой функции
- •Вопросы для самоконтроля
- •2.1. Метод вс
- •2.1.1. Построение базисного набора
- •2.1.2. Описание молекулы водорода методом вс
- •Симметрия волновой функции
- •Энергетические характеристики молекулы водорода
- •Влияние межъядерного расстояния
- •2.1.3. Общая формулировка метода вс
- •2.1.4. Теория резонанса
- •Вопросы для самоконтроля
- •2.2. Метод мо
- •2.2.1. Молекулярные орбитали
- •Вопросы для самоконтроля
- •2.2.2. Описание молекулы водорода методом мо
- •Вычисление энергии в методе мо
- •Орбитальные энергии
- •Конфигурационное взаимодействие
- •2.2.3. Общая формулировка метода мо
- •Канонические мо
- •Локальные характеристики молекулы в методе кмо
- •Электронная плотность атомов
- •Порядок химической связи
- •Индекс свободной валентности
- •Молекулярные диаграммы
- •Поляризуемости
- •Вопросы для самоконтроля
- •2.2.4. Метод мо Хюккеля
- •Молекула этилена
- •Молекула циклобутадиена
- •Общие решения в методе Хюккеля
- •Молекулы с гетероатомами в методе мох
- •Система параметров Стрейтвизера
- •Вопросы для самоконтроля
- •2.2.5. Метод лмо
- •Гибридизация ао
- •Эффекты сопряжения
- •Индуктивные эффекты
- •Вопросы для самоконтроля
- •2.3. Ядерный остов молекул
- •Вопросы для самоконтроля
- •2.4. Спиновые состояния ядерного остова
- •Вопросы для самоконтроля
- •Рекомендуемая литература Основная
- •Дополнительная
- •Типовые задачи
Молекулы с гетероатомами в методе мох
Рассмотрим два однотипных фрагмента некоторой молекулы, один из которых состоит только из одинаковых атомов углерода, а во втором один из этих атомов замещен другим (Х):

В результате такой замены произойдет изменение в значениях некоторых параметров орбитальной модели, а именно:
а) кулоновский интеграл атома С заменится на кулоновский интеграл гетероатома (Сr)(Xr) ;
б) резонансные интегралы, характеризующие связи атома Сrсо своими соседями заменятся на интегралы, характеризующие связи углерод–гетероатом(Cq–Cr)(Cq–Xr) и(Cr–Cs)(Xr–Cs).
В методе МОХ предполагается, что новые интегралы (X) и(C–Х) могут быть выражены через известные величины(С) и(C–С) посредством введения некоторых поправокhиK:
(X) =(С) +h(CС) и(C–Х) =K(C–С)
В результате, проблема учета наличия в молекуле гетероатомов сводится к простому видоизменению матрицы и определителя Хюккеля при сохранении методики выполнения расчетов:
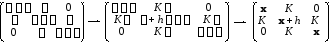
Далее решение проводится как обычно.
Параметры гетероатомов (Kиh) подбираются эмпирически. Существует несколько согласованных систем таких параметров. Наиболее употребительной их них является т.н. "система Стрейтвизера". В этой системе гетероатомы разделяют на два типа: а) участвующие в образовании-связи непосредственно; б) участвующие за счет мезомерного эффекта (n--типа).
Система параметров Стрейтвизера
|
Атом |
Тип связи |
h |
K |
|
C |
любой |
0 |
1 |
|
O |
>C=O >C=C—O: |
1,0 2,0 |
1,0 0,8 |
|
N |
>C=N– >C=C—N: |
0,5 1,5 |
1,0 0,8 |
|
S |
>C=S >C=C—S: |
0,4 1,3 |
1,0 0,6 |
|
F Cl Br I |
>C=C—F: >C=C—Cl: >C=C—Br: >C=C—I: |
3,0 2,0 1,5 1,3 |
0,7 0,4 0,3 0,25 |
Можно заметить, что величины параметра hсвязаны с электроотрицательностями атомов, а величины параметровK— с различиями в размерах гетероатома и атома углерода, которые влияют на эффективность перекрывания АО соседних атомов.
Рассмотрим несколько примеров.
Молекула винилхлоридаН2С=СН–Cl в качестве гетероатома содержит хлор, для которого параметры Стрейтвизера равны:h= 2,0 иK= 0,4. Матрица Хюккеля, характеристическое уравнение и его корни имеют вид:
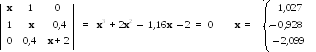
Хюккеллевские МО удобно выражать в матричной форме (i— заселенностьi-ой МО):
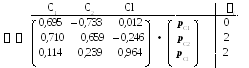
С помощью этой матрицы можно вычислить характеристики молекулы.
|
Атом |
Средняя электронная плотность |
Число поставляемых электронов |
Локальный заряд |
Порядок -связи |
|
С1 |
1,034 |
1 |
– 0,034 |
0,990 |
|
С2 |
0,983 |
1 |
+ 0,017 | |
|
0,137 | ||||
|
Cl |
1,980 |
2 |
+ 0,020 |
Молекулярная диаграмма (порядки связей указаны с учетом ‑связей) имеет вид:
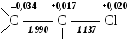
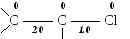
Для сравнения справа приведена молекулярная диаграмма, соответствующая классической структурной формуле молекулы винилхлорида. Легко заметить, что между классической и хюккелевской диаграммами имеются различия: изменены порядки связей и заряды атомов. С физической точки зрения, эти изменения можно рассматривать как результат "смещения" электронной плотности от атома хлора к этиленовому фрагменту. Это, разумеется, не настоящее смещение, а просто поправка, которую необходимо ввести в классическую формулу, чтобы согласовать ее с реальным распределением электронной плотности.
Такое "смещение" принято изображать кривыми стрелками, указывающими его направление. Результат введения такой поправки можно также отразить посредством т.н. неклассической структурной формулы, в которой отмечены такие особенности, как нецелочисленный порядок связей и наличие зарядов на атомах.
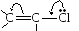
Отличие реальной электронной структуры молекулы от классической формулы часто обозначается терминами "мезомерный эффект" или "эффект сопряжения". Необходимость в учете таких "эффектов" химики установили на основе экспериментального изучения реакционной способности молекул и независимо от квантовой механики. Однако, метод Хюккеля (и другие, более точные методы квантовой химии) позволяют не только установить наличие такие "эффектов", но описать их количественно. (Нужно подчеркнуть, что указанные на диаграмме заряды атомов обусловлены только -электронами.).
Располагая значениями орбитальных энергий, можно построить корреляционную диаграмму для молекулы винилхлорида

С помощью этой диаграммы можно оценить не только прочность ‑связей в молекуле, но и величину поправки на "эффект сопряжения". Так, если бы электронная пара атома хлора не участвовала в образовании‑электронного облака, то оно было бы образовано только двумя электронами атомов углерода, и имело бы точно такой же вид, как в молекуле этилена. Энергия делокализации этих двух‑электронов, была бы равна 2. Энергия неподеленной электронной пары атома хлора была бы равна 22. Суммарная энергия составила бы 6. По корреляционной диаграмме легко подсчитать, что энергия делокализации 4-х электронов в реальной молекуле составляет 20,928+ 22,099= 6,053. В результате получим разницу в 0,053, что и составит т.н. "энергию сопряжения" или "энергию резонанса". Величина такой поправки характеризует степень снижения реакционной способности молекулы относительно тех предсказаний, что дает нам классическая теория строения. Так, например, хорошо известно, что атомы галогенов в винилхлориде замещаются гораздо труднее, чем в насыщенной молекуле этилхлорида. Это обстоятельство хорошо согласуется с порядками связей С–Cl:Р= 1,137 в винилхлориде иР= 1,000 в этилхлориде. Известно и множество других экспериментально обнаруженных особенностей в химическом поведении молекул, находящих объяснение с помощью метода Хюккеля.
Сероокись углерода, O = С = S. В этой молекуле имеется две системы-связей, которые расположены во взаимно перпендикулярных плоскостях — вертикальной и горизонтальной (точками обозначены электроны):
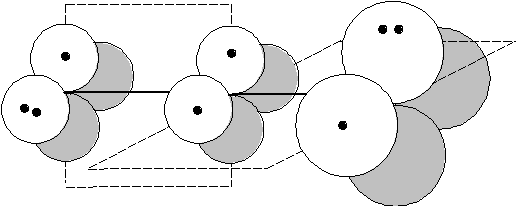
Каждую систему следует рассматривать отдельно.
Первая система (вертикальная плоскость) может быть изображена так:

В этом случае хюккелевская матрица, характеристическое уравнение и его корни имеют вид:
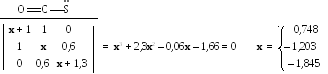
Коэффициенты МО можно выразить в матричной форме:
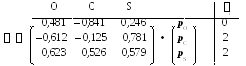
Располагая коэффициентами МО и их заселенностями, можно вычислить локальные характеристики молекулы для первой подсистемы.
|
Атом |
Средняя электронная плотность |
Число поставляемых электронов |
Локальный заряд |
Порядок -связи |
|
O |
1,525 |
1 |
– 0,525 |
0,808 |
|
С |
0,585 |
1 |
+ 0,415 | |
|
0,414 | ||||
|
S |
1,889 |
2 |
+ 0,111 |
Вторая система (горизонтальная плоскость) имеет вид:
В этом случае хюккелевская матрица, характеристическое уравнение и его корни выглядят таким образом:
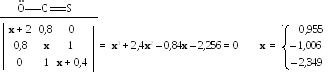
Коэффициенты МО можно выразить в матричной форме:
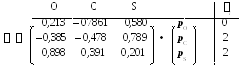
Располагая коэффициентами МО и их заселенностями, можно вычислить локальные характеристики молекулы для первой подсистемы.
|
Атом |
Средняя электронная плотность |
Число поставляемых электронов |
Локальный заряд |
Порядок -связи |
|
O |
1,909 |
2 |
+ 0,091 |
0,334 |
|
С |
0,763 |
1 |
+ 0,237 | |
|
0,911 | ||||
|
S |
1,326 |
1 |
– 0,326 |
Для того чтобы найти суммарные параметры молекулы, необходимо сложить величины, соответствующие отдельным подсистемам:
|
Атом |
Средняя электронная плотность |
Число поставляемых электронов |
Локальный заряд |
Порядок -связи |
|
O |
3,434 |
3 |
– 0,434 |
1,142 |
|
С |
1,348 |
2 |
+ 0,652 | |
|
1,325 | ||||
|
S |
3,215 |
3 |
– 0,215 |
Теперь можно построить суммарные диаграммы — молекулярную:
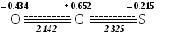
и корреляционную:

В заключение следует отметить, что у метода Хюккеля имеется ряд существенных недостатков, которые ограничивают область его применимости. Во-первых, это возможность расчета только -электронных свойств молекул. Во-вторых, полуэмпиричность метода приводит к необходимости экспериментального определения величины резонансного интеграла. Опыт показывает, что оценки этой величины, получаемые данных различных экспериментальных методов, плохо согласуются между собой. В результате, для каждой конкретной задачи приходится подбирать свое собственное значение этого интеграла.
