
- •Глава 2. Молекулы
- •Механическая модель физической молекулы
- •Подходы к построению волновой функции
- •Вопросы для самоконтроля
- •2.1. Метод вс
- •2.1.1. Построение базисного набора
- •2.1.2. Описание молекулы водорода методом вс
- •Симметрия волновой функции
- •Энергетические характеристики молекулы водорода
- •Влияние межъядерного расстояния
- •2.1.3. Общая формулировка метода вс
- •2.1.4. Теория резонанса
- •Вопросы для самоконтроля
- •2.2. Метод мо
- •2.2.1. Молекулярные орбитали
- •Вопросы для самоконтроля
- •2.2.2. Описание молекулы водорода методом мо
- •Вычисление энергии в методе мо
- •Орбитальные энергии
- •Конфигурационное взаимодействие
- •2.2.3. Общая формулировка метода мо
- •Канонические мо
- •Локальные характеристики молекулы в методе кмо
- •Электронная плотность атомов
- •Порядок химической связи
- •Индекс свободной валентности
- •Молекулярные диаграммы
- •Поляризуемости
- •Вопросы для самоконтроля
- •2.2.4. Метод мо Хюккеля
- •Молекула этилена
- •Молекула циклобутадиена
- •Общие решения в методе Хюккеля
- •Молекулы с гетероатомами в методе мох
- •Система параметров Стрейтвизера
- •Вопросы для самоконтроля
- •2.2.5. Метод лмо
- •Гибридизация ао
- •Эффекты сопряжения
- •Индуктивные эффекты
- •Вопросы для самоконтроля
- •2.3. Ядерный остов молекул
- •Вопросы для самоконтроля
- •2.4. Спиновые состояния ядерного остова
- •Вопросы для самоконтроля
- •Рекомендуемая литература Основная
- •Дополнительная
- •Типовые задачи
Вопросы для самоконтроля
1. Сформулируйте приближения, используемые в методе Хюккеля. Почему метод Хюккеля не требует выполнения итерационной процедуры при решении уравнений Хартри-Фока-Рутана?
2. Какие закономерности в рядах линейных полиенов и аннуленов можно выявить с помощью метода Хюккеля?
3. Дайте определение понятий "ароматичность" и "антиароматичность" в методе Хюккеля, сформулируйте "правило Хюккеля". Какими характерными химическими свойствами отличаются ароматические и антиароматические молекулы?
4. Каким образом метод Хюккеля можно распространить на гетероатомные молекулы? Каков физический смысл вводимых поправок hиK?
5. Дайте определение понятий "мезомерный эффект" и "эффект сопряжения". Как эти эффекты можно оценить количественно?
2.2.5. Метод лмо
Рассмотренный выше метод канонических молекулярных орбиталей (КМО) отличается тем, что он плохо согласуется с классическими структурными представлениями о молекуле, как совокупности атомов, связанных бинарными химическими связями. Строго говоря, в методе КМО отсутствуют даже сами понятия "атом" и "химическая связь". Поэтому были разработаны и другие варианты метода МО, более адаптированные к классическим структурным моделям молекулы. Одним из них является метод локализованных молекулярных орбиталей (ЛМО).
В основе метода ЛМО лежит предположение о том, что любую молекулу можно построить из двух фрагментов:
XnA* + *BYmXnA—BYm
Предполагается также, что реакционная способность фрагментов локализована на отдельных химически ненасыщенных атомах A* и *B, так что в результате их химического взаимодействия образуется бинарная и локализованная связьA—B. При этом остальные фрагменты молекулы (группыXиY) сами не изменяются и не влияют на взаимодействие атомов А и В. В результате такого представления оказывается возможным описать в рамках метода МО только фрагмент молекулы, включающий два выделенных атома и химическую связь между ними, абстрагируясь от остальных ее частей. Затем процедура описания поочередно повторяется для всех остальных связей. Другими словами, в методе ЛМО вместо одной глобальной модели молекулы получается множество локальных моделей — по одной для каждой химической связи (пары связанных атомов). Эти модели удобны еще и тем, что они являются двухэлектронными, так как при образовании каждой связи изменяется состояние только двух электронов (см. выше описание молекулы Н2):
–А• •В– –А: В–
Очевидно, что построение таких локальных моделей гораздо проще, чем глобальной КМО-модели. При взаимодействии двух атомов (А и В), поставляющих по одному электрону, каждый из которых находится на своей атомной орбитали (АиB, соответственно), волновая функция молекулы получается в виде определителя Слэтера:Ф= ||12||, где молекулярные орбитали (1и2) имеют универсальную форму:
1 = C11 A + C12 B 2 = C21 A – C22 B

Для разных типов взаимодействующих атомов все отличия сводятся к конкретным значениям коэффициентов Сij. Другими словами, во всех случаях образуется одна безузловая МО и одна МО с единственным узловой поверхностью, расположенной между ядрами взаимодействующих атомов.
Энергетические и корреляционные диаграммы разных двухатомных молекул также выглядят в качественном отношении одинаково.

Можно заметить, что одна из МО (безузловая) всегда имеет энергию ниже, чем у любой из базисных АО, тогда как энергия второй МО всегда выше. Поэтому переход электрона с АО на безузловую МО (1) сопровождается уменьшением энергии и возрастанием устойчивости молекулы. Напротив, переход электрона с АО на МО с узлом (2) сопровождается возрастанием энергии и снижением устойчивости молекулы. По этой причине первая МО обычно называетсясвязывающей, а вторая —разрыхляющей.
Ввиду локального характера ЛМО, их симметрия также описывается локальным образом — относительно ТГС не всей молекулы, а лишь ее двухатомного фрагмента. Такие фрагменты всегда имеют одну и ту же аксиальную симметрию. ЛМО, соответствующие различным типам симметрии (неприводимым представлениям) в этом случае имеют в поперечном разрезе следующий вид:

Здесь легко усмотреть аналогию с шаровыми АО s-,p-,d-типов, из которых данные ЛМО и образуются. Отсюда следует важный вывод: при образовании химической связи состояния электронов взаимодействующих атомов должны относиться к одному типу симметрии. В противном случае интеграл перекрывания будет равен нулю и взаимодействие атомов не приведет к образованию химической связи. В этом отношении часто говорят об "эффективных" и "неэффективных" способах перекрывания АО.
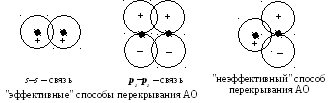
Таким образом, модель электронной оболочки молекулы в методе ЛМО выглядит следующим образом.
1. Каждой химической связи (валентному штриху, льюисовской связывающей электронной паре) сопоставляется орбитальная модель, включающая две ЛМО: а) связывающую(не имеющую узлов), с пониженной энергией, заселенную электронной парой, б)разрыхляющую(с одним узлом), с повышенной энергией, не заселенную электронами (вакантную).
2. В случае кратных связей между двумя атомами, каждая связь считается независящей от остальных и описывается отдельно. Например, для молекулы этилена корреляционная диаграмма имеет вид:
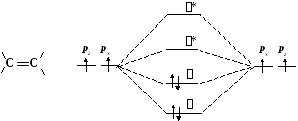
3. У некоторых атомов остаются электроны, не участвующие в образовании связывающих пар — несвязывающиеилинеподеленныеэлектронные пары. Такие электроны описываются локализованными АО, не участвующими в линейных комбинациях с другими АО. Некоторым атомам приписываются вакантные АО, также не участвующие в линейных комбинациях с другими АО. Такие АО называютсялакунами. Примерами таких молекул могут служить соединения трехвалентного азота и бора:

Главное достоинство метода ЛМО заключается в его почти полном соответствии классическим структурным представлениям, когда молекула рассматривается как совокупность атомов, связанных бинарными химическими связями. Классический подход к строению молекулы сохраняется и в электронной теории Льюиса, где в структурной модели молекулы валентные штрихи заменяются связывающими электронными парами, и, кроме того, добавляются неподеленные электронные пары и лакуны. В методе ЛМО связывающим электронным парам сопоставляется связывающая ЛМО, а неподеленным парам и лакунам — атомные орбитали.

Другими словами, модель ЛМО можно рассматривать как развитие и усовершенствование классической теории химического строения молекул.
В результате введения модели ЛМО химики получают возможность решать ряд важных задач:
1) обсуждать и объяснять химические свойства молекул, установленные экспериментально;
2) интерпретировать классические структурные характеристики молекулы с учетом движения электронов и квантовомеханических законов,;
3) ввести и использовать новые характеристики химических связей, такие как: а) симметрия и узловая структура электронного облака; б) тип связи: -,-,- связи,s-s,s-p,p-p-связи и т.д.; в) частичные электрические заряды атомов; г) порядки связи; д) индексы свободной валентности; е) поляризуемости различных типов и др.;
4) интерпретировать квантовомеханические понятия и численные параметры орбитальной модели на основе экспериментальных химических данных.
По сравнению с методом КМО, модель ЛМО имеет ряд существенных недостатков. Во-первых, она явным образом противоречит квантовой механике, утверждающей, что всякий электрон в составе молекулы должен двигаться во всем ее объеме и не может быть локализован в окрестности только двух ядер. Второй, наиболее важный, момент заключается в том, что во многих случаях простая модель ЛМО приводит к противоречию с опытом, что требует введения многочисленных поправок и дополнений в структурную модель молекулы, получаемую в рамках метода ЛМО. Рассмотрим два типа таких поправок.
